名校
解题方法
1 . 甲醇是重要的化工原料,发展前景广阔。研究表明CO2加氢可以合成甲醇。CO2和H2可发生如下两个反应:
Ⅰ.

Ⅱ.

(1)有利于提高反应Ⅰ中CO2的平衡转化率的措施有______ (填序号)。
a.使用催化剂 b.加压 c.增大CO2和H2的初始投料比
(2)研究温度对于甲醇产率的影响。在210℃~290℃,保持原料气中CO2和H2的投料比不变,按一定流速通过催化剂甲,主要发生反应Ⅰ,得到甲醇的实际产率、平衡产率与温度的关系如图。
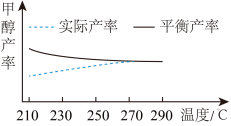
则
______ 0(填>、=或<),其依据是____________________ 。
(3)某实验控制压强一定,CO2和H2初始投料比一定,按一定流速通过催化剂乙,经过相同时间测得如下实验数据(反应未达到平衡状态)
(注:甲醇选择性是指转化的CO2中生成甲醇的百分比)
表中实验数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是_____________ 。
Ⅰ.


Ⅱ.


(1)有利于提高反应Ⅰ中CO2的平衡转化率的措施有
a.使用催化剂 b.加压 c.增大CO2和H2的初始投料比
(2)研究温度对于甲醇产率的影响。在210℃~290℃,保持原料气中CO2和H2的投料比不变,按一定流速通过催化剂甲,主要发生反应Ⅰ,得到甲醇的实际产率、平衡产率与温度的关系如图。

则

(3)某实验控制压强一定,CO2和H2初始投料比一定,按一定流速通过催化剂乙,经过相同时间测得如下实验数据(反应未达到平衡状态)
T(K) | CO2实际转化率(%) | 甲醇选择性(%)注 |
543 | 12.3 | 42.3 |
553 | 15.3 | 39.1 |
表中实验数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是
您最近一年使用:0次
名校
解题方法
2 . 乙醇与水催化反应可以制得氢气。
(1)已知: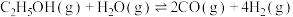
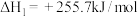 ,回答下列问题:
,回答下列问题:
①升温,平衡_______ 移动(填“向左”、“向右”、“不”);
②与原平衡相比较,增大压强,新平衡时
_______ (填“增大”、“减小”、“不变”,下同);
③恒温、恒容条件下。加入水蒸气,转化率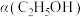
_______ ;
④恒温、恒压条件下,加入稀有气体,体积分数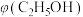
_______ 。
(2)乙醇与水催化制氢同时发生以下三个反应,回答下列问题:
反应I: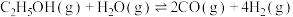
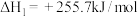
反应II:

反应III:

则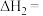
_______  。
。
(3)压强为100kPa, 的平衡产率与温度、起始时
的平衡产率与温度、起始时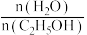 的关系如图所示,x、y、z三条曲线上的点都代表
的关系如图所示,x、y、z三条曲线上的点都代表 在不同条件下的平衡产率,且每条曲线上
在不同条件下的平衡产率,且每条曲线上 的平衡产率相同,如: A、B两点的
的平衡产率相同,如: A、B两点的 平衡产率相等,B、C两点的
平衡产率相等,B、C两点的 平衡产率不相等。
平衡产率不相等。
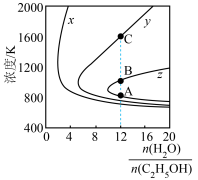
 的平衡产率:B点
的平衡产率:B点_______ C点(填“>”或“<”)。
(4)恒容条件下,将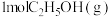 和
和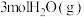 投入密闭容器中发生上述三个反应,平衡时
投入密闭容器中发生上述三个反应,平衡时 的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
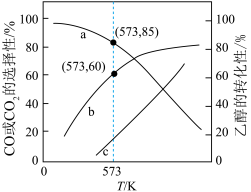
【已知:CO的选择性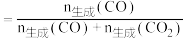 】
】
①表示乙醇转化率的曲线是_______ (填“a”、“b”或“c”)。
②573K时,反应II的压强平衡常数
_______ 。(已知:分压=总压 该组分物质的量分数,计算结果保留整数。)
该组分物质的量分数,计算结果保留整数。)
(1)已知:
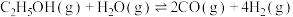
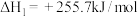 ,回答下列问题:
,回答下列问题:①升温,平衡
②与原平衡相比较,增大压强,新平衡时

③恒温、恒容条件下。加入水蒸气,转化率
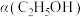
④恒温、恒压条件下,加入稀有气体,体积分数
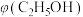
(2)乙醇与水催化制氢同时发生以下三个反应,回答下列问题:
反应I:
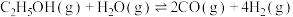
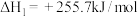
反应II:


反应III:


则
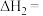
 。
。(3)压强为100kPa,
 的平衡产率与温度、起始时
的平衡产率与温度、起始时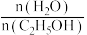 的关系如图所示,x、y、z三条曲线上的点都代表
的关系如图所示,x、y、z三条曲线上的点都代表 在不同条件下的平衡产率,且每条曲线上
在不同条件下的平衡产率,且每条曲线上 的平衡产率相同,如: A、B两点的
的平衡产率相同,如: A、B两点的 平衡产率相等,B、C两点的
平衡产率相等,B、C两点的 平衡产率不相等。
平衡产率不相等。
 的平衡产率:B点
的平衡产率:B点(4)恒容条件下,将
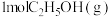 和
和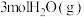 投入密闭容器中发生上述三个反应,平衡时
投入密闭容器中发生上述三个反应,平衡时 的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
【已知:CO的选择性
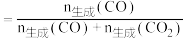 】
】①表示乙醇转化率的曲线是
②573K时,反应II的压强平衡常数

 该组分物质的量分数,计算结果保留整数。)
该组分物质的量分数,计算结果保留整数。)
您最近一年使用:0次
2023-11-14更新
|
361次组卷
|
2卷引用:重庆市第十一中学校2023-2024学年高二上学期期中考试化学试题
名校
3 . 如图所示,三个烧瓶中分别充满NO2气体并分别装在盛有水的三个烧杯中,在①烧杯中加入CaO,在②烧杯中不加其他任何物质,在③烧杯中加入NH4Cl晶体,发现①中红棕色变深,③中红棕色变浅。已知:2NO2(红棕色) N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是
 N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是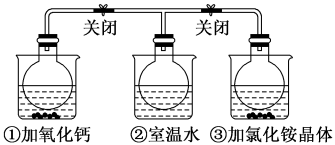
A.2NO2 N2O4是吸热反应 N2O4是吸热反应 |
| B.NH4Cl溶于水时吸收热量 |
| C.①烧瓶中平衡时混合气体的平均相对分子质量增大 |
| D.③烧瓶中气体的压强增大 |
您最近一年使用:0次
2022-08-28更新
|
1133次组卷
|
23卷引用:陕西省延安市第一中学2019-2020学年高二上学期期中考试化学试题
陕西省延安市第一中学2019-2020学年高二上学期期中考试化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题广东省深圳市宝安区宝安中学2022-2023学年高一上学期期中考试化学试题新疆奇台县第一中学2022-2023学年高二上学期期中考试化学试题山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题(已下线)2010年北京市八一中学高二第二学期期末考试化学试卷2018版化学(苏教版)高考总复习专题七课时跟踪训练--化学平衡的移动新疆生产建设兵团第二中学2017-2018学年高二上学期第四次月考(期末)化学试题【全国百强校】辽宁省鞍山市第一中学2018-2019学年高二下学期开学考试化学试题新疆自治区生产建设兵团第二中学2018-2019学年高二第一次月考化学试题(已下线)专题7.2 化学平衡状态 化学平衡移动(练)-《2020年高考一轮复习讲练测》云南省普洱市江城县第一中学2019—2020学年高二上学期期末考试化学试题四川省泸州市泸县第二中学2019-2020学年高二下学期第一次在线月考化学试题黑龙江省大庆市第四中学2019-2020学年高二上学期第一次检测化学试题(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)安徽省蚌埠田家炳中学2020-2021学年高二10月月考化学试题江西省上饶市2020-2021学年高二上学期期末教学质量测试化学试题江西省赣州市第一中学2020-2021学年高二下学期开学测试化学试题河南省信阳高级中学2020-2021学年高二下学期回顾测试化学试题福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题福建省莆田市擢英中学2021-2022学年高二上学期第一次月考化学试卷(已下线)2.2.2 浓度商、温度对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)选择题11-15
名校
解题方法
4 . 温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1molNO2,发生反应:2C(s)+2NO2(g) N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
 N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。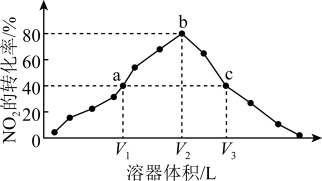
A.T℃时,该反应的化学平衡常数为Kc= mol·L-1 mol·L-1 |
| B.由图可知,c点V正>V逆 |
| C.向a点平衡体系中充入一定量的NO2,达到平衡时,NO2的转化率比原平衡小 |
| D.容器内的压强:pa∶pb=6∶7 |
您最近一年使用:0次
2021-09-06更新
|
1443次组卷
|
16卷引用:河北省保定市定州市2021-2022学年高二上学期期中考试化学试题
河北省保定市定州市2021-2022学年高二上学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2021-2022学年高三上学期期中考试化学试题四川省成都市树德中学2021-2022学年高二上学期11月阶段性测试(期中)化学试题 安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题黑龙江省哈尔滨市尚志中学2022-2023学年高三上学期期中考试化学试题福建师范大学附属中学2023-2024学年高二上学期期中考试化学试题重庆育才中学2022届高考适应性考试二化学试题江西省抚州市临川一中、临川一中实验学校2022届高三第一次月考化学试题吉林省洮南市第一中学2021-2022学年高二上学期第一次月考化学试题山西省长治市第二中学2021-2022学年高三上学期第三次练考化学试题安徽省六安市第一中学2022届高三上学期第三次月考化学试题广东省梅州市蕉岭县蕉岭中学2022-2023学年高三上学期高二第二次质检化学试题(已下线)化学(重庆A卷)-学易金卷:2023年高考第一次模拟考试卷(已下线)易错点4化学反应速率、平衡图像分析错误(已下线)题型24 化学反应平衡常数、平衡转化率图像
名校
解题方法
5 . 以CO2、H2为原料合成CH3OH涉及的主要反应如下:
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是
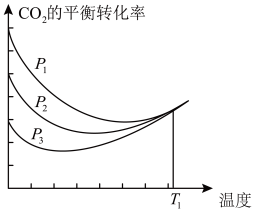
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是

| A.∆H3=-40.9 kJ/mol |
| B.p1 < p2 < p3 |
| C.为同时提高CO2的平衡转化率和CH3OH的平衡产率,反应条件应选择高温、高压 |
| D.T1温度时,三条曲线几乎交于一点的原因是:该温度下,主要发生反应③ |
您最近一年使用:0次
2021-04-04更新
|
1234次组卷
|
10卷引用:北京市顺义牛栏山第一中学2022-2023学年高二上学期期中考试化学试题
北京市顺义牛栏山第一中学2022-2023学年高二上学期期中考试化学试题北京市第一七一中学2023-2024学年高二上学期期中考试化学试题云南省保山市腾冲市第八中学2020-2021学年高二下学期期中考试化学试卷北京市丰台区2021届高三一模化学试题(已下线)押山东卷第14题 化学反应速率和平衡-备战2021年高考化学临考题号押题(山东卷)河北省武邑中学2021届高考七模化学试题黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题湖南省武冈市第一中学2021-2022学年高三下学期5月月考化学试题湖南省邵阳市第二中学2021-2022学年高一下学期期末考试化学试题山东省烟台市龙口市2023-2024学年高二上学期10月统考化学试题
填空题
|
适中(0.65)
|
6 . 二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业。
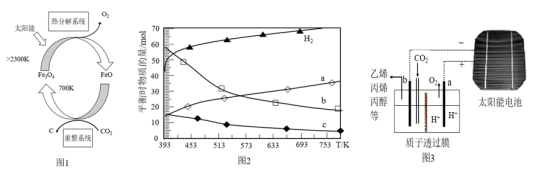
(1)国外学者提出的由CO2制取C的太阳能工艺如图1所示。
①“热分解系统”发生的反应为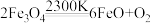 ,每分解1 mol Fe3O4转移的电子数为
,每分解1 mol Fe3O4转移的电子数为________ 。
②“重整系统”发生反应的化学方程式为________________________________ 。
(2)二氧化碳催化加氢合成低碳烯烃是目前研究的热门课题,起始时以0.1 MPa, 的投料比充入反应器中,发生反应:
的投料比充入反应器中,发生反应: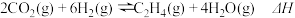 ,不同温度下平衡时的四种气态物质的物质的量如图2所示:
,不同温度下平衡时的四种气态物质的物质的量如图2所示:
①曲线b表示的物质为________ (写化学式)。②该反应的
________ 0。(填:“>”或“<”)
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是________________ (列举1项)。
(3)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如题图3所示。
①该工艺中若选择用熔融K2CO3作介质的甲烷燃料电池替代太阳能电池,则负极反应式为________ 。
②电解时其中b极上生成乙烯的电极反应式为________________________________ 。

(1)国外学者提出的由CO2制取C的太阳能工艺如图1所示。
①“热分解系统”发生的反应为
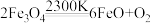 ,每分解1 mol Fe3O4转移的电子数为
,每分解1 mol Fe3O4转移的电子数为②“重整系统”发生反应的化学方程式为
(2)二氧化碳催化加氢合成低碳烯烃是目前研究的热门课题,起始时以0.1 MPa,
 的投料比充入反应器中,发生反应:
的投料比充入反应器中,发生反应: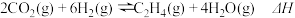 ,不同温度下平衡时的四种气态物质的物质的量如图2所示:
,不同温度下平衡时的四种气态物质的物质的量如图2所示:①曲线b表示的物质为

③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是
(3)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如题图3所示。
①该工艺中若选择用熔融K2CO3作介质的甲烷燃料电池替代太阳能电池,则负极反应式为
②电解时其中b极上生成乙烯的电极反应式为
您最近一年使用:0次
解题方法
7 . CH4和CO2在催化剂作用下反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)-247kJ完成下列填空:
2CO(g)+2H2(g)-247kJ完成下列填空:
(1)有利于提高CH4平衡转化率的措施是___ (任写两条)。
(2)该反应温度控制在550~750℃之间,从反应速率角度分析,选择该温度范围的可能原因:___ 。
(3)CH4和CO2各1mol充入密闭容器中,发生上述反应。
①300℃,100kPa,反应达到平衡时CO2体积分数与温度的关系如图中曲线所示。则n(平衡时气体):n(初始气体)=___ 。
②若A、B、C三点表示不同温度和压强下已达平衡时CO2体积分数,___ 点对应的平衡常数最小,理由是:___ ;___ 点对应压强最大,理由是:___ 。
(4)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应又使积碳量减少:
积碳反应:CH4(g) C(s)+2H2(g)-75kJ
C(s)+2H2(g)-75kJ
消碳反应:CO2(g)+C(s) 2CO(g)-172kJ
2CO(g)-172kJ
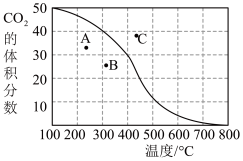
一定时间内,积碳量和反应温度的关系如图所示。
①一定温度,增大CO2的浓度有助于减少积碳,其原因是:___ 。
②温度高于600℃,积碳量减少的可能原因是:___ (任写一条)。
 2CO(g)+2H2(g)-247kJ完成下列填空:
2CO(g)+2H2(g)-247kJ完成下列填空:(1)有利于提高CH4平衡转化率的措施是
(2)该反应温度控制在550~750℃之间,从反应速率角度分析,选择该温度范围的可能原因:
(3)CH4和CO2各1mol充入密闭容器中,发生上述反应。
①300℃,100kPa,反应达到平衡时CO2体积分数与温度的关系如图中曲线所示。则n(平衡时气体):n(初始气体)=

②若A、B、C三点表示不同温度和压强下已达平衡时CO2体积分数,
(4)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应又使积碳量减少:
积碳反应:CH4(g)
 C(s)+2H2(g)-75kJ
C(s)+2H2(g)-75kJ消碳反应:CO2(g)+C(s)
 2CO(g)-172kJ
2CO(g)-172kJ一定时间内,积碳量和反应温度的关系如图所示。

①一定温度,增大CO2的浓度有助于减少积碳,其原因是:
②温度高于600℃,积碳量减少的可能原因是:
您最近一年使用:0次
2020-12-30更新
|
269次组卷
|
2卷引用:上海市彭浦中学 2022-2023学年高三上学期期中考试化学试题
名校
解题方法
8 . 一定条件下,可逆反应N2+3H2 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是 | A.加催化剂,v正、v逆都发生变化,且变化的倍数相等 |
| B.加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数 |
| C.降温,v正、v逆都减小,且v正减小的倍数大于v逆减小的倍数 |
| D.增大氮气的浓度,N2转化率减小,H2转化率增大 |
您最近一年使用:0次
2020-12-27更新
|
112次组卷
|
3卷引用:西藏林芝市第二高级中学2020-2021学年高二上学期期中考试理综化学试题
名校
9 . 如图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法正确的是( )
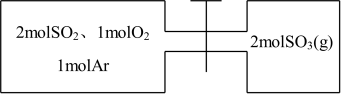

| A.第一次平衡时,SO2的物质的量左室更多 |
| B.充入气体未反应前,左室压强比右室大 |
| C.第一次平衡时,左室内压强一定小于右室 |
| D.第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍还要多 |
您最近一年使用:0次
2020-11-26更新
|
398次组卷
|
6卷引用:湖北省鄂州市部分高中联考协作体2020-2021学年高二上学期期中考试化学试题
名校
10 . 一定温度下,在3个容积均为1.0 L的恒容密闭容器中发生反应:PCl5 (g)  PCl3(g)+Cl2(g)。下列说法错误的是
PCl3(g)+Cl2(g)。下列说法错误的是
 PCl3(g)+Cl2(g)。下列说法错误的是
PCl3(g)+Cl2(g)。下列说法错误的是| 容器编号 | 物质的起始浓度/(mol·L-1) | 物质的平衡浓度/(mol·L-1) | ||
 | 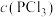 | 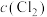 | 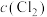 | |
| Ⅰ | 0.4 | 0 | 0 | 0.2 |
| Ⅱ | 0.6 | 0 | 0.2 | |
| Ⅲ | 0.8 | 0 | 0 | |
A.反应达到平衡时,容器I中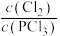 比容器Ⅱ中的小 比容器Ⅱ中的小 |
| B.反应达到平衡时,容器I与容器Ⅱ中的总压强之比为3︰4 |
C.反应达到平衡时,容器Ⅲ中 的体积分数小于 的体积分数小于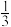 |
| D.反应达到平衡时,容器Ⅲ中0.4mol/L<c(PCl5)<0.8 mol/L |
您最近一年使用:0次
2020-09-29更新
|
716次组卷
|
6卷引用:江西省南昌县莲塘第三中学2020-2021学年高二上学期期中考试化学试题



