解题方法
1 . CH4和CO2在催化剂作用下反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)-247kJ完成下列填空:
2CO(g)+2H2(g)-247kJ完成下列填空:
(1)有利于提高CH4平衡转化率的措施是___ (任写两条)。
(2)该反应温度控制在550~750℃之间,从反应速率角度分析,选择该温度范围的可能原因:___ 。
(3)CH4和CO2各1mol充入密闭容器中,发生上述反应。
①300℃,100kPa,反应达到平衡时CO2体积分数与温度的关系如图中曲线所示。则n(平衡时气体):n(初始气体)=___ 。
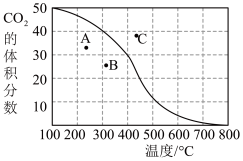
②若A、B、C三点表示不同温度和压强下已达平衡时CO2体积分数,___ 点对应的平衡常数最小,理由是:___ ;___ 点对应压强最大,理由是:___ 。
(4)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应又使积碳量减少:
积碳反应:CH4(g) C(s)+2H2(g)-75kJ
C(s)+2H2(g)-75kJ
消碳反应:CO2(g)+C(s) 2CO(g)-172kJ
2CO(g)-172kJ
一定时间内,积碳量和反应温度的关系如图所示。
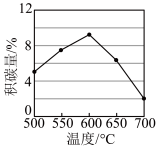
①一定温度,增大CO2的浓度有助于减少积碳,其原因是:___ 。
②温度高于600℃,积碳量减少的可能原因是:___ (任写一条)。
 2CO(g)+2H2(g)-247kJ完成下列填空:
2CO(g)+2H2(g)-247kJ完成下列填空:(1)有利于提高CH4平衡转化率的措施是
(2)该反应温度控制在550~750℃之间,从反应速率角度分析,选择该温度范围的可能原因:
(3)CH4和CO2各1mol充入密闭容器中,发生上述反应。
①300℃,100kPa,反应达到平衡时CO2体积分数与温度的关系如图中曲线所示。则n(平衡时气体):n(初始气体)=

②若A、B、C三点表示不同温度和压强下已达平衡时CO2体积分数,
(4)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应又使积碳量减少:
积碳反应:CH4(g)
 C(s)+2H2(g)-75kJ
C(s)+2H2(g)-75kJ消碳反应:CO2(g)+C(s)
 2CO(g)-172kJ
2CO(g)-172kJ一定时间内,积碳量和反应温度的关系如图所示。

①一定温度,增大CO2的浓度有助于减少积碳,其原因是:
②温度高于600℃,积碳量减少的可能原因是:
您最近一年使用:0次
2020-12-30更新
|
269次组卷
|
2卷引用:上海市彭浦中学 2022-2023学年高三上学期期中考试化学试题
名校
解题方法
2 . 一定条件下,可逆反应N2+3H2 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是 | A.加催化剂,v正、v逆都发生变化,且变化的倍数相等 |
| B.加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数 |
| C.降温,v正、v逆都减小,且v正减小的倍数大于v逆减小的倍数 |
| D.增大氮气的浓度,N2转化率减小,H2转化率增大 |
您最近一年使用:0次
2020-12-27更新
|
112次组卷
|
3卷引用:西藏林芝市第二高级中学2020-2021学年高二上学期期中考试理综化学试题
名校
3 . 如图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法正确的是( )
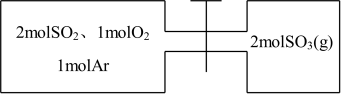

| A.第一次平衡时,SO2的物质的量左室更多 |
| B.充入气体未反应前,左室压强比右室大 |
| C.第一次平衡时,左室内压强一定小于右室 |
| D.第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍还要多 |
您最近一年使用:0次
2020-11-26更新
|
398次组卷
|
6卷引用:湖北省鄂州市部分高中联考协作体2020-2021学年高二上学期期中考试化学试题
名校
4 . 一定温度下,在3个容积均为1.0 L的恒容密闭容器中发生反应:PCl5 (g)  PCl3(g)+Cl2(g)。下列说法错误的是
PCl3(g)+Cl2(g)。下列说法错误的是
 PCl3(g)+Cl2(g)。下列说法错误的是
PCl3(g)+Cl2(g)。下列说法错误的是| 容器编号 | 物质的起始浓度/(mol·L-1) | 物质的平衡浓度/(mol·L-1) | ||
 | 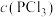 | 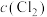 | 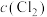 | |
| Ⅰ | 0.4 | 0 | 0 | 0.2 |
| Ⅱ | 0.6 | 0 | 0.2 | |
| Ⅲ | 0.8 | 0 | 0 | |
A.反应达到平衡时,容器I中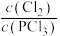 比容器Ⅱ中的小 比容器Ⅱ中的小 |
| B.反应达到平衡时,容器I与容器Ⅱ中的总压强之比为3︰4 |
C.反应达到平衡时,容器Ⅲ中 的体积分数小于 的体积分数小于 |
| D.反应达到平衡时,容器Ⅲ中0.4mol/L<c(PCl5)<0.8 mol/L |
您最近一年使用:0次
2020-09-29更新
|
725次组卷
|
6卷引用:江西省南昌县莲塘第三中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
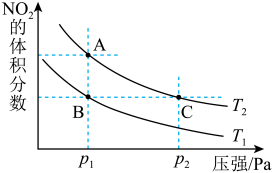
5 . 反应N2O4(g)  2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法不正确 的是
 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
| A.A点的反应速率小于C点的反应速率 |
| B.A、C两点气体的颜色:A浅,C深 |
| C.由状态B到状态A,可以用降温的方法 |
| D.A、C两点气体的平均相对分子质量:A<C |
您最近一年使用:0次
2020-04-02更新
|
1051次组卷
|
9卷引用:浙江省衢州市四校2019--2020学年上学期期中联考高二化学试题
浙江省衢州市四校2019--2020学年上学期期中联考高二化学试题黑吉两省十校2020-2021学年高二上学期期中联考(吉雅2校用)化学试题山东省新泰市第一中学2022-2023学年高二上学期期中考试化学试题广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题河北省沧州市河间市第四中学2019-2020学年高二下学期期末模拟考试化学试卷湖南省常德市外国语学校2020-2021学年高二上学期第二次月考化学试题江西省吉安县立中学2020-2021学年高二上学期12月月考化学(B班)试题黑龙江省大庆中学2020—2021学年高二上学期期末考试化学试题山东省泰安新泰市第一中学(实验部)2023-2024学年高二上学期第一次质量检测化学试题
名校
6 . 甲、乙、丙三个容器中最初存在的物质及其数量如图所示,三个容器最初的容积相等、温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是
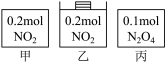
| A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙 |
| B.平衡时N2O4的百分含量:乙>甲=丙 |
| C.平衡时甲中NO2与丙中N2O4的转化率不可能相同 |
| D.平衡时混合物的平均相对分子质量:甲>乙>丙 |
您最近一年使用:0次
2019-11-06更新
|
2242次组卷
|
28卷引用:山西省朔州市怀仁一中2019-2020学年高二上学期期中考试化学试题
山西省朔州市怀仁一中2019-2020学年高二上学期期中考试化学试题山东省新泰市第二中学2019-2020学年高二上学期期中考试化学试题黑龙江省哈尔滨三中2021届高三上学期期中考试化学试题(已下线)选择性必修1 期中检测(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)河南省洛阳市2021-2022学年高二上期期中考试化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期中阶段性检测化学试题安徽省安庆市第二中学2023-2024学年高二上学期期中考试化学试卷福建师范大学附属中学2023-2024学年高二上学期期中考试化学试题步步为赢 高二化学寒假作业:作业六 化学平衡中的模型构建与等效平衡辽宁省辽阳市集美中学2020届高二12月月考化学试题江西省万载中学2019-2020学年高二12月月考(创新班)化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节综合训练高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 第二节综合训练天津市第一中学2021届高三上学期第二次月考化学试题(已下线)练习4 化学平衡-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)山西省寿阳县第一中学2020—2021学年高二上学期第二次月考化学试题黑龙江省龙东南六校2020-2021学年高二上学期期末联考化学试题河南省林州市第一中学2020-2021学年高二下学期第二次月考化学试题选择性必修1 专题2 第三单元综合训练黑龙江省哈尔滨师范大学附属中学2021-2022学年高二上学期开学考试化学试题山东省临沂市平邑县第一中学实验部2021-2022学年高二上学期第二次月考化学试题湖北省武汉市长虹中学2021-2022学年高二上学期10月月考化学试卷江西省新余市2021-2022学年高二上学期期末检测化学试题云南省凤庆县第一中学2021-2022学年高二下学期3月份考试化学试题四川省广安市华蓥中学校2021-2022学年高二上学期11月月考化学试题山西省山西大学附属中学2022-2023学年高二上学期10月考化学试题2.3.1浓度 压强变化对化学平衡的影响 课后山东省青岛第十七中学2023-2024学年高二上学期12月月考化学试题
7 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:_________________________________________ 。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
p2_______ p 1(填“>”或“<”),得出该结论的理由是________________ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+===S↓+2I2+2H2O
ii.I2+2H2O+_________ ===_________ +_______ +2I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=__________ 。
②比较A、B、C,可得出的结论是______________________ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________ 。
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
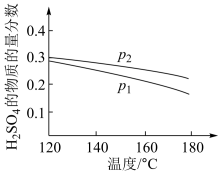
p2
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+===S↓+2I2+2H2O
ii.I2+2H2O+
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
A | B | C | D | |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
您最近一年使用:0次
2018-06-09更新
|
6548次组卷
|
28卷引用:北京东城区2019-2020学年高二下学期期中考试化学试题
北京东城区2019-2020学年高二下学期期中考试化学试题(已下线)北京市第四中学2021-2022学年高三上学期期中考试化学试题安徽省黄山市屯溪第一中学2021-2022学年高二上学期期中考试化学试题北京市铁路第二中学2022-2023学年高二上学期期中检测化学试题浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷北京市广渠门中学2023-2024学年高二上学期期中考试化学试题 北京市铁路第二中学2023-2024学年高二上学期期中考试化学试题10-2023新东方高二上期中考化学2018年全国普通高等学校招生统一考试化学(北京卷)(已下线)2018年高考题及模拟题汇编 专题14 化学反应原理综合【校级联考】安徽省江南片2019届高三上学期入学摸底考试化学试题陕西安康市紫阳县紫阳中学2019届高三上学期入学调研考试化学试题福建省泉州第五中学2019届高三入学调研考试化学试题【全国百强校】山西省太原市第五中学2018-2019学年高二(理)上学期10月月考化学试题江西省丰城中学2018-2019学年高一上学期课改期末考试化学试题云南省富宁县民族中学2020届高三上学期开学考试化学试题福建省福州市第三中学2019-2020学年高三10月月考化学试题(已下线)考点24 元素与理论综合——《备战2020年高考精选考点专项突破题集》(已下线)考点12 化学反应速率化学平衡——《备战2020年高考精选考点专项突破题集》2020届人教版高三专题基础复习专题7《化学反应速率与化学平衡》测试卷四川省成都市实验中学2019-2020学年高三下学期第三次周测化学试题(已下线)专题6.3 化学原理题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第3节 化学反应的速率北京市陈经纶中学2022-2023学年高二10月月考化学试题(已下线)化学(上海C卷)-学易金卷:2023年高考第一次模拟考试卷北京市第八中学2022-2023学年高二上学期期末考试化学试题广西壮族自治区钦州市第四中学2022-2023学年高一下学期3月月考化学试卷北京市第一○一中学2023-2024学年高二上学期统练一化学试题



