名校
1 . 2021年6月17日,搭载神舟十二号载人飞般的长征二号F遥十二运载火箭,在酒泉卫星发射中
心发射。该运载火箭推进物分为偏二甲基肼( )、四氧化二氮和液氢、液氧。
)、四氧化二氮和液氢、液氧。
(1)3.0g液态偏二甲基肼与足量液态四氧化二氮完全反应生成 、
、 和
和 ,放出112.5kJ的热量,写出上述反应的热化学方程式
,放出112.5kJ的热量,写出上述反应的热化学方程式___________ 。
(2)对 和
和 反应的说法正确的是___________。
反应的说法正确的是___________。
(3)飞船在发射前,运载火箭要加注燃料,火箭的周围常常会看到淡淡的黄色烟雾。这是由于燃料推进时,需要减压排出部分 。无色的
。无色的 可分解为红棕色的
可分解为红棕色的 。
。
①已知 和
和 的结构式分别是
的结构式分别是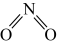 和
和 ,实验测得N-N的键能为167kJ/mol,
,实验测得N-N的键能为167kJ/mol, 中氮氧键(
中氮氧键( )的键能为466kJ/mol,
)的键能为466kJ/mol, 中氮氧键(
中氮氧键( )的键能为438.5kJ/mol;
)的键能为438.5kJ/mol; 转化为
转化为 的
的
___________ 。
②将一定量的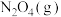 充入注射器中后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法确的是
充入注射器中后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法确的是___________ 。
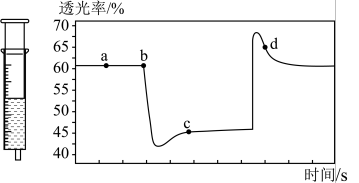
A.d点:
B.b点的操作是压缩注射器
C.c点与a点相比, 增大,
增大,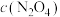 减小
减小
D.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数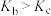
③反应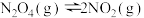 ,一定条件下
,一定条件下 与
与 的消耗速率与自身压强间存在:
的消耗速率与自身压强间存在: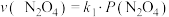 ,
,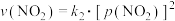 。其中
。其中 、
、 是与反应及温度有关的常数。一定温度下,
是与反应及温度有关的常数。一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是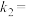
___________ 。(对于气相反应,用某组分B的平衡压强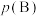 代替物质的量浓度
代替物质的量浓度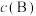 也可表示平衡常数,记作
也可表示平衡常数,记作 )
)
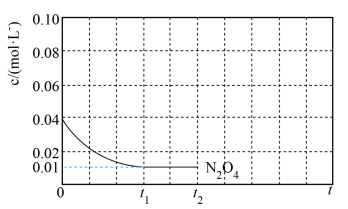
④反应温度 时,
时,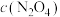 随t(时间)变化曲线如图1,画出
随t(时间)变化曲线如图1,画出 时段,
时段, 随t变化曲线。保持其它条件不变,改变反应温度为
随t变化曲线。保持其它条件不变,改变反应温度为 (
( ),再次画出
),再次画出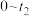 时段,
时段, 随t变化趋势的曲线。
随t变化趋势的曲线。_________
心发射。该运载火箭推进物分为偏二甲基肼(
 )、四氧化二氮和液氢、液氧。
)、四氧化二氮和液氢、液氧。(1)3.0g液态偏二甲基肼与足量液态四氧化二氮完全反应生成
 、
、 和
和 ,放出112.5kJ的热量,写出上述反应的热化学方程式
,放出112.5kJ的热量,写出上述反应的热化学方程式(2)对
 和
和 反应的说法正确的是___________。
反应的说法正确的是___________。| A.偏二甲肼是比液氢更环保的燃料 | B. 既是氧化产物,又是还原产物 既是氧化产物,又是还原产物 |
| C.偏二甲基肼的燃烧热为2250kJ/mol | D.该反应是一个熵增的自发反应 |
 。无色的
。无色的 可分解为红棕色的
可分解为红棕色的 。
。①已知
 和
和 的结构式分别是
的结构式分别是 和
和 ,实验测得N-N的键能为167kJ/mol,
,实验测得N-N的键能为167kJ/mol, 中氮氧键(
中氮氧键( )的键能为466kJ/mol,
)的键能为466kJ/mol, 中氮氧键(
中氮氧键( )的键能为438.5kJ/mol;
)的键能为438.5kJ/mol; 转化为
转化为 的
的
②将一定量的
 充入注射器中后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法确的是
充入注射器中后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法确的是
A.d点:

B.b点的操作是压缩注射器
C.c点与a点相比,
 增大,
增大, 减小
减小D.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数
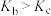
③反应
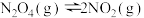 ,一定条件下
,一定条件下 与
与 的消耗速率与自身压强间存在:
的消耗速率与自身压强间存在: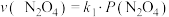 ,
,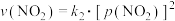 。其中
。其中 、
、 是与反应及温度有关的常数。一定温度下,
是与反应及温度有关的常数。一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是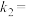
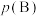 代替物质的量浓度
代替物质的量浓度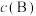 也可表示平衡常数,记作
也可表示平衡常数,记作 )
)④反应温度
 时,
时,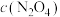 随t(时间)变化曲线如图1,画出
随t(时间)变化曲线如图1,画出 时段,
时段, 随t变化曲线。保持其它条件不变,改变反应温度为
随t变化曲线。保持其它条件不变,改变反应温度为 (
( ),再次画出
),再次画出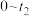 时段,
时段, 随t变化趋势的曲线。
随t变化趋势的曲线。
您最近一年使用:0次
解题方法
2 . 砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_______ 。该反应需要在加压下进行,原因是_______ 。
(2)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_______ 。
(3)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应: (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是_______ (填标号)。
a.溶液的pH不再变化 b.v(I−)=2v( )
)
c. c( )/c(
)/c( )不再变化 d. c(I−)=y mol·L−1
)不再变化 d. c(I−)=y mol·L−1
②tm时v逆_______ tn时v逆(填“大于”“小于”或“等于”),理由是_______ 。
③tm若平衡时溶液的pH=14,则该反应的平衡常数K为_______ 。
(1)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式
(2)已知:As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1H2(g)+
 O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH22As(s)+
 O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =
(3)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应:
 (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是
a.溶液的pH不再变化 b.v(I−)=2v(
 )
)c. c(
 )/c(
)/c( )不再变化 d. c(I−)=y mol·L−1
)不再变化 d. c(I−)=y mol·L−1②tm时v逆
③tm若平衡时溶液的pH=14,则该反应的平衡常数K为
您最近一年使用:0次
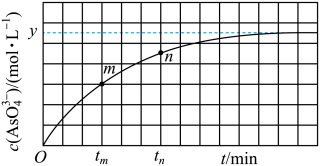
3 . 对于N2O4(g) 2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点)。
2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点)。
(1)A、C两点的反应速率的关系为A_______ C(填“>”、“<”或“=”)。
(2)当反应处于B状态时,v正_______ v逆(填“>”、“<”或“=”),A、B、C、D、E各状态中,v正<v逆的是_______ 。
(3)由D状态转变为C状态后,混合气体的总物质的量会_______ (填“增大”、“减小”)。
(4)欲要求使E状态从水平方向到达C状态后,再沿平衡曲线达A状态,从理论上来讲,可选用的条件是_______ 。
A.从P1无限缓慢加压至P2,再由P2无限缓慢降压至P1
B.从P1突然加压至P2,再由P2无限缓慢降压至P1
C.从P1突然加压至P2,再由P2突然降压至P1
 2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点)。
2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点)。
(1)A、C两点的反应速率的关系为A
(2)当反应处于B状态时,v正
(3)由D状态转变为C状态后,混合气体的总物质的量会
(4)欲要求使E状态从水平方向到达C状态后,再沿平衡曲线达A状态,从理论上来讲,可选用的条件是
A.从P1无限缓慢加压至P2,再由P2无限缓慢降压至P1
B.从P1突然加压至P2,再由P2无限缓慢降压至P1
C.从P1突然加压至P2,再由P2突然降压至P1
您最近一年使用:0次
解题方法
4 . 工业上二氧化碳、甲烷催化重整不仅可以获得合成气(CO和H2),还可减少温室气体排放,对治理生态环境具有重要意义。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=a kJ/mol
CO(g)+H2O(g)=CO2(g)+H2O(g) △H2=b kJ/mol
2CO(g)+O2(g)=2CO2(g) △H3=c kJ/mol
催化重整反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H4=_______ 。
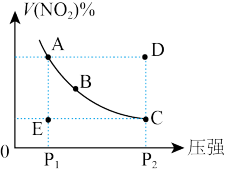
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,还可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250-300℃时,温度升高而乙酸的生成速率降低的原因可能是_______ 。
(3)催化重整 CO2(g)+CH4(g)=2CO(g)+2H2(g)的反应,测得CH4的平衡转化率与温度及压强的关系如图中曲线所示:
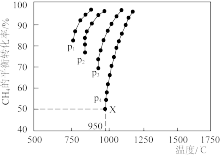
①根据图2可知,p1、p2、p3、p4由大到小的顺序为_______ 。
②在压强为p4、投料比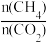 为1、950℃的条件下,X点平衡常数Kp=
为1、950℃的条件下,X点平衡常数Kp=_______ (用含p4的代数式表示,其中用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。
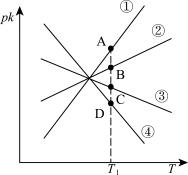
(4)若反应CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.17 kJ/mol 的正、逆反应速率分别可表示为v正=k正c(CO2)·c(H2)、k逆分别为正、逆反应速率常数,c为物质的量浓度。则如图(pK=-lgk:T表示温度
CO(g)+H2O(g) △H2=+41.17 kJ/mol 的正、逆反应速率分别可表示为v正=k正c(CO2)·c(H2)、k逆分别为正、逆反应速率常数,c为物质的量浓度。则如图(pK=-lgk:T表示温度 所示①、②、③、④四条斜线中,能表示以pk正随T变化关系的是斜线
所示①、②、③、④四条斜线中,能表示以pk正随T变化关系的是斜线_______ ,能表示pk逆随T变化关系的是斜线_______ 。
(5)我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C,放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C,放电时该电池“吸入”CO2,其工作原理如图所示:
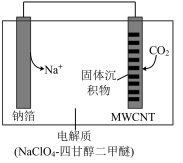
放电时,正极的电极反应式为_______ 。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=a kJ/mol
CO(g)+H2O(g)=CO2(g)+H2O(g) △H2=b kJ/mol
2CO(g)+O2(g)=2CO2(g) △H3=c kJ/mol
催化重整反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H4=
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,还可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250-300℃时,温度升高而乙酸的生成速率降低的原因可能是

(3)催化重整 CO2(g)+CH4(g)=2CO(g)+2H2(g)的反应,测得CH4的平衡转化率与温度及压强的关系如图中曲线所示:

①根据图2可知,p1、p2、p3、p4由大到小的顺序为
②在压强为p4、投料比
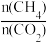 为1、950℃的条件下,X点平衡常数Kp=
为1、950℃的条件下,X点平衡常数Kp= 总压
总压 物质的量分数)。
物质的量分数)。(4)若反应CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.17 kJ/mol 的正、逆反应速率分别可表示为v正=k正c(CO2)·c(H2)、k逆分别为正、逆反应速率常数,c为物质的量浓度。则如图(pK=-lgk:T表示温度
CO(g)+H2O(g) △H2=+41.17 kJ/mol 的正、逆反应速率分别可表示为v正=k正c(CO2)·c(H2)、k逆分别为正、逆反应速率常数,c为物质的量浓度。则如图(pK=-lgk:T表示温度 所示①、②、③、④四条斜线中,能表示以pk正随T变化关系的是斜线
所示①、②、③、④四条斜线中,能表示以pk正随T变化关系的是斜线
(5)我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2
 2Na2CO3+C,放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C,放电时该电池“吸入”CO2,其工作原理如图所示:
放电时,正极的电极反应式为
您最近一年使用:0次
名校
解题方法
5 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
(1)已知在水中存在以下平衡: ,
, 。
。
①常温下 溶液的
溶液的
_______ (填序号)。
A.大于7 B.小于7 C.等于7 D.无法确定
②某温度下,若向 的
的 溶液中逐滴滴加
溶液中逐滴滴加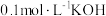 溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是
溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是_______ 。
A.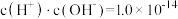 B.
B. 
C. D.
D. 
③已知常温下 的钙盐
的钙盐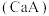 的饱和溶液中存在以下平衡:
的饱和溶液中存在以下平衡: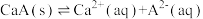
 。若要使该溶液中
。若要使该溶液中 浓度变小,可采取的措施有
浓度变小,可采取的措施有_______ 。
A.升高温度 B.降低温度 C.加入 晶体 D.加入
晶体 D.加入 固体
固体
(2)联氨(又称肼, ,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,请回答:
,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,请回答:
①联氨为二元弱碱,在水中的电离方程式与氨相似,则联氨第一步电离方程式为_______ 。
②肼-空气燃料电池是一种碱性燃料电池,生成无污染的物质。电解质溶液是20%~30%的 溶液。肼-空气燃料电池放电时:负极的电极反应式是
溶液。肼-空气燃料电池放电时:负极的电极反应式是_______ 。
(3)工业废水中含有一定量的 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:

若平衡体系的 ,则溶液显
,则溶液显_______ 色。
②能说明第①步反应达平衡状态的是_______ 。
A. 和
和 的浓度相同 b. v(
的浓度相同 b. v( )和v(
)和v( )相等 c.溶液的颜色不变
)相等 c.溶液的颜色不变
③第③步生成的 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡: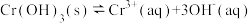 ,常温下,
,常温下, 的溶度积
的溶度积 ,要使
,要使 降至
降至 ,溶液的
,溶液的 应调至
应调至_______ 。
(1)已知在水中存在以下平衡:
 ,
, 。
。①常温下
 溶液的
溶液的
A.大于7 B.小于7 C.等于7 D.无法确定
②某温度下,若向
 的
的 溶液中逐滴滴加
溶液中逐滴滴加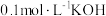 溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是
溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是A.
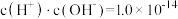 B.
B. 
C.
 D.
D. 
③已知常温下
 的钙盐
的钙盐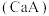 的饱和溶液中存在以下平衡:
的饱和溶液中存在以下平衡: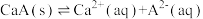
 。若要使该溶液中
。若要使该溶液中 浓度变小,可采取的措施有
浓度变小,可采取的措施有A.升高温度 B.降低温度 C.加入
 晶体 D.加入
晶体 D.加入 固体
固体(2)联氨(又称肼,
 ,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,请回答:
,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,请回答:①联氨为二元弱碱,在水中的电离方程式与氨相似,则联氨第一步电离方程式为
②肼-空气燃料电池是一种碱性燃料电池,生成无污染的物质。电解质溶液是20%~30%的
 溶液。肼-空气燃料电池放电时:负极的电极反应式是
溶液。肼-空气燃料电池放电时:负极的电极反应式是(3)工业废水中含有一定量的
 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
若平衡体系的
 ,则溶液显
,则溶液显②能说明第①步反应达平衡状态的是
A.
 和
和 的浓度相同 b. v(
的浓度相同 b. v( )和v(
)和v( )相等 c.溶液的颜色不变
)相等 c.溶液的颜色不变③第③步生成的
 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡: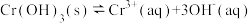 ,常温下,
,常温下, 的溶度积
的溶度积 ,要使
,要使 降至
降至 ,溶液的
,溶液的 应调至
应调至
您最近一年使用:0次
解题方法
6 . 在一定条件下,反应x A+yB zC达到平衡:
zC达到平衡:
(1)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是_______ ;
(2)若已知C是气体,且x+y=z。在增大压强时,若平衡发生移动,则一定向______ (填“正”或“逆”)反应方向移动;
(3)已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为____ 态;
(4)加热后C的质量分数减少,则正反应是________ (填“放热”或“吸热”)反应。升高温度达到新的平衡后,该反应的平衡常数将变___ (填“大”或“小”)。
 zC达到平衡:
zC达到平衡:(1)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是
(2)若已知C是气体,且x+y=z。在增大压强时,若平衡发生移动,则一定向
(3)已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为
(4)加热后C的质量分数减少,则正反应是
您最近一年使用:0次
2022-12-05更新
|
48次组卷
|
2卷引用:贵州省金沙县精诚中学2021-2022学年高二上学期期中理综化学试题
7 . 回答下列问题
(1)水煤气生产原理是:C(s)+H2O(g) CO(g)+ H2(g) ΔH=+131.3kJ·mol-1。
CO(g)+ H2(g) ΔH=+131.3kJ·mol-1。
①能说明该反应达到平衡状态的是_______ (填字母)。
A.v正(CO)= v正(H2) B.c(CO)=c(H2)
C.恒容容器中,气体密度不变 D.恒容容器中,气体压强不变
②该反应达到化学平衡时,若要增大水蒸气的转化率可采取的措施是_______ (填字母)。
A.增加碳的物质的量 B.增加水蒸气的物质的量
C.增大压强 D.升高温度
(2)已知6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。在温度为T℃,容积不变的密闭容器中,将3mol H2和1mol CO2混合,达到平衡时CO2气体的体积分数为a。
CH3CH2OH(g)+3H2O(g)。在温度为T℃,容积不变的密闭容器中,将3mol H2和1mol CO2混合,达到平衡时CO2气体的体积分数为a。
①达到平衡时,转化率α(H2)∶α(CO2) =_______ 。
②维持温度、容积不变,向该容器中充入2mol CO2,重新达到平衡时,CO2的物质的量_______ (填“增大” 、“减小” 或“不变”,下同),H2的转化率_______ 。
③维持温度、容积不变,向该容器中充入2mol He,CO2的转化率_______ a。(填>、<或=)
(1)水煤气生产原理是:C(s)+H2O(g)
 CO(g)+ H2(g) ΔH=+131.3kJ·mol-1。
CO(g)+ H2(g) ΔH=+131.3kJ·mol-1。①能说明该反应达到平衡状态的是
A.v正(CO)= v正(H2) B.c(CO)=c(H2)
C.恒容容器中,气体密度不变 D.恒容容器中,气体压强不变
②该反应达到化学平衡时,若要增大水蒸气的转化率可采取的措施是
A.增加碳的物质的量 B.增加水蒸气的物质的量
C.增大压强 D.升高温度
(2)已知6H2(g)+2CO2(g)
 CH3CH2OH(g)+3H2O(g)。在温度为T℃,容积不变的密闭容器中,将3mol H2和1mol CO2混合,达到平衡时CO2气体的体积分数为a。
CH3CH2OH(g)+3H2O(g)。在温度为T℃,容积不变的密闭容器中,将3mol H2和1mol CO2混合,达到平衡时CO2气体的体积分数为a。①达到平衡时,转化率α(H2)∶α(CO2) =
②维持温度、容积不变,向该容器中充入2mol CO2,重新达到平衡时,CO2的物质的量
③维持温度、容积不变,向该容器中充入2mol He,CO2的转化率
您最近一年使用:0次
8 . 回答下列化学平衡相关问题:
(1)工业制硫酸的核心反应是:2SO2(g)+O2(g) 2SO3(g) ∆H<0
2SO3(g) ∆H<0
①在1L密闭容器中充入1mol SO2(g)和2mol O2(g),在1min内达到平衡,测得v(SO3)=0.8mol/(L∙min)。该条件下,反应的平衡常数K=_______ 。
②下列措施中有利于提高SO2转化率的是_______  填字母
填字母 。
。
A.加入催化剂 B.通入O2 C.移出SO3
(2)将水蒸气通过红热的碳即可产生水煤气,C(s)+H2O(g) CO(g)+H2(g) ∆H=+131.3kJ∙mol-1,∆S=+133.7J∙(K∙mol)-1
CO(g)+H2(g) ∆H=+131.3kJ∙mol-1,∆S=+133.7J∙(K∙mol)-1
①该反应在_______ 能自发(填“高温”、“低温”、“任何温度”、“一定不”)。
②一定温度下,在一个恒容密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是_______ (填字母)。
A.c(CO)=c(H2)
B.1molH-H键断裂的同时生成2mol H-O键
C.容器中的压强不变
D.v正(CO)=v逆(H2O)
(3)汽车尾气含NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g) ∆H>0 ,已知该反应在2404℃时,平衡常数K=6.4×10-3,该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应
2NO(g) ∆H>0 ,已知该反应在2404℃时,平衡常数K=6.4×10-3,该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应_______ (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
(1)工业制硫酸的核心反应是:2SO2(g)+O2(g)
 2SO3(g) ∆H<0
2SO3(g) ∆H<0①在1L密闭容器中充入1mol SO2(g)和2mol O2(g),在1min内达到平衡,测得v(SO3)=0.8mol/(L∙min)。该条件下,反应的平衡常数K=
②下列措施中有利于提高SO2转化率的是
 填字母
填字母 。
。A.加入催化剂 B.通入O2 C.移出SO3
(2)将水蒸气通过红热的碳即可产生水煤气,C(s)+H2O(g)
 CO(g)+H2(g) ∆H=+131.3kJ∙mol-1,∆S=+133.7J∙(K∙mol)-1
CO(g)+H2(g) ∆H=+131.3kJ∙mol-1,∆S=+133.7J∙(K∙mol)-1 ①该反应在
②一定温度下,在一个恒容密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是
A.c(CO)=c(H2)
B.1molH-H键断裂的同时生成2mol H-O键
C.容器中的压强不变
D.v正(CO)=v逆(H2O)
(3)汽车尾气含NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)
 2NO(g) ∆H>0 ,已知该反应在2404℃时,平衡常数K=6.4×10-3,该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应
2NO(g) ∆H>0 ,已知该反应在2404℃时,平衡常数K=6.4×10-3,该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应
您最近一年使用:0次
9 . 反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g);△H>0,在一容积可变的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g);△H>0,在一容积可变的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率_______ (填“增大”“不变”或“减小”,下同),平衡_______ 移动(填“不”“向正反应方向”或“向逆反应方向”,下同)。
(2)将容器的体积缩小一半,其正反应速率_______ ,平衡_______ 移动。
(3)升高温度,其正反应速率_______ ,平衡_______ 移动。
(4)保持体积不变,充入水蒸气,其正反应速率_______ ,平衡_______ 移动。
(5)若要加快该反应的反应速率,可采取的措施有_______ 、_______ 。
 Fe3O4(s)+4H2(g);△H>0,在一容积可变的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g);△H>0,在一容积可变的密闭容器中进行,试回答:(1)增加Fe的量,其正反应速率
(2)将容器的体积缩小一半,其正反应速率
(3)升高温度,其正反应速率
(4)保持体积不变,充入水蒸气,其正反应速率
(5)若要加快该反应的反应速率,可采取的措施有
您最近一年使用:0次
10 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。已知二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),请回答下列问题:合成总反应在起始物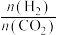 =3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250 ℃下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。
=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250 ℃下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。
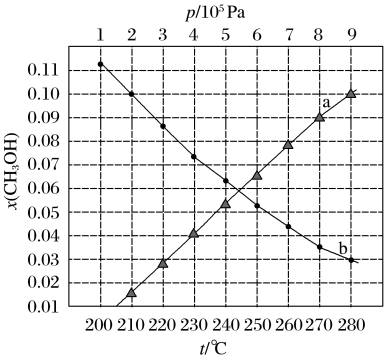
当x(CH3OH)=0.10时,CO2的平衡转化率α=___________ ,反应条件可能为___________ 或___________ 。
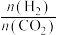 =3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250 ℃下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。
=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250 ℃下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。
当x(CH3OH)=0.10时,CO2的平衡转化率α=
您最近一年使用:0次



