名校
1 . 利用现代传感技术探究压强对 2NO2(g)  N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的 NO2气体后密封并保持活塞位置不变。分别在 t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列分析中不正确的是
N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的 NO2气体后密封并保持活塞位置不变。分别在 t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列分析中不正确的是
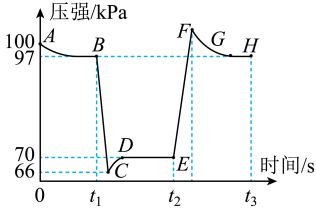
 N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的 NO2气体后密封并保持活塞位置不变。分别在 t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列分析中不正确的是
N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的 NO2气体后密封并保持活塞位置不变。分别在 t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列分析中不正确的是
| A.t1时移动活塞,使容器体积增大 |
| B.在 B、E 两点,对应的正反应速率:v(B)>v(E) |
| C.图中除 A、C、F 点外,其他点均为平衡状态 |
| D.在 E,F,H 三点中,H 点的气体平均相对分子质量最大 |
您最近一年使用:0次
2021-01-11更新
|
560次组卷
|
3卷引用:湖南省株洲市2021届高三教学质量统一检测(一)化学试题
湖南省株洲市2021届高三教学质量统一检测(一)化学试题湖南师范大学附属中学2022届高三月考(七)化学试题(已下线)专题09 化学反应速率与化学平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)
名校
解题方法
2 . 某密闭容器内,可逆反应2X(?) ⇌ Y(g)+Z(s)达到平衡。则有
| A.恒容时升高温度,气体的密度增大,X一定为非气态物质 |
| B.恒温时缩小容积,气体的相对平均分子量有可能不变 |
| C.恒温恒容时,加入少量Z,则平衡向左移动 |
| D.恒温恒容时催化剂加入,Z的质量会增加 |
您最近一年使用:0次
2020-12-31更新
|
336次组卷
|
4卷引用:上海市奉贤区2021届高三一模化学试卷
上海市奉贤区2021届高三一模化学试卷上海市行知中学2021届高三下学期3月月考化学试题(已下线)第七章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测(已下线)练习8 化学平衡的移动-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)
解题方法
3 . CH4和CO2在催化剂作用下反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)-247kJ完成下列填空:
2CO(g)+2H2(g)-247kJ完成下列填空:
(1)有利于提高CH4平衡转化率的措施是___ (任写两条)。
(2)该反应温度控制在550~750℃之间,从反应速率角度分析,选择该温度范围的可能原因:___ 。
(3)CH4和CO2各1mol充入密闭容器中,发生上述反应。
①300℃,100kPa,反应达到平衡时CO2体积分数与温度的关系如图中曲线所示。则n(平衡时气体):n(初始气体)=___ 。
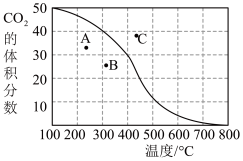
②若A、B、C三点表示不同温度和压强下已达平衡时CO2体积分数,___ 点对应的平衡常数最小,理由是:___ ;___ 点对应压强最大,理由是:___ 。
(4)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应又使积碳量减少:
积碳反应:CH4(g) C(s)+2H2(g)-75kJ
C(s)+2H2(g)-75kJ
消碳反应:CO2(g)+C(s) 2CO(g)-172kJ
2CO(g)-172kJ
一定时间内,积碳量和反应温度的关系如图所示。
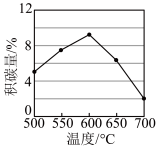
①一定温度,增大CO2的浓度有助于减少积碳,其原因是:___ 。
②温度高于600℃,积碳量减少的可能原因是:___ (任写一条)。
 2CO(g)+2H2(g)-247kJ完成下列填空:
2CO(g)+2H2(g)-247kJ完成下列填空:(1)有利于提高CH4平衡转化率的措施是
(2)该反应温度控制在550~750℃之间,从反应速率角度分析,选择该温度范围的可能原因:
(3)CH4和CO2各1mol充入密闭容器中,发生上述反应。
①300℃,100kPa,反应达到平衡时CO2体积分数与温度的关系如图中曲线所示。则n(平衡时气体):n(初始气体)=

②若A、B、C三点表示不同温度和压强下已达平衡时CO2体积分数,
(4)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应又使积碳量减少:
积碳反应:CH4(g)
 C(s)+2H2(g)-75kJ
C(s)+2H2(g)-75kJ消碳反应:CO2(g)+C(s)
 2CO(g)-172kJ
2CO(g)-172kJ一定时间内,积碳量和反应温度的关系如图所示。

①一定温度,增大CO2的浓度有助于减少积碳,其原因是:
②温度高于600℃,积碳量减少的可能原因是:
您最近一年使用:0次
2020-12-30更新
|
269次组卷
|
2卷引用:上海市杨浦区2021届高三一模化学试卷
名校
解题方法
4 . 一定条件下,可逆反应N2+3H2 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是 | A.加催化剂,v正、v逆都发生变化,且变化的倍数相等 |
| B.加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数 |
| C.降温,v正、v逆都减小,且v正减小的倍数大于v逆减小的倍数 |
| D.增大氮气的浓度,N2转化率减小,H2转化率增大 |
您最近一年使用:0次
2020-12-27更新
|
112次组卷
|
3卷引用:宁夏吴忠中学2020-2021学年高二上学期期末考试化学试题
名校
5 . 一定温度下,在3个容积均为1.0 L的恒容密闭容器中发生反应:PCl5 (g)  PCl3(g)+Cl2(g)。下列说法错误的是
PCl3(g)+Cl2(g)。下列说法错误的是
 PCl3(g)+Cl2(g)。下列说法错误的是
PCl3(g)+Cl2(g)。下列说法错误的是| 容器编号 | 物质的起始浓度/(mol·L-1) | 物质的平衡浓度/(mol·L-1) | ||
 | 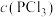 | 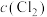 | 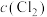 | |
| Ⅰ | 0.4 | 0 | 0 | 0.2 |
| Ⅱ | 0.6 | 0 | 0.2 | |
| Ⅲ | 0.8 | 0 | 0 | |
A.反应达到平衡时,容器I中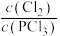 比容器Ⅱ中的小 比容器Ⅱ中的小 |
| B.反应达到平衡时,容器I与容器Ⅱ中的总压强之比为3︰4 |
C.反应达到平衡时,容器Ⅲ中 的体积分数小于 的体积分数小于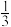 |
| D.反应达到平衡时,容器Ⅲ中0.4mol/L<c(PCl5)<0.8 mol/L |
您最近一年使用:0次
2020-09-29更新
|
725次组卷
|
6卷引用:广东省汕头市金山中学2020-2021学年高二上学期期末考试化学试题
名校
解题方法
6 . 运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3、FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
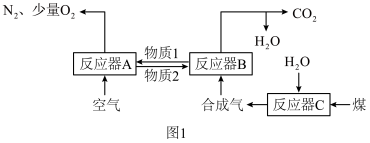
以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图1所示。
①C(s)+H2O(g)═CO(g)+H2(g)△H1=akJ•mol﹣1
②CO(g)+H2(g)+O2(g)═CO2(g)+H2O(g)△H2=bkJ•mol﹣1
(1)写出图1中总反应的热化学方程式:_____
(2)空气经反应器A后得到的尾气_____ (填“能”或“不能”)直接用作工业合成氨的原料气,原因是_____ 。
Ⅱ.用FeO作载氧剂,部分反应的lgKp[K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图2所示。
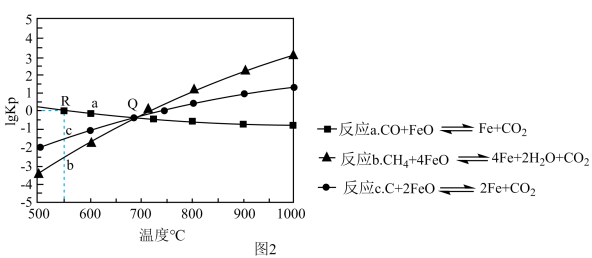
(3)图2涉及的反应中,属于吸热反应的是反应_____ (填字母)。
(4)R点对应温度下,向某恒容密闭容器中通入1mol CO,并加入足量的FeO,只发生反应CO(g)+FeO(s)⇌Fe(s)+CO2(g),则CO的平衡转化率为_____ 。
Ⅲ.在T℃下,向某恒容密闭容器中加入1mol CH4(g)和4mol FeO(s)进行反应:CH4(g)+4FeO(s)⇌4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为p0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp=_____ 。
(6)若起始时向该容器中加入1mol CH4(g),4mol FeO(s),1mol H2O(g),0.5mol CO2(g),此时反应向_____ (填“正反应”或“逆反应”)方向进行。
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4(g)的平衡转化率_____ (填“增大”“减小”或“不变”)。

以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图1所示。
①C(s)+H2O(g)═CO(g)+H2(g)△H1=akJ•mol﹣1
②CO(g)+H2(g)+O2(g)═CO2(g)+H2O(g)△H2=bkJ•mol﹣1
(1)写出图1中总反应的热化学方程式:
(2)空气经反应器A后得到的尾气
Ⅱ.用FeO作载氧剂,部分反应的lgKp[K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图2所示。

(3)图2涉及的反应中,属于吸热反应的是反应
(4)R点对应温度下,向某恒容密闭容器中通入1mol CO,并加入足量的FeO,只发生反应CO(g)+FeO(s)⇌Fe(s)+CO2(g),则CO的平衡转化率为
Ⅲ.在T℃下,向某恒容密闭容器中加入1mol CH4(g)和4mol FeO(s)进行反应:CH4(g)+4FeO(s)⇌4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为p0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp=
(6)若起始时向该容器中加入1mol CH4(g),4mol FeO(s),1mol H2O(g),0.5mol CO2(g),此时反应向
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4(g)的平衡转化率
您最近一年使用:0次
2020-07-23更新
|
292次组卷
|
5卷引用:新疆生产建设兵团第九师龙珍高级中学2021-2022学年高三上学期第一次月考化学试题
名校
解题方法
7 . 三氧化钼( )是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为
)是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为 )通过一定条件来制备。回答下列相关问题:
)通过一定条件来制备。回答下列相关问题:
⑴已知:①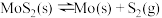

②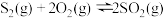

③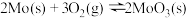

则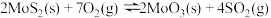 的
的
________ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
⑵若在恒温恒容条件下,仅发生反应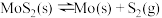 。
。
①下列说法正确的是________ (填字母)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加 的量,平衡正向移动
的量,平衡正向移动
②达到平衡时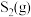 的浓度为1.4 mol·L−1,充入一定量的
的浓度为1.4 mol·L−1,充入一定量的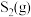 ,反应再次达到平衡,
,反应再次达到平衡,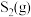 浓度
浓度________ (填“ ”“
”“ ”或“
”或“ ”) 1.4 mol·L−1。
”) 1.4 mol·L−1。
⑶在 恒容密闭容器中充入
恒容密闭容器中充入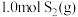 和
和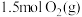 ,若仅发生反应:
,若仅发生反应: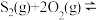
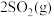 ,
,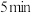 后反应达到平衡,此时容器压强为起始时的80%,则
后反应达到平衡,此时容器压强为起始时的80%,则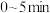 内,
内,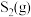 的反应速率为
的反应速率为________ 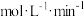 。
。
⑷在恒容密闭容器中,加入足量的 和
和 ,仅发生反应:
,仅发生反应: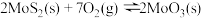

 。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
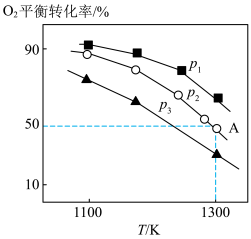
①
________ (填“ ”“
”“ ”或“
”或“ ”)0;比较
”)0;比较 、
、 、
、 的大小:
的大小:________ 。
②若初始时通入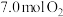 ,
, 为
为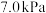 ,则
,则 点平衡常数
点平衡常数
________ (用气体平衡分压代替气体平衡浓度计算,分压 总压
总压 气体的物质的量分数,写出计算式即可)。
气体的物质的量分数,写出计算式即可)。
 )是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为
)是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为 )通过一定条件来制备。回答下列相关问题:
)通过一定条件来制备。回答下列相关问题:⑴已知:①
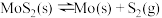

②
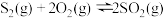

③
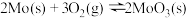

则
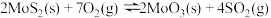 的
的
 、
、 、
、 的代数式表示)。
的代数式表示)。⑵若在恒温恒容条件下,仅发生反应
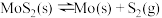 。
。①下列说法正确的是
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加
 的量,平衡正向移动
的量,平衡正向移动②达到平衡时
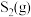 的浓度为1.4 mol·L−1,充入一定量的
的浓度为1.4 mol·L−1,充入一定量的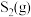 ,反应再次达到平衡,
,反应再次达到平衡,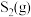 浓度
浓度 ”“
”“ ”或“
”或“ ”) 1.4 mol·L−1。
”) 1.4 mol·L−1。⑶在
 恒容密闭容器中充入
恒容密闭容器中充入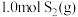 和
和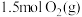 ,若仅发生反应:
,若仅发生反应: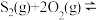
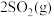 ,
,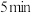 后反应达到平衡,此时容器压强为起始时的80%,则
后反应达到平衡,此时容器压强为起始时的80%,则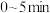 内,
内,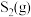 的反应速率为
的反应速率为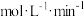 。
。⑷在恒容密闭容器中,加入足量的
 和
和 ,仅发生反应:
,仅发生反应: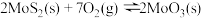

 。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
①

 ”“
”“ ”或“
”或“ ”)0;比较
”)0;比较 、
、 、
、 的大小:
的大小:②若初始时通入
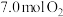 ,
, 为
为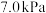 ,则
,则 点平衡常数
点平衡常数
 总压
总压 气体的物质的量分数,写出计算式即可)。
气体的物质的量分数,写出计算式即可)。
您最近一年使用:0次
2020-06-11更新
|
353次组卷
|
5卷引用:2021年秋季高三化学开学摸底考试卷01(山东专用)
(已下线)2021年秋季高三化学开学摸底考试卷01(山东专用)湖南省长沙市长郡中学2021-2022学年高二上学期第一次月考化学试题云南省楚雄彝族自治州2020届高三上学期期末考试理综化学试题陕西省2020届高三3月线上联考理综化学试题吉林省白山市2020届高三二模理综化学试卷
名校
解题方法
8 . 反应N2O4(g)  2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法不正确 的是
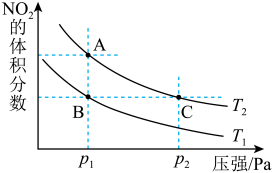
 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
| A.A点的反应速率小于C点的反应速率 |
| B.A、C两点气体的颜色:A浅,C深 |
| C.由状态B到状态A,可以用降温的方法 |
| D.A、C两点气体的平均相对分子质量:A<C |
您最近一年使用:0次
2020-04-02更新
|
1051次组卷
|
9卷引用:黑龙江省大庆中学2020—2021学年高二上学期期末考试化学试题
黑龙江省大庆中学2020—2021学年高二上学期期末考试化学试题浙江省衢州市四校2019--2020学年上学期期中联考高二化学试题河北省沧州市河间市第四中学2019-2020学年高二下学期期末模拟考试化学试卷黑吉两省十校2020-2021学年高二上学期期中联考(吉雅2校用)化学试题湖南省常德市外国语学校2020-2021学年高二上学期第二次月考化学试题江西省吉安县立中学2020-2021学年高二上学期12月月考化学(B班)试题山东省新泰市第一中学2022-2023学年高二上学期期中考试化学试题广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题山东省泰安新泰市第一中学(实验部)2023-2024学年高二上学期第一次质量检测化学试题
名校
解题方法
9 . 研究CO和CO2的应用对构建低碳、环保的生态文明型社会具有重要的意义。以CO和H2为原料可以制取甲醇。已知部分反应的热化学方程式如下:
反应Ⅰ CO(g)+2H2(g) CH3OH(g) ΔH=-99 kJ·mol-1
CH3OH(g) ΔH=-99 kJ·mol-1
反应Ⅱ CO2(g)+H2(g) CO(g)+H2O(l) ΔH=-3 kJ·mol-1
CO(g)+H2O(l) ΔH=-3 kJ·mol-1
反应Ⅲ H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
(1)反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的ΔH=
CH3OH(g)+H2O(g)的ΔH=____ kJ·mol-1。
(2)向T1℃的恒容密闭容器中充入一定量的CO和H2,发生反应Ⅰ,保持温度不变,测得CH3OH的物质的量随时间的变化关系如图所示。
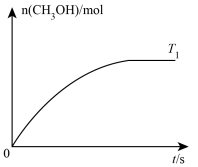
①下列条件可以判定反应到达平衡状态的是____ (填字母)。
A.2v正(H2)=v逆(CH3OH)
B.容器内气体的密度不变
C.容器内压强不变
D.反应不再释放热量
②在图中作出当其他条件不变,温度改为T2℃(T1<T2)时CH3OH的物质的量随时间的变化关系图。_____
(3)体积可变的密闭容器中,起始n(H2)/n(CO)=2.60时,反应Ⅰ体系中CO的平衡转化率(α)与温度和压强的关系如图所示。
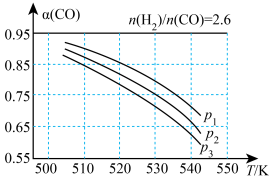
①α(CO)随温度升高而减小的原因是____ 。
②图中压强p1、p2、p3中最大的是____ 。
③若起始CO、H2、CH3OH的物质的量分别为0 mol、1.2 mol、2 mol,保持温度为530K、压强为p2,反应达到平衡时,CH3OH的转化率是____ 。
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是____ 。

反应Ⅰ CO(g)+2H2(g)
 CH3OH(g) ΔH=-99 kJ·mol-1
CH3OH(g) ΔH=-99 kJ·mol-1反应Ⅱ CO2(g)+H2(g)
 CO(g)+H2O(l) ΔH=-3 kJ·mol-1
CO(g)+H2O(l) ΔH=-3 kJ·mol-1反应Ⅲ H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
(1)反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)的ΔH=
CH3OH(g)+H2O(g)的ΔH=(2)向T1℃的恒容密闭容器中充入一定量的CO和H2,发生反应Ⅰ,保持温度不变,测得CH3OH的物质的量随时间的变化关系如图所示。

①下列条件可以判定反应到达平衡状态的是
A.2v正(H2)=v逆(CH3OH)
B.容器内气体的密度不变
C.容器内压强不变
D.反应不再释放热量
②在图中作出当其他条件不变,温度改为T2℃(T1<T2)时CH3OH的物质的量随时间的变化关系图。
(3)体积可变的密闭容器中,起始n(H2)/n(CO)=2.60时,反应Ⅰ体系中CO的平衡转化率(α)与温度和压强的关系如图所示。

①α(CO)随温度升高而减小的原因是
②图中压强p1、p2、p3中最大的是
③若起始CO、H2、CH3OH的物质的量分别为0 mol、1.2 mol、2 mol,保持温度为530K、压强为p2,反应达到平衡时,CH3OH的转化率是
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是

您最近一年使用:0次
2020-01-01更新
|
166次组卷
|
2卷引用:江苏省苏州实验中学2020--2021学年高二下学期5月份学情调研考试化学试题
名校
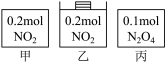
10 . 甲、乙、丙三个容器中最初存在的物质及其数量如图所示,三个容器最初的容积相等、温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是
| A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙 |
| B.平衡时N2O4的百分含量:乙>甲=丙 |
| C.平衡时甲中NO2与丙中N2O4的转化率不可能相同 |
| D.平衡时混合物的平均相对分子质量:甲>乙>丙 |
您最近一年使用:0次
2019-11-06更新
|
2243次组卷
|
28卷引用:黑龙江省龙东南六校2020-2021学年高二上学期期末联考化学试题
黑龙江省龙东南六校2020-2021学年高二上学期期末联考化学试题河南省林州市第一中学2020-2021学年高二下学期第二次月考化学试题选择性必修1 专题2 第三单元综合训练黑龙江省哈尔滨师范大学附属中学2021-2022学年高二上学期开学考试化学试题(已下线)选择性必修1 期中检测(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)山东省临沂市平邑县第一中学实验部2021-2022学年高二上学期第二次月考化学试题湖北省武汉市长虹中学2021-2022学年高二上学期10月月考化学试卷河南省洛阳市2021-2022学年高二上期期中考试化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期中阶段性检测化学试题山西省朔州市怀仁一中2019-2020学年高二上学期期中考试化学试题山东省新泰市第二中学2019-2020学年高二上学期期中考试化学试题步步为赢 高二化学寒假作业:作业六 化学平衡中的模型构建与等效平衡辽宁省辽阳市集美中学2020届高二12月月考化学试题江西省万载中学2019-2020学年高二12月月考(创新班)化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节综合训练高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 第二节综合训练黑龙江省哈尔滨三中2021届高三上学期期中考试化学试题天津市第一中学2021届高三上学期第二次月考化学试题(已下线)练习4 化学平衡-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)山西省寿阳县第一中学2020—2021学年高二上学期第二次月考化学试题江西省新余市2021-2022学年高二上学期期末检测化学试题云南省凤庆县第一中学2021-2022学年高二下学期3月份考试化学试题四川省广安市华蓥中学校2021-2022学年高二上学期11月月考化学试题山西省山西大学附属中学2022-2023学年高二上学期10月考化学试题2.3.1浓度 压强变化对化学平衡的影响 课后安徽省安庆市第二中学2023-2024学年高二上学期期中考试化学试卷山东省青岛第十七中学2023-2024学年高二上学期12月月考化学试题福建师范大学附属中学2023-2024学年高二上学期期中考试化学试题



