名校
1 . 将SO2转化为SO3是工业上生产硫酸的关键步骤,发生反应为: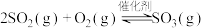
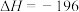 kJ⋅mol
kJ⋅mol ,某小组计划研究在相同温度下该反应的物质变化和能量变化,他们分别在恒温下的密闭容器中加入一定量的物质,获得如下数据:
,某小组计划研究在相同温度下该反应的物质变化和能量变化,他们分别在恒温下的密闭容器中加入一定量的物质,获得如下数据:
回答下列问题:
(1)若容器①的容积变为原来的2倍,则 的平衡转化率
的平衡转化率_______ (填“增大”“减小”或“不变”)。
(2)容器①②中均达到平衡时:
_______ (填“>”“<”或“=”,下同) ;放出热量
;放出热量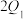
_______  。
。
(3) 与
与 在
在 作催化剂的条件下的反应历程如下:
作催化剂的条件下的反应历程如下:
① ;
;
②_______ (写出第2步反应的化学方程式);
 能加快反应速率的根本原因是
能加快反应速率的根本原因是_______ 。
(4)现向恒温恒容密闭容器中通入2 mol 和1 mol
和1 mol  ,反应
,反应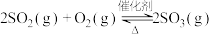 达到平衡后,再通入一定量
达到平衡后,再通入一定量 ,达到新平衡时,下列有关判断错误的是_______
,达到新平衡时,下列有关判断错误的是_______
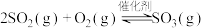
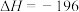 kJ⋅mol
kJ⋅mol ,某小组计划研究在相同温度下该反应的物质变化和能量变化,他们分别在恒温下的密闭容器中加入一定量的物质,获得如下数据:
,某小组计划研究在相同温度下该反应的物质变化和能量变化,他们分别在恒温下的密闭容器中加入一定量的物质,获得如下数据:| 容器编号 | 容器体积/L | 起始时各物质的物质的量/mol | 达到平衡的时间/min | 平衡时反应热量变化/kJ | ||
 |  |  | ||||
| ① | 1 | 0.050 | 0.030 |  |  | 放出热量: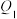 |
| ② | 1 | 0.100 | 0.060 |  |  | 放出热量: |
(1)若容器①的容积变为原来的2倍,则
 的平衡转化率
的平衡转化率(2)容器①②中均达到平衡时:

 ;放出热量
;放出热量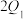
 。
。(3)
 与
与 在
在 作催化剂的条件下的反应历程如下:
作催化剂的条件下的反应历程如下:①
 ;
;②
 能加快反应速率的根本原因是
能加快反应速率的根本原因是(4)现向恒温恒容密闭容器中通入2 mol
 和1 mol
和1 mol  ,反应
,反应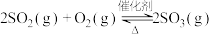 达到平衡后,再通入一定量
达到平衡后,再通入一定量 ,达到新平衡时,下列有关判断错误的是_______
,达到新平衡时,下列有关判断错误的是_______A. 的平衡浓度增大 的平衡浓度增大 | B.反应平衡常数增大 |
| C.正向反应速率增大 | D. 的转化总量增大 的转化总量增大 |
您最近一年使用:0次
解题方法
2 . I.研究和深度开发 CO,CO2的应用对构建生态文明社会具有重要的意义。
(1)CO 可用于炼铁。
已知:a.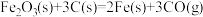 △H1=+489.0kJ·mol-1
△H1=+489.0kJ·mol-1
b.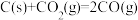 △H2=+172.5 kJ·mol-1
△H2=+172.5 kJ·mol-1
则 △H=
△H=______ 。
(2)CO2和 H2充入一定体积的密闭容器中,在两种温度下发生反应: △H,测得 CH3OH 的物质的量随时间的变化如图所示。
△H,测得 CH3OH 的物质的量随时间的变化如图所示。

①T1______ T2,△H______ 0(填“>”“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则 c的取值范围为______ 。
Ⅱ.固体氧化物电解池(SOEC)用于高温共电解 CO2/H2O,既可高效制备合成气(CO+H2),又可实现 CO2的减排,其工作原理如图所示。
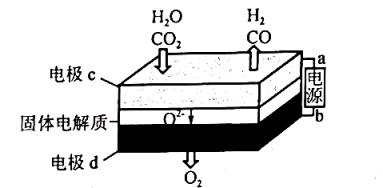
(1)a为电源的______ (填“正极”或“负极”);
(2)该电池是将电能转化为______ 能;请写出电极 c 发生的电极反应式:______ 、______ 。
(1)CO 可用于炼铁。
已知:a.
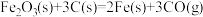 △H1=+489.0kJ·mol-1
△H1=+489.0kJ·mol-1 b.
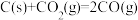 △H2=+172.5 kJ·mol-1
△H2=+172.5 kJ·mol-1则
 △H=
△H=(2)CO2和 H2充入一定体积的密闭容器中,在两种温度下发生反应:
 △H,测得 CH3OH 的物质的量随时间的变化如图所示。
△H,测得 CH3OH 的物质的量随时间的变化如图所示。
①T1
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1 mol CO2 、2 mol H2 | a mol CO2、b mol H2、c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则 c的取值范围为
Ⅱ.固体氧化物电解池(SOEC)用于高温共电解 CO2/H2O,既可高效制备合成气(CO+H2),又可实现 CO2的减排,其工作原理如图所示。

(1)a为电源的
(2)该电池是将电能转化为
您最近一年使用:0次
解题方法
3 . 化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种。且均符合勒夏特列原理。请回答下列问题。
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应A(g)+2B(g) 4C(g)∆H >0 达到平衡时,c(A)=2mol/L、c(B)=7mol/L、c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是
4C(g)∆H >0 达到平衡时,c(A)=2mol/L、c(B)=7mol/L、c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是_______ ;若改变条件重新达到平衡后,体系中C的质量分数增大,下列措施可行的是_______ 。
A.增加C的物质的量 B.加压 C.升温 D.使用催化剂
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。分析该溶液遇酚酞呈红色原因(用离子方程式表示)_______ 。
(3)关于小苏打(NaHCO3)溶液的表述错误的是( )
A. c(Na+)=c(HCO )+ c(CO
)+ c(CO )+c(H2CO3)
)+c(H2CO3)
B. c(Na+)+c(H+)=c(HCO )+ 2c(CO
)+ 2c(CO )+c(OH-)
)+c(OH-)
C. HCO 的电离程度大于其水解程度
的电离程度大于其水解程度
D. c(Na+)>c(HCO ) >c(OH-)>c(CO
) >c(OH-)>c(CO )
)
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应A(g)+2B(g)
 4C(g)∆H >0 达到平衡时,c(A)=2mol/L、c(B)=7mol/L、c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是
4C(g)∆H >0 达到平衡时,c(A)=2mol/L、c(B)=7mol/L、c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是A.增加C的物质的量 B.加压 C.升温 D.使用催化剂
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。分析该溶液遇酚酞呈红色原因(用离子方程式表示)
(3)关于小苏打(NaHCO3)溶液的表述错误的是
A. c(Na+)=c(HCO
 )+ c(CO
)+ c(CO )+c(H2CO3)
)+c(H2CO3)B. c(Na+)+c(H+)=c(HCO
 )+ 2c(CO
)+ 2c(CO )+c(OH-)
)+c(OH-)C. HCO
 的电离程度大于其水解程度
的电离程度大于其水解程度D. c(Na+)>c(HCO
 ) >c(OH-)>c(CO
) >c(OH-)>c(CO )
)
您最近一年使用:0次
4 . 碳及其化合物种类繁多,在能源、化工、电池等方面有着广泛的用途。回答下列问题:
(1)已知:①
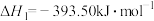
②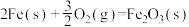
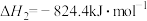
则

___________  。
。
(2)碳酸二乙酯(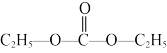 ,简称DEC)可用于锂离子电池电解液。在催化剂的作用下,利用乙醇、
,简称DEC)可用于锂离子电池电解液。在催化剂的作用下,利用乙醇、 和CO可直接反应制备DEC,反应如下:
和CO可直接反应制备DEC,反应如下: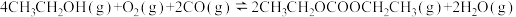
 。
。
①在恒温恒容的密闭容器中发生上述反应,能说明反应达到平衡状态的是___________ (填字母)。
a.
b.容器内气体的密度不变
c.容器内压强不变
d.DEC与 的物质的量之比为
的物质的量之比为
②一定条件下,分别向甲、乙、丙三个恒容密闭容器中加入一定量的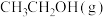 、
、 、
、 ,发生上述反应,各容器中温度、各物质的起始量如下表,反应过程中DEC的物质的量浓度随时间的变化如图所示:
,发生上述反应,各容器中温度、各物质的起始量如下表,反应过程中DEC的物质的量浓度随时间的变化如图所示:

上图中,a,b两点反应达到平衡。甲容器中,在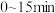 时间段内的平均反应速率
时间段内的平均反应速率
___________ ;乙容器中,若平衡时 ,则T1
,则T1___________ T2(填“>”“<”或“=”);T3℃时的平衡常数K=___________ 。
(1)已知:①

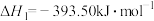
②
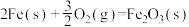
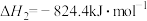
则


 。
。(2)碳酸二乙酯(
 ,简称DEC)可用于锂离子电池电解液。在催化剂的作用下,利用乙醇、
,简称DEC)可用于锂离子电池电解液。在催化剂的作用下,利用乙醇、 和CO可直接反应制备DEC,反应如下:
和CO可直接反应制备DEC,反应如下: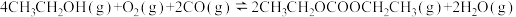
 。
。①在恒温恒容的密闭容器中发生上述反应,能说明反应达到平衡状态的是
a.

b.容器内气体的密度不变
c.容器内压强不变
d.DEC与
 的物质的量之比为
的物质的量之比为
容器 | 甲 | 乙 | 丙 |
容积/L | 0.4 | 0.4 | 0.2 |
温度/℃ | T1 | T2 | T3 |
| 起始量 | 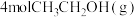 、 、 、 、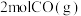 |  、 、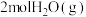 | 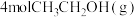 、 、 、 、 |
②一定条件下,分别向甲、乙、丙三个恒容密闭容器中加入一定量的
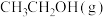 、
、 、
、 ,发生上述反应,各容器中温度、各物质的起始量如下表,反应过程中DEC的物质的量浓度随时间的变化如图所示:
,发生上述反应,各容器中温度、各物质的起始量如下表,反应过程中DEC的物质的量浓度随时间的变化如图所示:
上图中,a,b两点反应达到平衡。甲容器中,在
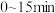 时间段内的平均反应速率
时间段内的平均反应速率
 ,则T1
,则T1
您最近一年使用:0次
5 . 碳及其化合物在生产、生活中广泛存在。请回答下列问题:K=
 已知某温度下某反应的化学平衡常数表达式为:
已知某温度下某反应的化学平衡常数表达式为: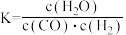 ,它所对应的化学反应为:
,它所对应的化学反应为:__________ 。
 已知在一定温度下,
已知在一定温度下,
①
 平衡常数
平衡常数
②
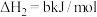 平衡常数
平衡常数
③
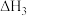 平衡常数
平衡常数
则 、
、 、
、 之间的关系是
之间的关系是
________ ,
___________  用含a、b的代数式表示
用含a、b的代数式表示 。
。
 煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:
煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应: ;该反应平衡常数随温度的变化如表所示:
;该反应平衡常数随温度的变化如表所示:
该反应的正反应方向是____ 反应 填“吸热”或“放热”
填“吸热”或“放热” ,若在
,若在 时进行,设起始时CO和
时进行,设起始时CO和 的起始浓度均为
的起始浓度均为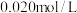 ,在该条件下,CO的平衡转化率为
,在该条件下,CO的平衡转化率为________ 。
 高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和
高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和 反应制备甲醇:
反应制备甲醇: 。请回答下列问题:
。请回答下列问题:
①若在相同温度和恒容且容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
则下列关系不正确的是___________ 。

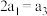



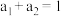

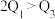
 该反应若生成
该反应若生成 ,则放出
,则放出 热量
热量
②若在一体积可变的密闭容器中充入 、
、 和
和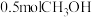 ,达到平衡时测得混合气体的密度是同温同压下起始的
,达到平衡时测得混合气体的密度是同温同压下起始的 倍,则该反应向
倍,则该反应向___  填“正”或“逆”
填“正”或“逆” 反应方向移动。
反应方向移动。
 已知某温度下某反应的化学平衡常数表达式为:
已知某温度下某反应的化学平衡常数表达式为: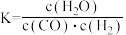 ,它所对应的化学反应为:
,它所对应的化学反应为: 已知在一定温度下,
已知在一定温度下,①

 平衡常数
平衡常数
②

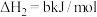 平衡常数
平衡常数
③

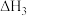 平衡常数
平衡常数
则
 、
、 、
、 之间的关系是
之间的关系是

 用含a、b的代数式表示
用含a、b的代数式表示 。
。 煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:
煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应: ;该反应平衡常数随温度的变化如表所示:
;该反应平衡常数随温度的变化如表所示:温度 | 400 | 500 | 800 |
| 平衡常数K |  | 9 | 1 |
 填“吸热”或“放热”
填“吸热”或“放热” ,若在
,若在 时进行,设起始时CO和
时进行,设起始时CO和 的起始浓度均为
的起始浓度均为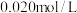 ,在该条件下,CO的平衡转化率为
,在该条件下,CO的平衡转化率为 高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和
高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和 反应制备甲醇:
反应制备甲醇: 。请回答下列问题:
。请回答下列问题:①若在相同温度和恒容且容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
| 容器 | 反应物投入的量 | 反应物的转化率 |  的浓度 的浓度 | 能量变化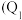 、 、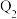 、 、 均大于 均大于 |
| 甲 | 1molCO和 | 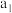 | 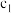 | 放出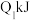 热量 热量 |
| 乙 |  | 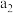 | 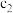 | 吸收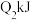 热量 热量 |
| 丙 | 2molCO和 | 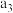 | 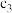 | 放出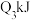 热量 热量 |

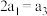



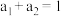

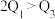
 该反应若生成
该反应若生成 ,则放出
,则放出 热量
热量②若在一体积可变的密闭容器中充入
 、
、 和
和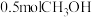 ,达到平衡时测得混合气体的密度是同温同压下起始的
,达到平衡时测得混合气体的密度是同温同压下起始的 倍,则该反应向
倍,则该反应向 填“正”或“逆”
填“正”或“逆” 反应方向移动。
反应方向移动。
您最近一年使用:0次
2020-11-16更新
|
103次组卷
|
2卷引用:安徽省黄山市屯溪第一中学2020-2021学年高二上学期期中考试化学试题
6 . 研究和深度开发 CO、CO2的应用对构建生态文明社会具有重要的意义。回答下列问题:
Ⅰ.CO 可用于高炉炼铁
已知: Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) △H1=akJ/mol;
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=bkJ/mol;
则反应 Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)的 △H3=______________ kJ/mol(用含 a、b 的代数式表示)。
Ⅱ.一定条件下,CO2和 CO 可以互相转化
(1)某温度下,在容积为 2 L 的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)。
甲容器 15min 后达到平衡,此时 CO2的转化率为 75%.则 0~15min 内平均反应速率 v(CO2)=____________ mol/(L·min),此条件下该反应的平衡常数 K=______________ 。欲使平衡后乙与甲中相同组分气体的体积分数相等,则ω、x、y、z 需满足的关系是 y _____________ z(填“>”、“<”或“=”),且 y=___________ (用含 x、w 的式子表示)。
(2)研究温度、压强对反应的影响:C6H5CH2CH3(g)+CO2(g)⇌C6H5CH=CH2(g)+CO(g)+H2O(g) △H C6H5CH2CH3(乙苯)的平衡转化率影响如下图所示:则△H_____ 0(填“>”“<”或“=”),压强 p1、p2、p3由小到大的排列顺序是____ 。

(3)CO 可被 NO2氧化,反应为 CO+NO2⇌CO2+NO,当温度高于 225℃时,反应速率 v 正=k 正⋅c(CO)⋅c(NO2)、v 逆=k 逆⋅c(CO2)⋅c(NO),k 正、k 逆分别为正、逆反应速率常数。在上述温度范围内,k 正、k 逆与该反应的平衡常数 K 之间的关系为________ 。
Ⅰ.CO 可用于高炉炼铁
已知: Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) △H1=akJ/mol;
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=bkJ/mol;
则反应 Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)的 △H3=
Ⅱ.一定条件下,CO2和 CO 可以互相转化
(1)某温度下,在容积为 2 L 的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)。
| 容器 | 反应物 |
| 甲 | 8molCO2(g)、16molH2(g) |
| 乙 | wmolCO2(g)、xmolH2(g)、ymolCO(g)、zmolH2O(g) |
(2)研究温度、压强对反应的影响:C6H5CH2CH3(g)+CO2(g)⇌C6H5CH=CH2(g)+CO(g)+H2O(g) △H C6H5CH2CH3(乙苯)的平衡转化率影响如下图所示:则△H

(3)CO 可被 NO2氧化,反应为 CO+NO2⇌CO2+NO,当温度高于 225℃时,反应速率 v 正=k 正⋅c(CO)⋅c(NO2)、v 逆=k 逆⋅c(CO2)⋅c(NO),k 正、k 逆分别为正、逆反应速率常数。在上述温度范围内,k 正、k 逆与该反应的平衡常数 K 之间的关系为
您最近一年使用:0次
解题方法
7 . A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的 通过
通过 、
、 分别充入A、B中,反应起始时,A、B的体积相同。(已知:
分别充入A、B中,反应起始时,A、B的体积相同。(已知: 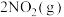

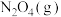
 )
)

(1).一段时间后,反应达到平衡,此时A、B中生成N2O4的速率是vA_____ vB (填“>”、“<”或“=”);若打开活塞 ,气球B将
,气球B将__________ (填“变大”、“变小”或“不变”).
(2).关闭活塞 ,若在A、B中再充入与初始量相等的
,若在A、B中再充入与初始量相等的 ,则达到平衡时, 再分别通入等量的氖气,则达到平衡时,A中
,则达到平衡时, 再分别通入等量的氖气,则达到平衡时,A中 的转化率将
的转化率将__________ ,B中 的转化率将
的转化率将__________ (填“变大”、“变小”或“不变”).
(3)若在A中充入4.6g NO2,达到平衡后容器内混合气体的平均摩尔质量为57.5g/mol,则平衡时N2O4的物质的量为_____ 。
 通过
通过 、
、 分别充入A、B中,反应起始时,A、B的体积相同。(已知:
分别充入A、B中,反应起始时,A、B的体积相同。(已知: 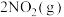

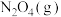
 )
)
(1).一段时间后,反应达到平衡,此时A、B中生成N2O4的速率是vA
 ,气球B将
,气球B将(2).关闭活塞
 ,若在A、B中再充入与初始量相等的
,若在A、B中再充入与初始量相等的 ,则达到平衡时, 再分别通入等量的氖气,则达到平衡时,A中
,则达到平衡时, 再分别通入等量的氖气,则达到平衡时,A中 的转化率将
的转化率将 的转化率将
的转化率将(3)若在A中充入4.6g NO2,达到平衡后容器内混合气体的平均摩尔质量为57.5g/mol,则平衡时N2O4的物质的量为
您最近一年使用:0次
2020-10-22更新
|
90次组卷
|
2卷引用:四川省宜宾翠屏棠湖学校2020-2021学年高二上学期10月月考化学试题
8 . 将2 mol I2(g)和1 mol H2置于某2 L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) 2HI(g) ΔH<0,并达平衡,HI的体积分数φ(HI)随时间变化如图曲线(Ⅱ)所示。
2HI(g) ΔH<0,并达平衡,HI的体积分数φ(HI)随时间变化如图曲线(Ⅱ)所示。
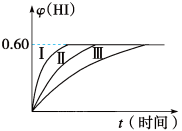
(1)达平衡时,I2(g)的物质的量浓度为_______ 。
(2)若保持温度不变,在另一相同的2 L的密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是______ 。
 2HI(g) ΔH<0,并达平衡,HI的体积分数φ(HI)随时间变化如图曲线(Ⅱ)所示。
2HI(g) ΔH<0,并达平衡,HI的体积分数φ(HI)随时间变化如图曲线(Ⅱ)所示。
(1)达平衡时,I2(g)的物质的量浓度为
(2)若保持温度不变,在另一相同的2 L的密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是
您最近一年使用:0次
解题方法
9 . 目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.
(1)向浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙 粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通 入CO2,制备纳米级碳酸钙的离子方程式为
粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通 入CO2,制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______ .
(2)一定条件下,C(s)和H2O(g)反应,能生成CO2(g)和H2(g),将C(s)和H2O(g)分别 加入甲、乙两个密闭容器中,发生反应:C(s)+2H2O(g) CO2(g)+2H2(g)其相关数 据如下表所示:
CO2(g)+2H2(g)其相关数 据如下表所示:
①T1℃时,该反应的平衡常数
______
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度____  填选项字母
填选项字母 .
.
A、=0.8mol·L-1 B、=1.4mol·L-1 C、<1.4mol·L-1 D、>1.4mol·L-1
③丙容器的容积为1L,T2℃时,起始充入a mol CO2(g)和b mol H2(g),反应达到平衡时,测得CO2的转化率大于 的转化率,则
的转化率,则 的值需满足的条件为
的值需满足的条件为 ______ ;
④丁容器的容积为1L, 时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是
时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 ______  填选项字母
填选项字母 .
.
A 0.6mol、1.0mol、0.5mol、1.0mol
B 0.6mol、2.0mol、0 mol、0 mol
C 1.0mol、2.0mol、1.0mol、2.0mol
D 0.25mol、0.5mol、0.75mol、1.5mol
(3)CO2在一定条件下可转化为甲醚CH3OCH3用甲醚燃料电池做电源,用惰性电极电 解饱和K2SO4溶液可制取H2SO4和KOH,实验装置如图所示

 甲醚燃料电池的负极反应式为
甲醚燃料电池的负极反应式为 ______
 口导出的物质为
口导出的物质为 ______  填化学式
填化学式 .
.
 若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C 口收集 到标准状况下气体的体积为
若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C 口收集 到标准状况下气体的体积为 ______ .
(1)向浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙
 粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通 入CO2,制备纳米级碳酸钙的离子方程式为
粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通 入CO2,制备纳米级碳酸钙的离子方程式为 (2)一定条件下,C(s)和H2O(g)反应,能生成CO2(g)和H2(g),将C(s)和H2O(g)分别 加入甲、乙两个密闭容器中,发生反应:C(s)+2H2O(g)
 CO2(g)+2H2(g)其相关数 据如下表所示:
CO2(g)+2H2(g)其相关数 据如下表所示:| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/mol | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 |  | 2 | 4 |  | 8 |
| 乙 | 1 |  | 1 | 2 |  | 3 |
①T1℃时,该反应的平衡常数

②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度
 填选项字母
填选项字母 .
.A、=0.8mol·L-1 B、=1.4mol·L-1 C、<1.4mol·L-1 D、>1.4mol·L-1
③丙容器的容积为1L,T2℃时,起始充入a mol CO2(g)和b mol H2(g),反应达到平衡时,测得CO2的转化率大于
 的转化率,则
的转化率,则 的值需满足的条件为
的值需满足的条件为 ④丁容器的容积为1L,
 时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是
时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是  填选项字母
填选项字母 .
.A 0.6mol、1.0mol、0.5mol、1.0mol
B 0.6mol、2.0mol、0 mol、0 mol
C 1.0mol、2.0mol、1.0mol、2.0mol
D 0.25mol、0.5mol、0.75mol、1.5mol
(3)CO2在一定条件下可转化为甲醚CH3OCH3用甲醚燃料电池做电源,用惰性电极电 解饱和K2SO4溶液可制取H2SO4和KOH,实验装置如图所示

 甲醚燃料电池的负极反应式为
甲醚燃料电池的负极反应式为  口导出的物质为
口导出的物质为  填化学式
填化学式 .
. 若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C 口收集 到标准状况下气体的体积为
若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C 口收集 到标准状况下气体的体积为
您最近一年使用:0次
名校
解题方法
10 . 接触法制硫酸工艺中,主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g) 
(1)上述反应的平衡常数表达式为___________ 。
(2)恒温恒容条件下,下列能说明此反应已达平衡的是______________ 。
a. v正(O2)=2v逆(SO3)
b. 容器中气体的密度不随时间而变化
c. 容器中气体的平均摩尔质量不随时间而变化
(3)下列有关该反应的叙述中,正确的是__________ 。
a. 升高温度可以增大活化分子百分数,加快反应速率
b. 使用催化剂提高二氧化硫的平衡转化率
c. 使用催化剂可以使反应物分子平均能量升高,加快反应速率
d. 缩小容器体积增大压强不能增大活化分子百分数,但可以加快反应速率
(4)一定温度下,在容积不变的密闭容器中充入4mol SO2和2mol O2,达平衡时SO2的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后SO2的体积分数仍为a%的是___________ 。
a. 2mol SO3 b. 2mol SO2+1mol O2
c. 4mol SO3 d. 2.5mol SO2+1.25mol O2+1.5mol SO3
(5)SO2与H2O反应生成H2SO3,H2SO3电离方程式为____________ ;将H2SO3溶液加入酸性KMnO4溶液中,溶液紫色褪去,将下列离子方程式补充完整:
_________ +_____ MnO4-=______ Mn2++_______________
2SO2(g)+O2(g)
 2SO3(g)
2SO3(g) 
(1)上述反应的平衡常数表达式为
(2)恒温恒容条件下,下列能说明此反应已达平衡的是
a. v正(O2)=2v逆(SO3)
b. 容器中气体的密度不随时间而变化
c. 容器中气体的平均摩尔质量不随时间而变化
(3)下列有关该反应的叙述中,正确的是
a. 升高温度可以增大活化分子百分数,加快反应速率
b. 使用催化剂提高二氧化硫的平衡转化率
c. 使用催化剂可以使反应物分子平均能量升高,加快反应速率
d. 缩小容器体积增大压强不能增大活化分子百分数,但可以加快反应速率
(4)一定温度下,在容积不变的密闭容器中充入4mol SO2和2mol O2,达平衡时SO2的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后SO2的体积分数仍为a%的是
a. 2mol SO3 b. 2mol SO2+1mol O2
c. 4mol SO3 d. 2.5mol SO2+1.25mol O2+1.5mol SO3
(5)SO2与H2O反应生成H2SO3,H2SO3电离方程式为
您最近一年使用:0次



