名校
解题方法
1 . 利用化学反应原理分析指导工业生产具有重要的现实意义,回答下列问题。___________ 。
(2)合成氨的反应,T1℃时在容积为2L的恒容密闭容器中通入2molN2和5molH2发生反应。5min时反应达到平衡状态,达平衡时N2(g)的转化率为50%,求:
①0~5min内该反应的平均速率v(H2)=___________ mol/(L•min);平衡常数K=___________ 。___________ (填序号)。
a.升高温度 b.将平衡体系中的NH3(g)分离出来
c.减小容器的体积增大体系压强 d.加入合适的催化剂
(3)泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式___________ 。
(2)合成氨的反应,T1℃时在容积为2L的恒容密闭容器中通入2molN2和5molH2发生反应。5min时反应达到平衡状态,达平衡时N2(g)的转化率为50%,求:
①0~5min内该反应的平均速率v(H2)=
②相同条件下,改变反应物的起始通入量,某时刻测得N2、H2、NH3的物质的量分别为2mol、4mol、2mol,则此时反应达到平衡状态 ),v正
),v正
a.升高温度 b.将平衡体系中的NH3(g)分离出来
c.减小容器的体积增大体系压强 d.加入合适的催化剂
(3)泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式
您最近一年使用:0次
解题方法
2 . 中国科学家首次实现了二氧化碳到淀粉的全合成,相关成果于北京时间 9 月 24 日由国际知名学术期刊《科学》在线发表。CO2的捕集、利用与封存是科学家研究的重要课题,利用 CH4与 CO2制备“合成气”(CO、H2),合成气可直接制备甲醇,反应原理为:
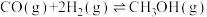
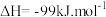 。
。
(1)已知: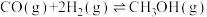
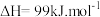 ,部分键能数据如下:(CO 的结构式为 C≡O)
,部分键能数据如下:(CO 的结构式为 C≡O)
计算 C—H 的键能 x= ______________ kJ/mol,(保留一位小数)。
(2)若要该反应自发进行,_______ (填“高温”或“低温”)更有利,该反应必须在高温下才能启动,原因是_______ 。
(3)已知:H2 (g)的燃烧热ΔH=-285.8kJ.mol-1,写出H2 (g)燃烧热的热化学反应方程式____________ 。
(4)在恒温,恒容密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是_______(填字母序号)。
(5)T1℃下,在 2L 恒容密闭容器中充入 2molCO 和 6molH2合成 CH3OH(g),测得 CO 的物质的量浓度随反应时间的变化如图所示:_______ 。
②T1℃时,该反应的化学平衡常数 K=_______ 。
③10min 时,改变的外界条件可能是_______ 。
(6)T1℃下,在 1L 恒容密闭容器中充入 2molCO、2molH2和 3molCH3OH(g),此时反应将_______ (填“向左进行”“向右进行”“达到平衡”或“无法判断”)。
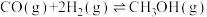
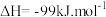 。
。(1)已知:
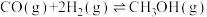
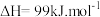 ,部分键能数据如下:(CO 的结构式为 C≡O)
,部分键能数据如下:(CO 的结构式为 C≡O)| 共价键 | C≡O | C—O | C—H | O—H | H—H |
| 键能/(kJ/mol) | 1072 | 326 | 464 | 436 |
(2)若要该反应自发进行,
(3)已知:H2 (g)的燃烧热ΔH=-285.8kJ.mol-1,写出H2 (g)燃烧热的热化学反应方程式
(4)在恒温,恒容密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是_______(填字母序号)。
| A.混合气体的平均相对分子质量不再变化 |
| B.混合气体的密度不再变化 |
| C.CO 的百分含量不再变化 |
| D.CO、H2、CH3OH 的物质的量之比为 1∶2∶1 |
(5)T1℃下,在 2L 恒容密闭容器中充入 2molCO 和 6molH2合成 CH3OH(g),测得 CO 的物质的量浓度随反应时间的变化如图所示:
②T1℃时,该反应的化学平衡常数 K=
③10min 时,改变的外界条件可能是
(6)T1℃下,在 1L 恒容密闭容器中充入 2molCO、2molH2和 3molCH3OH(g),此时反应将
您最近一年使用:0次
3 . 含氮化合物是化工、能源、环保等领域的研究热点。
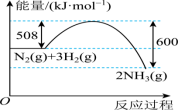
(1)工业上常用NH3和CO2合成尿素[CO(NH2)2],利用该反应可以在一定程度上减缓温室效应。该反应可分两步进行,其能量变化和反应历程如图所示___________ ;
②合成尿素总反应自发进行的条件是___________ (填“高温”或“低温”)。
(2)一定温度下,将NH3和CO2按2:1的物质的量之比充入一容积恒为10L的密闭容器中发生总反应。15min时达到平衡,各物质的浓度变化曲线如图所示。___________ g min﹣1。
min﹣1。
②下列叙述中能说明该反应达到平衡状态的是___________ (填选项字母)。
A.体系压强不再变化
B.NH3和CO2的浓度之比为2:1
C.气体平均摩尔质量不再变化
D.NH3的消耗速率和CO2的消耗速率之比为2:1
③25min时再向容器中充入2mol的NH3、1molCO2和2molH2O,则此时平衡___________ (填“正向移动”或“逆向移动”),再次平衡时总反应的平衡常数为 ___________ 。
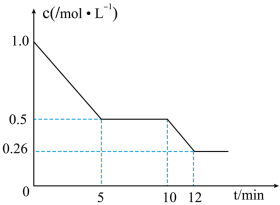
(3)汽车尾气已成为许多大城市空气的主要污染源,其中存在大量NO。中国科学家在以H2为还原剂清除NO的研究方面取得了显著成果,其化学方程式为2NO(g)+2H2(g)⇌N2(g)+2H2O(g) ΔH<0。当固定比例的NO(g)和H2(g)的混合气体,以相同流速分别通过填充有两种催化剂的反应器,测得NO的转化率与温度的关系如图所示。___________ 。
②M、N、P、Q四点中一定未达到平衡状态的是___________ (填字母)。
(1)工业上常用NH3和CO2合成尿素[CO(NH2)2],利用该反应可以在一定程度上减缓温室效应。该反应可分两步进行,其能量变化和反应历程如图所示

②合成尿素总反应自发进行的条件是
(2)一定温度下,将NH3和CO2按2:1的物质的量之比充入一容积恒为10L的密闭容器中发生总反应。15min时达到平衡,各物质的浓度变化曲线如图所示。

 min﹣1。
min﹣1。②下列叙述中能说明该反应达到平衡状态的是
A.体系压强不再变化
B.NH3和CO2的浓度之比为2:1
C.气体平均摩尔质量不再变化
D.NH3的消耗速率和CO2的消耗速率之比为2:1
③25min时再向容器中充入2mol的NH3、1molCO2和2molH2O,则此时平衡
(3)汽车尾气已成为许多大城市空气的主要污染源,其中存在大量NO。中国科学家在以H2为还原剂清除NO的研究方面取得了显著成果,其化学方程式为2NO(g)+2H2(g)⇌N2(g)+2H2O(g) ΔH<0。当固定比例的NO(g)和H2(g)的混合气体,以相同流速分别通过填充有两种催化剂的反应器,测得NO的转化率与温度的关系如图所示。
②M、N、P、Q四点中一定未达到平衡状态的是
您最近一年使用:0次
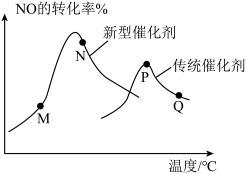
4 . I.T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如(Ⅱ)所示:
(1)反应的化学方程式为___________ 。
(2)当反应达到平衡后升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量___________ (填“变大”、“变小”或“不变”)。
Ⅱ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(3)一般说化学平衡常数数值K___________ ,通常认为该反应进行较完全。
(4)该反应为___________ 反应(填“吸热”或“放热”)。
(5)能判断该反应是否达到化学平衡状态的依据是___________。
(6)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试判断此时的温度为___________ 。
(1)反应的化学方程式为
(2)当反应达到平衡后升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量
Ⅱ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下表:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(3)一般说化学平衡常数数值K
(4)该反应为
(5)能判断该反应是否达到化学平衡状态的依据是___________。
| A.v正(H2) = v逆(H2O) | B.反应停止,正、逆反应速率都等于零 |
| C.容器中压强不再发生变化 | D.混合气体中c(CO2)不变 |
(6)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试判断此时的温度为
您最近一年使用:0次
5 . 请回答下列问题:
(1) 可发生二聚反应生成
可发生二聚反应生成 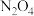 ,化学方程式为
,化学方程式为 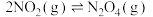 ,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
___________ 0(填“>”或“<”)。已知该反应的正反应速率方程为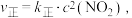 逆反应速率方程为
逆反应速率方程为 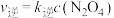 ,其中
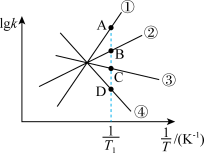
,其中 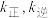 分别为正、逆反应的速率常数。则如图(
分别为正、逆反应的速率常数。则如图( 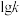 表示速率常数的对数;
表示速率常数的对数; 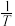 示温度的倒数)所示①、②、③、④四条斜线中,能表示
示温度的倒数)所示①、②、③、④四条斜线中,能表示 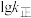 随
随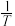 变化关系的是斜线
变化关系的是斜线___________ ,能表示 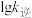 随
随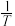 变化关系的是斜线
变化关系的是斜线___________ 。
(2)图中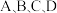 点的纵坐标分别为
点的纵坐标分别为 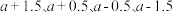 ,则温度
,则温度  时化学平衡常数K=
时化学平衡常数K=___________ mol/L。已知温度  时,某时刻恒容密闭容器中
时,某时刻恒容密闭容器中 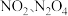 浓度均为
浓度均为 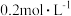 ,此时v正
,此时v正___________ v逆(填“>”“<”或“=”)。
(1)
 可发生二聚反应生成
可发生二聚反应生成 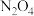 ,化学方程式为
,化学方程式为 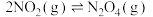 ,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
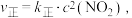 逆反应速率方程为
逆反应速率方程为 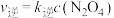 ,其中
,其中 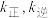 分别为正、逆反应的速率常数。则如图(
分别为正、逆反应的速率常数。则如图( 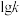 表示速率常数的对数;
表示速率常数的对数; 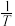 示温度的倒数)所示①、②、③、④四条斜线中,能表示
示温度的倒数)所示①、②、③、④四条斜线中,能表示 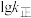 随
随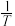 变化关系的是斜线
变化关系的是斜线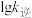 随
随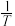 变化关系的是斜线
变化关系的是斜线
(2)图中
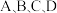 点的纵坐标分别为
点的纵坐标分别为 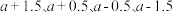 ,则温度
,则温度  时化学平衡常数K=
时化学平衡常数K= 时,某时刻恒容密闭容器中
时,某时刻恒容密闭容器中 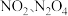 浓度均为
浓度均为 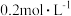 ,此时v正
,此时v正
您最近一年使用:0次
名校
解题方法
6 . 以CO2和H2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向。
(1)工业上常用CO2和H2为原料合成甲醇(CH3OH),过程中发生如下两个反应:
反应I:
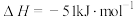
反应Ⅱ:
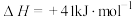
①已知几种化学键的键能如下表所示,则a=_____ kJ·mol-1.
②若反应Ⅱ逆反应活化能 ,则该反应的正反应的活化能
,则该反应的正反应的活化能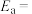
_____ kJ·mol-1.
(2)向2L容器中充入1molCO2和2molH2,若只发生反应I,测得反应在不同压强下平衡混合物中甲醇体积分数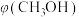 随温度变化如图1所示,逆反应速率与容器中
随温度变化如图1所示,逆反应速率与容器中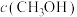 关系如图2所示:
关系如图2所示:
①图1中P1_____ P2(填“>”、“<”或“=”);
②图2中x点平衡体系时升温,反应重新达平衡状态时新平衡点可能是_____ (填字母序号)。 、
、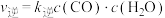 ,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是
,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是_____ ,表示lgk逆随温度T变化关系的直线是_____ 。
(4)已知一定温度下按照起始比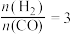 ,在一密闭容器中进行反应:
,在一密闭容器中进行反应: ,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
_____ MPa-2(保留2位有效数字)(各气体分压=平衡体系中各气体的体积分数×总压)。
(5)
 ,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。
,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。
(1)工业上常用CO2和H2为原料合成甲醇(CH3OH),过程中发生如下两个反应:
反应I:

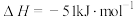
反应Ⅱ:

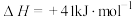
①已知几种化学键的键能如下表所示,则a=
| 化学键 | C—H | C—O | H—O | H—H | C≡O |
| 键能/kJ·mol-1 | 406 | 351 | 465 | 436 | a |
 ,则该反应的正反应的活化能
,则该反应的正反应的活化能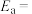
(2)向2L容器中充入1molCO2和2molH2,若只发生反应I,测得反应在不同压强下平衡混合物中甲醇体积分数
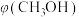 随温度变化如图1所示,逆反应速率与容器中
随温度变化如图1所示,逆反应速率与容器中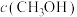 关系如图2所示:
关系如图2所示:①图1中P1
②图2中x点平衡体系时升温,反应重新达平衡状态时新平衡点可能是

 、
、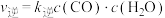 ,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是
,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是(4)已知一定温度下按照起始比
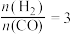 ,在一密闭容器中进行反应:
,在一密闭容器中进行反应: ,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
(5)
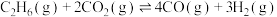
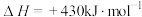 ,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。
,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。| A.恒温恒容容器 | B.恒容绝热容器 |
| C.恒压绝热容器 | D.恒温恒压容器 |
您最近一年使用:0次
解题方法
7 . 以下是关于合成氨的有关问题,请回答:
(1)在合成氨工业中I2O5常用于定量测定CO的含量,I2O5能将CO氧化为CO2,I2O5被还原为I2。已知
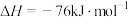 ;
;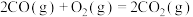
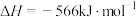 。则该测定反应的热化学方程式为
。则该测定反应的热化学方程式为___________ 。
(2)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:
 ,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时
,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时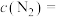
___________ ,平衡时H2的转化率为___________ %。
(3)平衡后,若提高H2的转化率,可以采取的措施有___________。
(4)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:
 ,其化学平衡常数K与温度T的关系如表所示:
,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①写出化学平衡常数K的表达式___________ 。
②试比较 、
、 的大小,
的大小,
___________  (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
③400°C时,反应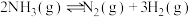 的化学平衡常数为
的化学平衡常数为___________ 。当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的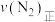
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(1)在合成氨工业中I2O5常用于定量测定CO的含量,I2O5能将CO氧化为CO2,I2O5被还原为I2。已知

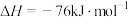 ;
;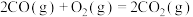
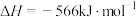 。则该测定反应的热化学方程式为
。则该测定反应的热化学方程式为(2)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:

 ,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时
,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时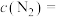
(3)平衡后,若提高H2的转化率,可以采取的措施有___________。
| A.加了催化剂 | B.增大容器体积 |
| C.降低反应体系的温度 | D.加入一定量N2 |
(4)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:

 ,其化学平衡常数K与温度T的关系如表所示:
,其化学平衡常数K与温度T的关系如表所示:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①写出化学平衡常数K的表达式
②试比较
 、
、 的大小,
的大小,
 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);③400°C时,反应
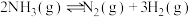 的化学平衡常数为
的化学平衡常数为
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
解题方法
8 . 亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应2NO(g)+Cl2(g) 2ClNO(g)获得。
2ClNO(g)获得。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及以下反应:
①2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g) 2ClNO(g) K3
2ClNO(g) K3
则K3=___________ (用K1和K2表示)。
(2)已知几种化学键的键能数据如表所示(亚硝酰氯的结构为Cl-N=O):
则反应2NO(g)+Cl2(g) 2ClNO(g)的ΔH=
2ClNO(g)的ΔH=___________ kJ·mol-1(用含a的代数式表示)。
(3)按投料比n(NO)∶n(Cl2)=2∶1把NO和Cl2加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:

①该反应的ΔH___________ (填“>”“<”或“=”)0。
②在压强为p的条件下,M点时容器内NO的体积分数为___________ 。
③若反应一直保持在压强为p条件下进行,则M点的压强平衡常数Kp=___________ (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数(φ)随 的变化关系如图B所示。则A、B、C三点对应状态中,NO的转化率最大的是
的变化关系如图B所示。则A、B、C三点对应状态中,NO的转化率最大的是___________ 点,当 =1.5时,达到平衡状态时ClNO的体积分数φ可能对应D、E、F三点中的
=1.5时,达到平衡状态时ClNO的体积分数φ可能对应D、E、F三点中的___________ 点。

 2ClNO(g)获得。
2ClNO(g)获得。(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及以下反应:
①2NO2(g)+NaCl(s)
 NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1②4NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2③2NO(g)+Cl2(g)
 2ClNO(g) K3
2ClNO(g) K3则K3=
(2)已知几种化学键的键能数据如表所示(亚硝酰氯的结构为Cl-N=O):
| 化学键 | N≡O | Cl—Cl | Cl—N | N=O |
| 键能/kJ·mol-1 | 630 | 243 | a | 607 |
 2ClNO(g)的ΔH=
2ClNO(g)的ΔH=(3)按投料比n(NO)∶n(Cl2)=2∶1把NO和Cl2加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:

①该反应的ΔH
②在压强为p的条件下,M点时容器内NO的体积分数为
③若反应一直保持在压强为p条件下进行,则M点的压强平衡常数Kp=
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数(φ)随
 的变化关系如图B所示。则A、B、C三点对应状态中,NO的转化率最大的是
的变化关系如图B所示。则A、B、C三点对应状态中,NO的转化率最大的是 =1.5时,达到平衡状态时ClNO的体积分数φ可能对应D、E、F三点中的
=1.5时,达到平衡状态时ClNO的体积分数φ可能对应D、E、F三点中的
您最近一年使用:0次
解题方法
9 . Ⅰ.在密闭容器中充入2molN2和6molH2,容器体积为5L,在一定温度下催化反应N2(g)+3H2(g) 2NH3(g),NH3的物质的量浓度随时间的变化如图所示。
2NH3(g),NH3的物质的量浓度随时间的变化如图所示。
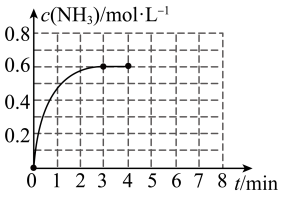
(1)①前3min内平均反应速率:v(H2)=______ ;
②平衡时,N2的转化率为_______ ;反应前后压强之比P前:P后=______ 。
③在此温度下,上述反应平衡常数K=______ 。
Ⅱ.工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
请回答下列问题:
(2)根据反应①与②可推导出K3=________ (用K1、K2表示);△H3_____ 0(用“>”或“<”表示);
(3)下列图像符合反应③的是_______。
 2NH3(g),NH3的物质的量浓度随时间的变化如图所示。
2NH3(g),NH3的物质的量浓度随时间的变化如图所示。
(1)①前3min内平均反应速率:v(H2)=
②平衡时,N2的转化率为
③在此温度下,上述反应平衡常数K=
Ⅱ.工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
| 化学反应 | 平衡常数符号 | 平衡常数值 | ||
| 500℃ | 700℃ | 800℃ | ||
| ①2H2(g)+CO(g)=CH3OH(g) △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)=CO(g)+H2O(g) △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H3 | K3 | |||
(2)根据反应①与②可推导出K3=
(3)下列图像符合反应③的是_______。
A.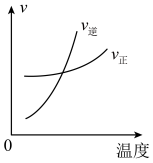 | B.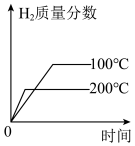 |
C.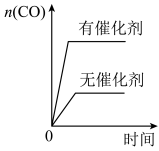 | D.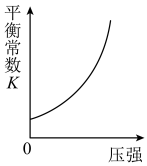 |
您最近一年使用:0次
解题方法
10 .  的资源化利用对碳循环经济技术的发展具有重要意义。
的资源化利用对碳循环经济技术的发展具有重要意义。
Ⅰ.利用 和
和 制备合成气(CO、
制备合成气(CO、 ),反应分两步进行:
),反应分两步进行:
反应①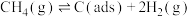

反应②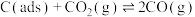

有关物质的相对能量与反应历程的变化如图所示[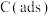 为吸附性活性炭]:
为吸附性活性炭]:
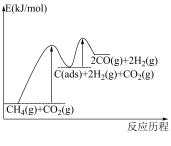
(1)总反应 能自发进行的条件为
能自发进行的条件为_______ 。
(2)总反应速率由反应_______ (填“①”或“②”)决定,增加 的浓度,
的浓度,_______ (填“能”或“不能”)显著提升总反应的速率。
Ⅱ.工业上可利用 生产燃料甲醇。该过程发生下列反应:
生产燃料甲醇。该过程发生下列反应:
反应③

反应④
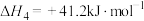
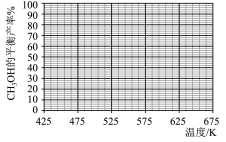
在5MPa的恒压反应器中,按照 投料,测得体系中平衡时
投料,测得体系中平衡时 和CO的选择性及
和CO的选择性及 的平衡转化率随温度的变化如图所示(选择性:转化的
的平衡转化率随温度的变化如图所示(选择性:转化的 中生成
中生成 或CO的百分比)。
或CO的百分比)。

(3)在425℃~675℃范围内(其他条件不变), 的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:
的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:_______ ,_______ 。
(4)下列说法正确的是_______(填字母)。
(5)反应④在545K时的平衡常数
_______ 。
(6)结合上图,在下图中画出 的平衡产率随温度的变化曲线
的平衡产率随温度的变化曲线_______ (标出B点坐标)。
 的资源化利用对碳循环经济技术的发展具有重要意义。
的资源化利用对碳循环经济技术的发展具有重要意义。Ⅰ.利用
 和
和 制备合成气(CO、
制备合成气(CO、 ),反应分两步进行:
),反应分两步进行:反应①
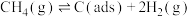

反应②
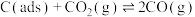

有关物质的相对能量与反应历程的变化如图所示[
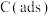 为吸附性活性炭]:
为吸附性活性炭]:
(1)总反应
 能自发进行的条件为
能自发进行的条件为(2)总反应速率由反应
 的浓度,
的浓度,Ⅱ.工业上可利用
 生产燃料甲醇。该过程发生下列反应:
生产燃料甲醇。该过程发生下列反应:反应③


反应④

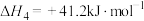
在5MPa的恒压反应器中,按照
 投料,测得体系中平衡时
投料,测得体系中平衡时 和CO的选择性及
和CO的选择性及 的平衡转化率随温度的变化如图所示(选择性:转化的
的平衡转化率随温度的变化如图所示(选择性:转化的 中生成
中生成 或CO的百分比)。
或CO的百分比)。
(3)在425℃~675℃范围内(其他条件不变),
 的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:
的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:(4)下列说法正确的是_______(填字母)。
| A.曲线Ⅱ代表CO的选择性随温度的变化 |
B.温度越低,越有利于工业生产 |
C.上述反应条件下, 的平衡转化率等于 的平衡转化率等于 的平衡转化率 的平衡转化率 |
D.原料气中掺入适量CO能提高 的产率 的产率 |
(5)反应④在545K时的平衡常数

(6)结合上图,在下图中画出
 的平衡产率随温度的变化曲线
的平衡产率随温度的变化曲线
您最近一年使用:0次



