1 . 化学与生活、生产、社会密切相关。下列说法错误的是
| A.加热食品时加热剂(生石灰和水)发生了能量变化,也伴随有物质变化 |
| B.水凝结成冰的过程中,△H<0,△S>0 |
| C.古人使用草木灰浸取液洗衣服与盐类水解原理有关 |
| D.航母上的钛合金铆钉可抗海水腐蚀 |
您最近一年使用:0次
2 . 丙烯是重要的有机化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义。回答下列问题:
(1)已知:Ⅰ.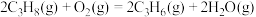
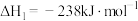
Ⅱ.
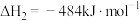
则丙烷脱氢制丙烯反应 的
的
____ ,
____ (填“>“<”或“=”)0。
(2)一定温度下,向 的密闭容器中充入
的密闭容器中充入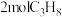 发生脱氢反应,经过
发生脱氢反应,经过 达到平衡状态,测得平衡时气体压强是开始的1.4倍。则
达到平衡状态,测得平衡时气体压强是开始的1.4倍。则 内氢气的生成速率
内氢气的生成速率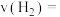
_____ , 的平衡转化率为
的平衡转化率为____ 。
(3)脱氢反应在压强分别为 和
和 时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示。
时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示。
_____ (填“>”或“<”) 。
。
②为了同时提高反应速率和反应物的平衡转化率,可采取的措施是______ 。
(1)已知:Ⅰ.
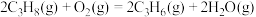
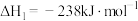
Ⅱ.

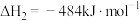
则丙烷脱氢制丙烯反应
 的
的

(2)一定温度下,向
 的密闭容器中充入
的密闭容器中充入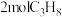 发生脱氢反应,经过
发生脱氢反应,经过 达到平衡状态,测得平衡时气体压强是开始的1.4倍。则
达到平衡状态,测得平衡时气体压强是开始的1.4倍。则 内氢气的生成速率
内氢气的生成速率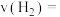
 的平衡转化率为
的平衡转化率为(3)脱氢反应在压强分别为
 和
和 时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示。
时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示。

 。
。②为了同时提高反应速率和反应物的平衡转化率,可采取的措施是
您最近一年使用:0次
解题方法
3 . 明代诗人于谦的《石灰吟》是一首托物言志诗。下列反应类型与诗句“千锤万凿出深山,烈火焚烧若等闲”没有关联的是
| A.吸热反应 | B.复分解反应 | C.分解反应 | D.熵增反应 |
您最近一年使用:0次
名校
解题方法
4 . 以水为原料,通过铁氧化物进行循环制氢,示意图如图。_______ 。若反应Ⅰ生成了标准状况下 的
的 ,则反应中转移的电子数目为
,则反应中转移的电子数目为_______ mol。
2.科学家用钴氧化物进行循环制氢,制氢过程中涉及 的化学反应,该反应的
的化学反应,该反应的 值与温度(K)的关系如图所示。下列判断正确的是_______。
值与温度(K)的关系如图所示。下列判断正确的是_______。

 的
的 ,则反应中转移的电子数目为
,则反应中转移的电子数目为2.科学家用钴氧化物进行循环制氢,制氢过程中涉及
 的化学反应,该反应的
的化学反应,该反应的 值与温度(K)的关系如图所示。下列判断正确的是_______。
值与温度(K)的关系如图所示。下列判断正确的是_______。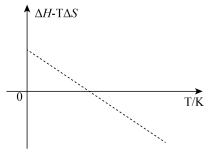
A. , , | B. , , |
C. , , | D. , , |
您最近一年使用:0次
名校
5 . 亚硝酰氯(NOCl)主要用于合成洗涤剂、催化剂,也可用作有机合成中间体。NOCl在一定频率(v)光的照射下会发生光解,其反应机理为:第一步: NOCl+hv→NOCl*; 第二步:  其中hv表示一个光子能量,NOCl*表示NOCl的激发态。
其中hv表示一个光子能量,NOCl*表示NOCl的激发态。
(1)以下均从选项中选择:第一步的焓变△H_____ 0;第二步的熵变△S____ 0填 (>,<,=)。
(2)激光照射下NOCl分子会发生解离,将产物通过质谱,发现存在m/z=30的离子峰,该峰对应的微粒是______(已知各产物微粒均带1个单位正电荷)。
 其中hv表示一个光子能量,NOCl*表示NOCl的激发态。
其中hv表示一个光子能量,NOCl*表示NOCl的激发态。(1)以下均从选项中选择:第一步的焓变△H
(2)激光照射下NOCl分子会发生解离,将产物通过质谱,发现存在m/z=30的离子峰,该峰对应的微粒是______(已知各产物微粒均带1个单位正电荷)。
| A.NOCl⁺ | B.NO⁺ | C.Cl⁺ | D.OCl⁺ |
您最近一年使用:0次
解题方法
6 . CO2的综合利用与工业合成氨:综合利用CO2、CO对实现“零排放”有重要意义。CH4-CO2催化重整是CO2利用的研究热点之一、其主要反应原理为: 。
。
已知:①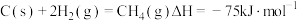 。
。
②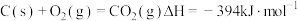 。
。
③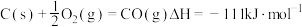 。
。
(1)固态CO2属于_______晶体,当它升华时,其中_______作用力发生了变化_______ 。
A.分子 共价键 B.分子 范德华力 C.共价 共价键
(2)根据盖斯定律,该催化重整反应的
_______  。写出该催化重整反应的平衡常数表达式
。写出该催化重整反应的平衡常数表达式
_______ 。
A.+247 B.-247 C.+358 D.-358
(3)请判断反应②常温下是否可自发进行?_______ (填可或不可)自发进行,并写出判断依据:_______ 。
(4)某温度下,在体积为2L的容器中加入1molCH4、2molCO2以及催化剂进行重整反应,10min时测得生成的CO是0.5mol。则0~10min内的平均反应速率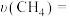
_______ 。
(5)若要加快CO的生成速率同时有利于提高CH4平衡转化率的条件是_______。
 。
。已知:①
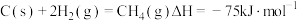 。
。②
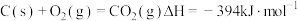 。
。③
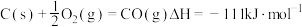 。
。(1)固态CO2属于_______晶体,当它升华时,其中_______作用力发生了变化
A.分子 共价键 B.分子 范德华力 C.共价 共价键
(2)根据盖斯定律,该催化重整反应的

 。写出该催化重整反应的平衡常数表达式
。写出该催化重整反应的平衡常数表达式
A.+247 B.-247 C.+358 D.-358
(3)请判断反应②常温下是否可自发进行?
(4)某温度下,在体积为2L的容器中加入1molCH4、2molCO2以及催化剂进行重整反应,10min时测得生成的CO是0.5mol。则0~10min内的平均反应速率
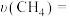
(5)若要加快CO的生成速率同时有利于提高CH4平衡转化率的条件是_______。
| A.高温 | B.高压 | C.使用催化剂 | D.增大 浓度 浓度 |
您最近一年使用:0次
7 . 五氧化二碘( )是一种重要的工业试剂,常温下为白色针状晶体,可作氧化剂除去气体中的一氧化碳。
)是一种重要的工业试剂,常温下为白色针状晶体,可作氧化剂除去气体中的一氧化碳。
已知:
反应I: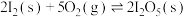


反应II: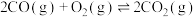


反应III: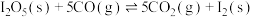


回答下列问题:
(1)对于反应I、II、III;
①
___________ (用含 、
、 的代数式表示),
的代数式表示),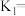
___________ (用含 、
、 的代数式表示)。
的代数式表示)。
②查阅资料可知,对于反应I, ,在
,在___________ (填“低温”“高温”或“任意温度”)下有利于该反应自发进行,判断的理由为___________ 。
(2) ℃时向盛有足量
℃时向盛有足量 (s)的VL恒容密闭容器中通入1.6molCO,此时压强为p,仅发生反应Ⅲ(该反应为放热反应)。
(s)的VL恒容密闭容器中通入1.6molCO,此时压强为p,仅发生反应Ⅲ(该反应为放热反应)。
①下列关于反应III的说法错误的是___________ (填标号)。
A.加入合适的催化剂,可实现CO的完全转化
B.该反应的反应物的能量总和大于生成物的能量总和
C.保持其他条件不变,仅适当降低温度,该反应的平衡常数增大
D.保持其他条件不变,仅适当增大压强, 的大小不发生改变
的大小不发生改变
② ℃时,若反应达到平衡后固体质量减小19.2g,该反应的平衡常数
℃时,若反应达到平衡后固体质量减小19.2g,该反应的平衡常数
___________ (分压=总压×物质的量分数);CO的平衡转化率随 的移出率[
的移出率[ 的移出率=
的移出率=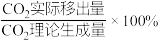 ]变化关系如,则a=
]变化关系如,则a=___________ ,b=___________ (保留3位有效数字)。
 )是一种重要的工业试剂,常温下为白色针状晶体,可作氧化剂除去气体中的一氧化碳。
)是一种重要的工业试剂,常温下为白色针状晶体,可作氧化剂除去气体中的一氧化碳。已知:
反应I:
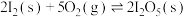


反应II:
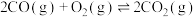


反应III:
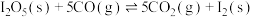


回答下列问题:
(1)对于反应I、II、III;
①

 、
、 的代数式表示),
的代数式表示),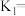
 、
、 的代数式表示)。
的代数式表示)。②查阅资料可知,对于反应I,
 ,在
,在(2)
 ℃时向盛有足量
℃时向盛有足量 (s)的VL恒容密闭容器中通入1.6molCO,此时压强为p,仅发生反应Ⅲ(该反应为放热反应)。
(s)的VL恒容密闭容器中通入1.6molCO,此时压强为p,仅发生反应Ⅲ(该反应为放热反应)。①下列关于反应III的说法错误的是
A.加入合适的催化剂,可实现CO的完全转化
B.该反应的反应物的能量总和大于生成物的能量总和
C.保持其他条件不变,仅适当降低温度,该反应的平衡常数增大
D.保持其他条件不变,仅适当增大压强,
 的大小不发生改变
的大小不发生改变②
 ℃时,若反应达到平衡后固体质量减小19.2g,该反应的平衡常数
℃时,若反应达到平衡后固体质量减小19.2g,该反应的平衡常数
 的移出率[
的移出率[ 的移出率=
的移出率=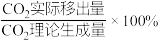 ]变化关系如,则a=
]变化关系如,则a=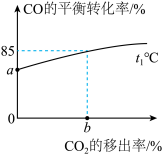
您最近一年使用:0次
8 . 水凝结成冰的过程中,其焓变和熵变正确的是
| A.ΔH>0,ΔS>0 | B.ΔH<0,ΔS>0 | C.ΔH<0,ΔS<0 | D.ΔH>0,ΔS<0 |
您最近一年使用:0次
2024-07-05更新
|
102次组卷
|
42卷引用:2011-2012学年河北省唐山一中高二上学期期中考试化学(理)试卷
(已下线)2011-2012学年河北省唐山一中高二上学期期中考试化学(理)试卷(已下线)2012年人教版高中化学选修4 2.4化学反应进行的方向练习卷(已下线)2013-2014学年云南省玉溪一中高二上学期期中考试化学试卷2014-2015学年广东省汕头市潮师高中高二上学期期中化学(理)试卷2015-2016学年河北成安一中、永年二中高二上期中联考化学试卷江西省抚州市临川区第一中学2017-2018学年高二上学期期中考试化学试题【全国校级联考】福建省闽侯第二中学、连江华侨中学等五校教学联合体2016-2017学年高二上学期期中考试化学试题新疆自治区阿克苏地区库车县伊西哈拉镇中学2018-2019学年高二上学期期中考试化学试题河南省安阳市安阳县第一高级中学2019-2020学年高二上学期期中考试化学试题新疆昌吉回族自治州玛纳斯县第一中学2019-2020学年高二上学期期中考试化学试题福建省泉州第十六中学2019-2020学年高二上学期期中考试化学(选考班)试题江西省新余市第一中学2019-2020学年高二上学期第二次段考试化学试题河北省沧州市肃宁县第一中学2019-2020学年高二上学期第四次月考化学试题陕西省榆林市绥德县绥德中学2019-2020学年高二下学期第二次阶段性测试化学试题(已下线)2.2.1 化学反应的方向(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)吉林省通化县综合高级中学2020-2021学年高二上学期期中考试化学试题湖南省张家界市2020-2021学年高二上学期期末考试化学试题辽宁省葫芦岛市第八高级中学2020-2021学年高二下学期期初考试实验班化学试题吉林省白山市抚松县第一中学2021-2022学年高二上学期开学考试验收化学试题浙江省绍兴鲁迅中学2021-2022学年高二上学期第一次限时训练化学试题人教2019版选择性必修一第二章 第三节 化学反应的方向 课后习题湖南省宁乡市第七高级中学2021-2022学年高二上学期期中考试化学试题黑龙江省双鸭山市第一中学2021-2022学年高二上学期期末考试化学试题(已下线)2.2.1 化学反应的方向(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)北京市丰台区2021~2022学年高二上学期期末考试化学试题河南省南阳市第一中学校2022-2023学年高二上学期开学考试化学试题天津市第二中学2022-2023学年高二上学期12月学情调查化学试题黑龙江省虎林市高级中学2022-2023学年高二上学期期中考试化学试题广东省广州市东涌中学2022-2023学年高二上学期期中考试化学试题湖北省黄冈市红安县第一中学2022-2023学年高二上学期元月月考化学试题天津市南开大学附属中学2022-2023学年高二上学期期末考试化学试卷上海市育才中学2022-2023学年高二下学期(等级考)期中调研化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期10月月考化学试题浙江省绍兴市第一中学2023-2024学年高二上学期11月期中考试(平行班)化学试题北京市第十五中学2022-2023学年高二上学期期中考试 化学试题北京市第一六一中学2023-2024学年高二上学期10月月考化学试题浙江省绍兴市柯桥区2023-2024学年高二上学期期末教学质量调测化学试题黑龙江省大庆实验中学实验二部2023-2024学年高二上学期期末考试化学试题内蒙古呼伦贝尔市满洲里远方中学2023-2024学年高二上学期期末考试化学试题广东省肇庆市2023-2024学年高二上学期期末教学质量检测化学试卷甘肃省武威市第一中学2018届高三上学期期末考试化学试题浙江省绍兴市2023-2024学年高一下学期期末教学质量检测化学试题(实验班)
9 . 对于反应4HCl(g)+O2(g) 2Cl2(g)+2H2O(g),下列说法正确的是
2Cl2(g)+2H2O(g),下列说法正确的是
 2Cl2(g)+2H2O(g),下列说法正确的是
2Cl2(g)+2H2O(g),下列说法正确的是| A.上述反应ΔS > 0 |
B.上述反应平衡常数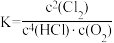 |
C.其他条件相同,增大 ,HCl的转化率升高 ,HCl的转化率升高 |
| D.上述反应中消耗1molO2,转移电子的数目为4×6.02×1023 |
您最近一年使用:0次
名校
10 . 甲酸是一种有机化工原料,广泛用于农药、皮革、医药和橡胶等工业。请回答:
(1)活性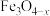 催化反应
催化反应 ,进而可制得甲酸。该反应的△H
,进而可制得甲酸。该反应的△H_______ 0(填“>”或“<”),理由是_______ 。
(2)某温度下,HCOOH电离平衡常数为 ,当HCOOH平衡浓度为x mol/L时,HCOOH已电离的弱电解质分子数的电离度
,当HCOOH平衡浓度为x mol/L时,HCOOH已电离的弱电解质分子数的电离度
_______ (电离度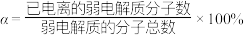 ,用含
,用含 和x的代数式表示,可不化简)。
和x的代数式表示,可不化简)。
(3)某研究小组发现HCOOH水溶液在密封石英管中的分解反应如下:
Ⅰ.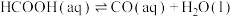

Ⅱ.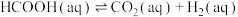

研究发现,在反应Ⅰ、Ⅱ中, 仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。T℃下,在密封石英管内完全充满1.0mol/L HCOOH水溶液,分解产物均完全溶于水中。
仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。T℃下,在密封石英管内完全充满1.0mol/L HCOOH水溶液,分解产物均完全溶于水中。 、CO浓度与反应时间的变化关系如图所示。
、CO浓度与反应时间的变化关系如图所示。_______ 。
A.反应Ⅰ活化能小于反应Ⅱ
B.反应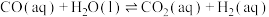
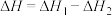
C.混合体系达平衡后: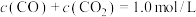
D.若在起始溶液中加入盐酸,则CO达浓度峰值时,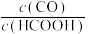 的值与未加盐酸时相同
的值与未加盐酸时相同
②保持其它条件不变,若反应起始时溶液中同时还含有0.10mol/L盐酸,请在上图中画出CO的浓度与应时间的变化关系图_______ 。
(1)活性
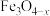 催化反应
催化反应 ,进而可制得甲酸。该反应的△H
,进而可制得甲酸。该反应的△H(2)某温度下,HCOOH电离平衡常数为
 ,当HCOOH平衡浓度为x mol/L时,HCOOH已电离的弱电解质分子数的电离度
,当HCOOH平衡浓度为x mol/L时,HCOOH已电离的弱电解质分子数的电离度
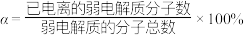 ,用含
,用含 和x的代数式表示,可不化简)。
和x的代数式表示,可不化简)。(3)某研究小组发现HCOOH水溶液在密封石英管中的分解反应如下:
Ⅰ.
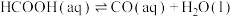

Ⅱ.
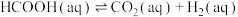

研究发现,在反应Ⅰ、Ⅱ中,
 仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。T℃下,在密封石英管内完全充满1.0mol/L HCOOH水溶液,分解产物均完全溶于水中。
仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。T℃下,在密封石英管内完全充满1.0mol/L HCOOH水溶液,分解产物均完全溶于水中。 、CO浓度与反应时间的变化关系如图所示。
、CO浓度与反应时间的变化关系如图所示。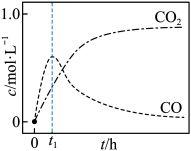
A.反应Ⅰ活化能小于反应Ⅱ
B.反应
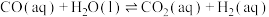
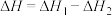
C.混合体系达平衡后:
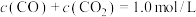
D.若在起始溶液中加入盐酸,则CO达浓度峰值时,
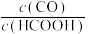 的值与未加盐酸时相同
的值与未加盐酸时相同②保持其它条件不变,若反应起始时溶液中同时还含有0.10mol/L盐酸,请在上图中画出CO的浓度与应时间的变化关系图
您最近一年使用:0次



