22-23高二上·山西·期末
名校
解题方法
1 . Ka、Kw、Kh、Ksp分别表示电离常数、水的离子积常数、水解常数、溶度积常数,下列判断不正确的是
A.室温下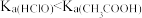 , , 的电离度一定比HClO的大 的电离度一定比HClO的大 |
B.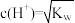 的溶液任何温度下均为中性 的溶液任何温度下均为中性 |
| C.已知25℃时,AgCl和砖红色沉淀Ag2CrO4的Ksp分别为1.8×10-10和2.0×10-12,则用AgNO3标准溶液滴定Cl-时,可采用K2CrO4为指示剂 |
| D.某温度下,一元弱酸HA的Ka越小,则NaA的Kh越大 |
您最近一年使用:0次
2023-12-25更新
|
487次组卷
|
8卷引用:水溶液中的离子反应与平衡——进阶学习
2 . 25 ℃时部分弱酸的电离平衡常数如下表:
(1)在温度相同时,各弱酸的Ka值与酸性的相对强弱的关系为________________ 。
(2)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1 NaHCO3,溶液的pH由大到小的关系为________________ 。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO 、CO
、CO 、HSO
、HSO 、HCO
、HCO 浓度由大到小的顺序为
浓度由大到小的顺序为____________________ 。
(4)下列离子方程式书写正确的是__________ (填字母)。
a.2ClO-+H2O+CO2=2HClO+CO
b.2HCOOH+CO =2HCOO-+H2O+CO2↑
=2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-=2HCOOH+SO
d.Cl2+H2O+2CO =2HCO
=2HCO +Cl-+ClO-
+Cl-+ClO-
(5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为________________________ 。
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡 常数/(mol·L-1) | Ka=1.8×10-4 | Ka=4.7×10-8 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(2)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1 NaHCO3,溶液的pH由大到小的关系为
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO
 、CO
、CO 、HSO
、HSO 、HCO
、HCO 浓度由大到小的顺序为
浓度由大到小的顺序为(4)下列离子方程式书写正确的是
a.2ClO-+H2O+CO2=2HClO+CO

b.2HCOOH+CO
 =2HCOO-+H2O+CO2↑
=2HCOO-+H2O+CO2↑c.H2SO3+2HCOO-=2HCOOH+SO

d.Cl2+H2O+2CO
 =2HCO
=2HCO +Cl-+ClO-
+Cl-+ClO-(5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为
您最近一年使用:0次
3 . 已知在25 ℃时,氨水中NH3·H2O的电离常数Kb=1.8×10-5 mol·L-1,回答下列问题:
(1)氨水中NH3·H2O的电离常数表达式Kb=___________ 。
(2)当向该氨水中加入一定量的NaOH溶液时,Kb值是否会发生变化?___________ (填“会”或“不会”)。
(3)若该氨水的起始浓度为0.01 mol·L-1,则达到电离平衡时溶液中OH-的物质的量浓度为___________ 。
(1)氨水中NH3·H2O的电离常数表达式Kb=
(2)当向该氨水中加入一定量的NaOH溶液时,Kb值是否会发生变化?
(3)若该氨水的起始浓度为0.01 mol·L-1,则达到电离平衡时溶液中OH-的物质的量浓度为
您最近一年使用:0次
4 . 已知Ka(CH3COOH)=1.75×10-5,试计算0.1 mol·L-1 CH3COOH溶液中H+的浓度(写出计算过程) ______ 。
您最近一年使用:0次
5 . 有下列物质的溶液①CH3COOH ②HCl ③H2SO4 ④NaHSO4。
(1)若四种溶液的物质的量浓度相同,其c平(H+)的大小比较为___________ (用序号表示,下同)。
(2)若四种溶液的c平(H+)相同,其物质的量浓度的大小比较为___________ 。
(1)若四种溶液的物质的量浓度相同,其c平(H+)的大小比较为
(2)若四种溶液的c平(H+)相同,其物质的量浓度的大小比较为
您最近一年使用:0次
6 . 按如图Ⅰ所示的装置来测定烧杯中溶液的导电能力的强弱。
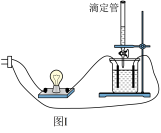
(1)若烧杯中盛放的是Ba(OH)2溶液,当从滴定管中逐渐加入相同物质的量浓度的某种溶液(A)时,溶液的导电性的变化趋势如图Ⅱ所示。
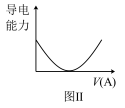
A溶液中含有的溶质可能是___________ (至少写出一种),并写出相应的离子反应的离子方程式: ___________ 。
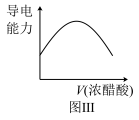
(2)若烧杯中盛放的是浓氨水,当从滴定管中逐渐加入相同浓度的浓醋酸时,溶液的导电性的变化趋势如图Ⅲ所示,则实验中观察的灯泡变化的现象是___________ ,原因是___________ 。
(3)由(1)和(2)两个实验对比可知,溶液导电性的强弱取决于___________ ,在相同温度和浓度的条件下,可溶性的强电解质的导电能力___________ (填“强”或“弱”)于弱电解质的导电能力。

(1)若烧杯中盛放的是Ba(OH)2溶液,当从滴定管中逐渐加入相同物质的量浓度的某种溶液(A)时,溶液的导电性的变化趋势如图Ⅱ所示。

A溶液中含有的溶质可能是
(2)若烧杯中盛放的是浓氨水,当从滴定管中逐渐加入相同浓度的浓醋酸时,溶液的导电性的变化趋势如图Ⅲ所示,则实验中观察的灯泡变化的现象是

(3)由(1)和(2)两个实验对比可知,溶液导电性的强弱取决于
您最近一年使用:0次
解题方法
7 . 下列说法正确的是
| A.强电解质一定是离子化合物,弱电解质一定是共价化合物 |
| B.强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物 |
| C.CO2的水溶液导电能力很弱,所以CO2是弱电解质 |
| D.属于共价化合物的电解质在熔化状态下一般不导电 |
您最近一年使用:0次
2023-08-27更新
|
538次组卷
|
2卷引用:作业(十六) 水的电离电解质在水溶液中的存在形态
解题方法
8 . 强弱电解质的本质区别是
| A.导电能力 | B.相对分子质量 |
| C.电离程度 | D.溶解度 |
您最近一年使用:0次
2023-08-27更新
|
365次组卷
|
2卷引用:作业(十六) 水的电离电解质在水溶液中的存在形态
11-12高二上·辽宁沈阳·期中
9 . 高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
由以上表格中数据判断以下说法不正确的是
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6× 10-5mol·L-1 | 6.3× 10-9mol·L-1 | 1.6× 10-9mol·L-1 | 4.2× 10-10mol·L-1 |
| A.在冰醋酸中这四种酸都没有完全电离 |
| B.在冰醋酸中高氯酸是这四种酸中酸性最强的酸 |
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO |
| D.水对这四种酸的强弱没有区分能力,但冰醋酸可以区分这四种酸的强弱 |
您最近一年使用:0次
2023-08-27更新
|
798次组卷
|
52卷引用:2015安徽望江中学同步课时练(人教选修4)3.1弱电解质的电离试卷
(已下线)2015安徽望江中学同步课时练(人教选修4)3.1弱电解质的电离试卷人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第一节 电离平衡 教材帮作业(十八) 弱电解质的电离平衡(已下线)2011-2012学年辽宁省沈阳四校协作体高二上学期期中考试化学试卷(已下线)2012-2013学年江西省赣州市十一县(市)高二上学期期中联考化学试卷(已下线)2014秋湖北省武汉市部分重点中学高二上学期期中联考化学试卷2014-2015湖南省益阳市箴言中学高二1月月考化学试卷2015-2016学年河北省冀州中学高二上第二次月考化学试卷2015-2016学年吉林实验中学高二上学期期中考试化学试卷12015-2016学年吉林实验中学高二上学期期中考试化学试卷22015-2016学年内蒙古赤峰二中高二上第二次月考化学试卷2015-2016学年福建晨曦、冷曦、正曦、岐滨四校高二上联考化学卷2015-2016学年江西省丰城中学高二上学期期中考试化学试卷江西省南康中学2017-2018学年高二上学期第一次月考化学试题湖南省祁阳四中2018届高三第四次月考化学试题(已下线)2018年10月28日 《每日一题》人教选修4--每周一测江西省上高县第二中学2019-2020学年高二上学期第一次月考化学试题河北省承德第一中学2020届高三10月月考化学试题江苏省南京师大苏州实验学校2019-2020学年高二9月月考化学试题(已下线)上海市徐汇区2010届高三上学期期末学习能力诊断化学试题河北省邯郸市大名县第一中学2020-2021学年高二上学期10月月考化学试题(普通版)湖南省临澧县第一中学2020-2021学年高二上学期期中考试化学试题(选考)重庆市凤鸣山中学2020-2021学年高二上学期期中考试化学试题(已下线)第03章 水溶液中的离子反应与平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)湖南省临澧县第一中学2020-2021学年高二下学期阶段性考试(二)化学试题福建省莆田第十五中学2019-2020学年高二下学期期末考试化学试题河北正定中学2020-2021学年高二上学期第一次半月考化学试题吉林省长春外国语学校2021-2022学年高二上学期第一次月考化学试题湖北省黄冈市浠水县实验高级中学2021-2022学年高二上学期九月月考化学试题(已下线)专题3.1 电离平衡(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)3.1.2 电离平衡常数-2021-2022学年高二化学课后培优练(人教版选修4)山东省济南市第一中学2021-2022学年高二上学期期中考试化学试题(已下线)必考点05 电离平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)广东省高州市校际2021-2022学年高二11月联考化学试题陕西省西安市第一中学2021-2022学年高二上学期期中考试化学试题河北省唐山市第十一中学2021-2022学年高二上学期期中考试化学试题安徽省马鞍山市第二中学2021-2022学年高二上学期期中考试化学试题陕西省西安中学2021-2022学年高二上学期期末考试化学试题新疆生产建设兵团第二师八一中学2021-2022学年高二上学期期中考试化学试题河南省濮阳市第一高级中学2021-2022学年高二下学期期中考试化学试题海南省琼海市嘉积第二中学2021-2022学年高二下学期教学质量监测(段考)化学科试题 四川省广安市第二中学校2022-2023学年高二上学期11月期中考试化学试题江苏省宿迁市北大附属宿迁实验学校2022-2023学年高二上学期11月期中化学试题广东番禺中学2022-2023学年高二下学期科开学考试化学试题河北省新乐市第一中学2022-2023学年高二上学期11月期中考试化学试题浙江省浙南名校联盟2023-2024学年高二上学期10月联考化学试题【精品卷】3.1.3电离平衡常数课堂例题-人教版2023-2024学年选择性必修1(已下线)BBWYhjhx1106.pdf(已下线)选择题16-20广东省清远市阳山县南阳中学2023-2024学年高二上学期第二次月考(期中)化学试题湖南省郴州市明星高级中学2023-2024学年高二上学期期中考试化学试题甘肃省白银市会宁县第三中学2023-2024学年高二上学期期中考试化学试题
10 . 完成下列问题。
(1)甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲、乙两瓶氨水中c平(OH-)之比___________ (填“大于”“等于”或“小于”)10,请说明理由:____________________ 。
(2)常温下,将pH=10的NH3·H2O溶液稀释至原体积的10倍。
①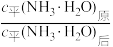
___________ 10(填“>”“<”或“=”,下同)。
②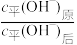
__________ 10。
③pH值范围是___________ 。
(1)甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲、乙两瓶氨水中c平(OH-)之比
(2)常温下,将pH=10的NH3·H2O溶液稀释至原体积的10倍。
①
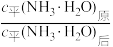
②
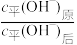
③pH值范围是
您最近一年使用:0次



