解题方法
1 . 一种从废旧锂电池(主要含LiCoO2,及少量Al、Cu)中制备钴酸锂的工艺流程如下:
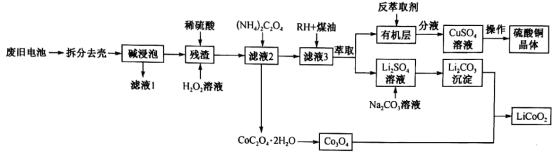
(1)碱浸泡用来除去废旧电池中的_________ ,为提高该物质的去除率可采取的措施有_______ (任写两条)。
(2)向“残渣”中加入稀硫酸和H2O2,放出大量气泡,写出LiCoO2与H2O2反应的化学方程式:_________ 。
(3)设溶液中c(Co2+)=0.1mol⋅L-1,为沉淀Co2+,向“滤液2”中加入 (NH4)2C2O4,而不用Na2C2O4。利用如下数据说明原因:________ 。[已知:25℃时0.1mol/L (NH4)2C2O4溶液pH约为6.4;0.1mol⋅L-1 Na2C2O4溶液pH约为8.35;Ksp[Co(OH)2]=6.0×10−13]
(4)H萃取Cu2+的原理可表示为:Cu2++2HR⇌CuR2+2H+。实验室进行萃取实验用到的两种玻璃仪器是______ 、_____ ;向有机层中加入反萃取剂
________ (填化学式)可将Cu2+反萃取至水层。

(5)已知Li2CO3溶解度随着温度变化曲线如图。加入Na2CO3溶液后应进行的操作是________ 。

(1)碱浸泡用来除去废旧电池中的
(2)向“残渣”中加入稀硫酸和H2O2,放出大量气泡,写出LiCoO2与H2O2反应的化学方程式:
(3)设溶液中c(Co2+)=0.1mol⋅L-1,为沉淀Co2+,向“滤液2”中加入 (NH4)2C2O4,而不用Na2C2O4。利用如下数据说明原因:
(4)H萃取Cu2+的原理可表示为:Cu2++2HR⇌CuR2+2H+。实验室进行萃取实验用到的两种玻璃仪器是

(5)已知Li2CO3溶解度随着温度变化曲线如图。加入Na2CO3溶液后应进行的操作是
您最近一年使用:0次
2 . 合理利用工厂烟灰,变废为宝,对保护环境具有重要意义.以某钢铁厂烟灰 主要成分为ZnO,并含少量的CuO、
主要成分为ZnO,并含少量的CuO、 、
、 等
等 为原料制备氧化锌的工艺流程如图。
为原料制备氧化锌的工艺流程如图。
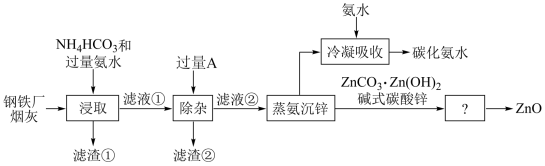
回答下列问题:
(1)“浸取”工序中加入过量氨水的目的:①使ZnO、CuO溶解,转化为 和
和 配离子;②使NH4HCO3部分转化为
配离子;②使NH4HCO3部分转化为 _______ 。
(2)将滤渣①用稀 溶液处理后得到
溶液处理后得到 _______ 溶液和 _______ 固体,检验该溶液中金属阳离子的方法是_______ 。
(3)“除杂”工序加入过量的A是一种金属,其化学式为_______ ,该反应的离子方程式为 _______ 。
(4)滤渣②的主要成分有_______  填化学式
填化学式 ,回收后可用作冶金原料。
,回收后可用作冶金原料。
(5)ZnO与 NH4HCO3和NH3·H2O 的混合物三者在“浸取”反应时离子方程式为_______ 。
(6)“蒸氨沉锌”工序中,“蒸氨”是将氨及其盐从固液混合物中蒸出,蒸出物冷凝吸收后得到的碳化氨水,产物可返回_______ 工序循环使用 。从碱式碳酸锌得到氧化锌的工序为 _______ 。
 主要成分为ZnO,并含少量的CuO、
主要成分为ZnO,并含少量的CuO、 、
、 等
等 为原料制备氧化锌的工艺流程如图。
为原料制备氧化锌的工艺流程如图。
回答下列问题:
(1)“浸取”工序中加入过量氨水的目的:①使ZnO、CuO溶解,转化为
 和
和 配离子;②使NH4HCO3部分转化为
配离子;②使NH4HCO3部分转化为 (2)将滤渣①用稀
 溶液处理后得到
溶液处理后得到 (3)“除杂”工序加入过量的A是一种金属,其化学式为
(4)滤渣②的主要成分有
 填化学式
填化学式 ,回收后可用作冶金原料。
,回收后可用作冶金原料。(5)ZnO与 NH4HCO3和NH3·H2O 的混合物三者在“浸取”反应时离子方程式为
(6)“蒸氨沉锌”工序中,“蒸氨”是将氨及其盐从固液混合物中蒸出,蒸出物冷凝吸收后得到的碳化氨水,产物可返回
您最近一年使用:0次
2021-04-29更新
|
423次组卷
|
2卷引用:湖南省常德市桃源县第一中学2022届高三下学期第三次模拟考试化学试题
名校
解题方法
3 . 以金属切削废料(由铁屑和镍钴合金、金刚砂组成)为原料回收镍钴生产NiSO4·7H2O和CoCl2·6H2O的工艺如图:
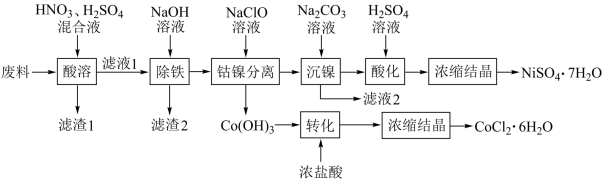
已知:①相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
②常温下,Ksp(NiCO3)=1.0×10-7。
回答下列问题:
(1)将废料研磨成粉的作用是___ 。
(2)理论上“除铁”需控制pH的范围为___ ,“滤渣2”中除Fe(OH)3外,还有少量黄钠铁矾[Na2Fe6(SO4)4(OH)12],写出Fe3+生成黄钠铁矾的离子方程式:___ 。
(3)写出“钴镍分离”时发生反应的离子方程式:___ 。“镍钴分离”后溶液中c(Ni2+)=1.0mol·L-1,若“滤液2”中c(CO )=10-5mol·L-1,则沉镍率=
)=10-5mol·L-1,则沉镍率=___ [沉镍率=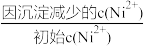 ]。
]。
(4)“转化”时产生的气体为___ 。
(5)碱性镍氢电池是国产比亚迪汽车车载电池之一,其电池反应为:NiOOH+MH Ni(OH)2+M。放电时,负极反应式为
Ni(OH)2+M。放电时,负极反应式为___ 。

已知:①相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Co3+ | Co2+ | Fe3+ | Fe2+ | Ni2+ |
| 开始沉淀的pH | 0.3 | 7.2 | 1.5 | 6.3 | 6.9 |
| 沉淀完全的pH | 1.1 | 9.2 | 2.8 | 8.3 | 8.9 |
回答下列问题:
(1)将废料研磨成粉的作用是
(2)理论上“除铁”需控制pH的范围为
(3)写出“钴镍分离”时发生反应的离子方程式:
 )=10-5mol·L-1,则沉镍率=
)=10-5mol·L-1,则沉镍率=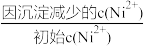 ]。
]。(4)“转化”时产生的气体为
(5)碱性镍氢电池是国产比亚迪汽车车载电池之一,其电池反应为:NiOOH+MH
 Ni(OH)2+M。放电时,负极反应式为
Ni(OH)2+M。放电时,负极反应式为
您最近一年使用:0次
2021-04-07更新
|
515次组卷
|
4卷引用:湖南省常德市2021届高三第一次(3月)模拟考试化学试题
湖南省常德市2021届高三第一次(3月)模拟考试化学试题湖南省永州市第一中学2022届高三第二次月考化学试题(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)福建省莆田一中2021届高三模拟质量检测化学试题
名校
解题方法
4 . 下表是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
| 化学式 |  |  |  |  |  |
 或 或 | 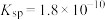 | 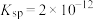 |  |  | 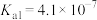  |
A.相同浓度 和 和 的混合液中,各离子浓度的大小关系是 的混合液中,各离子浓度的大小关系是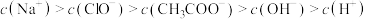 |
B.碳酸钠溶液中滴加少量氯水的离子方程式 |
C.向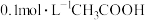 溶液中滴加 溶液中滴加 溶液至 溶液至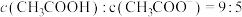 ,此时溶液 ,此时溶液 |
D.向浓度均为 的 的 和 和 混合液中滴加 混合液中滴加 的 的 溶液, 溶液, 先形成沉淀 先形成沉淀 |
您最近一年使用:0次
2021-04-01更新
|
331次组卷
|
9卷引用:湖南省长沙市第一中学2020-2021学年高二下学期开学考化学试题
湖南省长沙市第一中学2020-2021学年高二下学期开学考化学试题2016-2017学年湖北省襄阳五中高二上10月月考化学试卷辽宁省大连市2017届高三3月双基测试化学试题(已下线)考点13 沉淀溶解平衡-2020年高考化学命题预测与模拟试题分类精编内蒙古北京八中乌兰察布分校2019-2020学年高二下学期期末考试化学试题云南省富宁县一中2020-2021学年高二下学期第一次月考化学试题四川省成都市高新区2021届高三第二次阶段质量检测理科综合化学试题(已下线)课时45 难溶电解质的溶解平衡-2022年高考化学一轮复习小题多维练(全国通用)江西省崇义中学2020-2021学年高一上学期期中考试(A卷)化学试题
名校
5 . 2020年6月比亚迪正式发布采用磷酸铁锂技术的刀片电池,大幅度提高了电动汽车的续航里程,可媲美特斯拉。以硫铁矿(主要成分是FeS2,含少量Al2O3、SiO2和Fe3O4)为原料制备LiFePO4的流程如下:
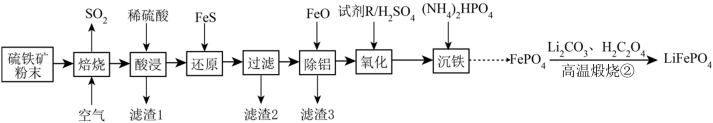
已知几种金属离子沉淀的pH如表所示:
请回答下列问题:
(1)“酸浸”需要适当加热,但温度不宜过高,其原因是___________ 。灼烧滤渣3得到固体的主要成分是___________ (写出化学式)。
(2)用FeS还原Fe3+的目的是___________ ,加入FeO的作用是___________ (用离子反应方程式表示)。
(3)试剂R宜选择___________ (填字母)。
A.高锰酸钾 B.稀硝酸 C.双氧水 D.次氯酸钠
(4)常温下,Ksp(FePO4)=1.3×10-22,“沉铁”中为了使c(Fe3+)≤1×10-5 mol·L-1,c(PO )最小为
)最小为___________ mol·L-1。
(5)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式:___________ 。

已知几种金属离子沉淀的pH如表所示:
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 4.0 |
| 完全沉淀的pH | 4.1 | 9.7 | 5.2 |
(1)“酸浸”需要适当加热,但温度不宜过高,其原因是
(2)用FeS还原Fe3+的目的是
(3)试剂R宜选择
A.高锰酸钾 B.稀硝酸 C.双氧水 D.次氯酸钠
(4)常温下,Ksp(FePO4)=1.3×10-22,“沉铁”中为了使c(Fe3+)≤1×10-5 mol·L-1,c(PO
 )最小为
)最小为(5)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式:
您最近一年使用:0次
2021-03-27更新
|
515次组卷
|
3卷引用:湖南省岳阳市2021届高三二模考试化学试题
解题方法
6 . 锂离子电池是一种非常重要的储能技术,广泛应用于便携电子设备上,将锂离子电池废料进行处理并进行综合利用是十分重要的研究课题,不仅节约资源,还能减少锂离子电池废料对环境的危害。锂离子电池的正极铝钴膜主要含有LiCoO2、Al等,处理该废料并制取Co单质的一种工艺如下图所示:
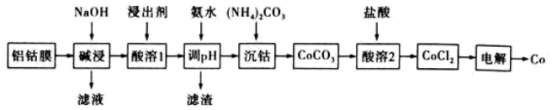
已知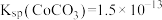 。回答下列问题:
。回答下列问题:
(1)提高“碱浸”速率的措施有_______ (任写一条)。
(2)“酸溶1”时不同的浸出剂,钴的浸出率如下表:
浸出剂①中HCl与浸出剂③的作用均为_______ 。浸出剂①的浸出率最高,而工业上一般不选用浸出剂①,其原因为_______ ,选用浸出剂③时,温度不宜过高,其理由为_______ 。
(3)氨水调节pH后所得滤渣主要为_______ 。
(4)“沉钴”的离子方程式为_______ ,“沉钴”时若溶液中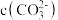 为
为 ,则此时溶液中的
,则此时溶液中的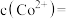
_______ 。
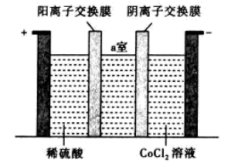
(5)“电解”时装置如图所示,阳极电极反应式为_______ ,电解后a室中的电解质溶液可以返回_______ 环节循环使用。

已知
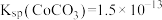 。回答下列问题:
。回答下列问题:(1)提高“碱浸”速率的措施有
(2)“酸溶1”时不同的浸出剂,钴的浸出率如下表:
| 浸出剂 | 钴浸出率% |
| ①HCl | 98.4 |
| ②H2SO4 | 72.3 |
③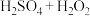 | 98.1 |
浸出剂①中HCl与浸出剂③的作用均为
(3)氨水调节pH后所得滤渣主要为
(4)“沉钴”的离子方程式为
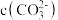 为
为 ,则此时溶液中的
,则此时溶液中的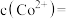
(5)“电解”时装置如图所示,阳极电极反应式为

您最近一年使用:0次
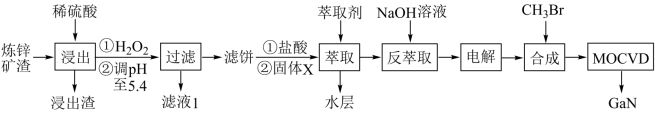
7 . 综合利用炼锌矿渣(主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4)获得3种金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如图。
已知:①常温下,浸出液中各离子的浓度及其开始形成氢氧化物沉淀的pH如表。
②金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)如表。
(1)为提高浸出率,可采用的方法是____ (填一种方法即可),“浸出”时Ga2(Fe2O4)3发生反应的化学方程式为___ 。
(2)加入稀硫酸浸出后将pH调至5.4,目的是____ ;滤液1中主要溶质是____ (写化学式)。
(3)Ga与Al同主族,化学性质相似。反萃取时镓元素发生反应的离子方程式为____ 。
(4)电解过程包括电解反萃取液制粗镓和粗镓精炼两个步骤。精炼时,以粗镓为阳极,以NaOH溶液为电解液,阴极的电极反应为____ 。
(5)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以合成的三甲基镓[Ga(CH3)3]为原料,使其与NH3发生反应得到GaN和另一种气态产物,该过程的化学方程式为____ 。
(6)滤液1中残余的Fe3+的浓度为___ 。

已知:①常温下,浸出液中各离子的浓度及其开始形成氢氧化物沉淀的pH如表。
| 金属离子 | 浓度(mol•L-1) | 开始沉淀pH |
| Fe2+ | 1.0×10-3 | 8.0 |
| Fe3+ | 4.0×10-2 | 1.7 |
| Zn2+ | 1.5 | 5.5 |
| Ga3+ | 3.0×10-3 | 3.0 |
| 金属离子 | 萃取率(%) |
| Fe2+ | 0 |
| Fe3+ | 99 |
| Zn2+ | 0 |
| Ga3+ | 97~98.5 |
(2)加入稀硫酸浸出后将pH调至5.4,目的是
(3)Ga与Al同主族,化学性质相似。反萃取时镓元素发生反应的离子方程式为
(4)电解过程包括电解反萃取液制粗镓和粗镓精炼两个步骤。精炼时,以粗镓为阳极,以NaOH溶液为电解液,阴极的电极反应为
(5)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以合成的三甲基镓[Ga(CH3)3]为原料,使其与NH3发生反应得到GaN和另一种气态产物,该过程的化学方程式为
(6)滤液1中残余的Fe3+的浓度为
您最近一年使用:0次
2021-03-24更新
|
734次组卷
|
2卷引用:2021年湖南省高考化学试卷变式题11-19
名校
解题方法
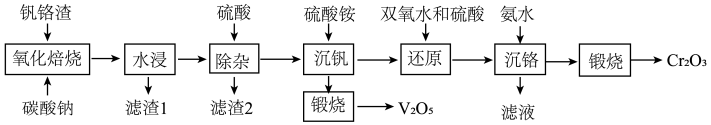
8 . 为解决国家“973计划”中钒、铬资源的利用问题,2013年6月攀钢成立“钒铬渣分离提取钒铬技术研究”课题组,2020年5月课题组公布了提取钒铬的工艺流程:
已知:
①钒铬渣中含有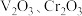 ,及
,及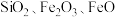 等;
等;
② 时,
时, 的溶度积常数为
的溶度积常数为 ;
;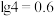 。
。
回答下列问题:
(1)“氧化焙烧”时,钒铬渣中化合价发生变化的元素为铬及______ (用元素名称表示)。
(2)为加快“水浸”速率,可采取的措施为______ (写出一种即可)。
(3)“除杂”产生的滤渣2的成分是______ (用化学式表示)。
(4)写出“煅烧”时反应的化学方程式______ (已知“沉钒”时析出正五价钒的含氧酸铵盐)。
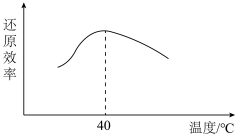
(5)“还原”溶液中的 时发生反应的离子方程式为
时发生反应的离子方程式为______ ,已知双氧水还原 的效率与温度的关系如图,分析
的效率与温度的关系如图,分析 时,双氧水还原效率最高的原因
时,双氧水还原效率最高的原因______ 。
(6)“沉铬”过程中,含铬元素的离子刚好完全沉淀时,溶液的pH=______ (已知溶液中离子浓度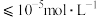 时认为已完全沉淀)。
时认为已完全沉淀)。

已知:
①钒铬渣中含有
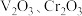 ,及
,及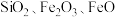 等;
等;②
 时,
时, 的溶度积常数为
的溶度积常数为 ;
; 。
。回答下列问题:
(1)“氧化焙烧”时,钒铬渣中化合价发生变化的元素为铬及
(2)为加快“水浸”速率,可采取的措施为
(3)“除杂”产生的滤渣2的成分是
(4)写出“煅烧”时反应的化学方程式
(5)“还原”溶液中的
 时发生反应的离子方程式为
时发生反应的离子方程式为 的效率与温度的关系如图,分析
的效率与温度的关系如图,分析 时,双氧水还原效率最高的原因
时,双氧水还原效率最高的原因(6)“沉铬”过程中,含铬元素的离子刚好完全沉淀时,溶液的pH=
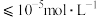 时认为已完全沉淀)。
时认为已完全沉淀)。
您最近一年使用:0次
2021-03-20更新
|
1909次组卷
|
10卷引用:湖南省衡阳市衡阳县第一中学2021-2022学年高三下学期期中考试化学试题
湖南省衡阳市衡阳县第一中学2021-2022学年高三下学期期中考试化学试题广东省肇庆市2021届高三第二次统一测试(二模)化学试题(已下线)押山东卷第16题 化工流程综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)微专题18 金属及其化合物制备流程(V)-备战2022年高考化学考点微专题(已下线)微专题18 金属及其化合物制备流程(Cr)-备战2022年高考化学考点微专题2021年辽宁高考化学试题变式题11-19河北省石家庄市第二中学西校区2021-2022学年高三下学期4月月考化学试题江西省九江第一中学2021-2022学年高二下学期5月月考化学试题(已下线)2022年全国甲卷高考真题变式题(非选择题)甘肃省张掖市2022-2023学年高三上学期第一次诊断考试化学试题
名校
解题方法
9 . 以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe3(SO4)2(OH)6]和纳米镍粉的部分工艺流程如图:
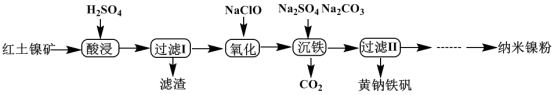
已知:Fe3+在pH约为3.7时可完全转化为Fe(OH)3,Fe2+在pH约为9时可完全转化为Fe(OH)2
下列说法错误的是

已知:Fe3+在pH约为3.7时可完全转化为Fe(OH)3,Fe2+在pH约为9时可完全转化为Fe(OH)2
下列说法错误的是
| A.“滤渣”的主要成分是SiO2 |
| B.为提高镍、铁元素的利用率,可将“过滤I”的滤液和滤渣洗涤液合并 |
| C.“氧化”过程发生的离子方程式为2H++2Fe2++ClO-=2Fe3++Cl-+H2O |
| D.“沉铁”过程中加入碳酸钠的作用是调节溶液的酸碱度,应将pH控制在3.7~9 |
您最近一年使用:0次
2021-03-18更新
|
1185次组卷
|
6卷引用:湖南省郴州市永兴县第一中学2021-2022学年高三下学期期中考试化学试题
湖南省郴州市永兴县第一中学2021-2022学年高三下学期期中考试化学试题湖北省八市2021届高三下学期(3月)联考化学试题(已下线)押山东卷第09题 化工生产流程选择题-备战2021年高考化学临考题号押题(山东卷)(已下线)考向06 钠及其重要化合物-备战2022年高考化学一轮复习考点微专题安徽省蚌埠第三中学2021-2022学年高二下学期开学测试化学试题广西河池市高级中学2021-2022学年高三上学期第二次月考化学试题
10 . PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如图所示。
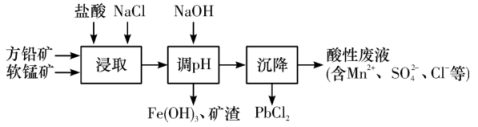
已知:
ⅰ.PbCl2微溶于水
ⅱ.PbCl2(s)+2Cl-(aq) PbCl
PbCl (aq)ΔH>0
(aq)ΔH>0
(1)浸取过程中MnO2与PbS发生反应的离子反应方程式为__ 。
(2)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是__ 。
(3)调pH的目的是__ 。
(4)沉降池中获得PbCl2采取的两种措施是__ 。(根据平衡的观点)
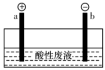
(5)通过电解酸性废液可重新获得MnO2,装置示意图如图,获得MnO2的电极反应式为__ 。

已知:
ⅰ.PbCl2微溶于水
ⅱ.PbCl2(s)+2Cl-(aq)
 PbCl
PbCl (aq)ΔH>0
(aq)ΔH>0(1)浸取过程中MnO2与PbS发生反应的离子反应方程式为
(2)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是
(3)调pH的目的是
(4)沉降池中获得PbCl2采取的两种措施是
(5)通过电解酸性废液可重新获得MnO2,装置示意图如图,获得MnO2的电极反应式为

您最近一年使用:0次



