9-10高三·湖南长沙·阶段练习
1 . 可溶性氯化物中氯含量的测定常采用莫尔法,此法是以K2CrO4为指示剂,用AgNO3标准溶液进行滴定。其实验步骤为:
一、配制0.100mol·L-1AgNO3溶液
准确称取AgNO38.50g,溶于500mL不含氯离子的蒸馏水中,摇匀后,贮存于带玻璃塞的棕色试剂瓶中。
二、0.100mol·L-1AgNO3溶液的标定
准确称取0.585g NaCl于100mL烧杯中,用蒸馏水溶解后,定量转移入100mL容量瓶中,加水稀释至刻度,摇匀。
取所配NaCl溶液25.00mL 3份,分别置于锥形瓶中,加25mL水,1mL 5% K2CrO4溶液,在不断摇动下用AgNO3溶液滴定,至溶液呈砖红色[2Ag++CrO42-=Ag2CrO4↓(砖红色)]。实验测得三次所耗硝酸银溶液体积的平均值为26.32mL。
三、氯化物试样中氯的测定
准确移取25.00mL氯化物试液3份,分别置于锥形瓶中,加入25mL水,1mL 5% K2CrO4溶液,在不断摇动下用AgNO3标准溶液滴定至溶液呈砖红色。实验测得三次所耗硝酸银溶液的体积的平均值为VmL。
回答下列问题:
(1)NaCl固体使用前,要将其置于坩埚中加热,并用_____ 不断搅拌,以除掉氯化钠晶体中的水。
(2)AgNO3溶液需要标定的主要原因是__________________ 。
(3)指示剂CrO42-在溶液中存在下列的平衡:2H++2CrO42- 2HCrO4-
2HCrO4- Cr2O72-+H2O,由此判断该滴定适宜的pH值范围可能是
Cr2O72-+H2O,由此判断该滴定适宜的pH值范围可能是___ 。(填代号)
A.1——6.5 B.6.5——10.5 C.10.5——14
(4)用硝酸银滴定氯离子达到化学计量点时,c(Ag+)=c(Cl-),若此时要求不生成Ag2CrO4沉淀,c(CrO42-)最大不能超过________ mol·L-1,因此,实验中对指示剂的浓度有较高的要求。(已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.8×10-12)
(5)CrO42-的黄色对滴定终点的判断没有影响的原因是_______________ 。
(6)AgNO3标准溶液的准确浓度为_____ mol·L-1,列出计算可溶性氯化物试液中氯元素的含量的式子:____________ g·L-1。
一、配制0.100mol·L-1AgNO3溶液
准确称取AgNO38.50g,溶于500mL不含氯离子的蒸馏水中,摇匀后,贮存于带玻璃塞的棕色试剂瓶中。
二、0.100mol·L-1AgNO3溶液的标定
准确称取0.585g NaCl于100mL烧杯中,用蒸馏水溶解后,定量转移入100mL容量瓶中,加水稀释至刻度,摇匀。
取所配NaCl溶液25.00mL 3份,分别置于锥形瓶中,加25mL水,1mL 5% K2CrO4溶液,在不断摇动下用AgNO3溶液滴定,至溶液呈砖红色[2Ag++CrO42-=Ag2CrO4↓(砖红色)]。实验测得三次所耗硝酸银溶液体积的平均值为26.32mL。
三、氯化物试样中氯的测定
准确移取25.00mL氯化物试液3份,分别置于锥形瓶中,加入25mL水,1mL 5% K2CrO4溶液,在不断摇动下用AgNO3标准溶液滴定至溶液呈砖红色。实验测得三次所耗硝酸银溶液的体积的平均值为VmL。
回答下列问题:
(1)NaCl固体使用前,要将其置于坩埚中加热,并用
(2)AgNO3溶液需要标定的主要原因是
(3)指示剂CrO42-在溶液中存在下列的平衡:2H++2CrO42-
 2HCrO4-
2HCrO4- Cr2O72-+H2O,由此判断该滴定适宜的pH值范围可能是
Cr2O72-+H2O,由此判断该滴定适宜的pH值范围可能是A.1——6.5 B.6.5——10.5 C.10.5——14
(4)用硝酸银滴定氯离子达到化学计量点时,c(Ag+)=c(Cl-),若此时要求不生成Ag2CrO4沉淀,c(CrO42-)最大不能超过
(5)CrO42-的黄色对滴定终点的判断没有影响的原因是
(6)AgNO3标准溶液的准确浓度为
您最近一年使用:0次
2 . 重水(D2O)的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-lgc(D+),以下关于pD的叙述正确的是
| A.重水的pD=7.0 |
| B.含0.01mol NaOD的D2O溶液1L,其pD=12.0 |
| C.溶解0.01molDCl的D2O溶液10L,其pD=2.0 |
| D.在100mL 0.25mol/L的DCl重水溶液中,加入50mL 0.2mol/L NaOD的重水溶液,其pD=1.0 |
您最近一年使用:0次
9-10高三·湖南长沙·阶段练习
解题方法
3 . 根据化学平衡知识,判断下列说法正确的是
| A.已知NaHA溶液呈弱碱性,则该溶液中下列各种微粒浓度大小排列顺序为:c(Na+)>c(HA-)>c(A2-)>c(H2A) |
| B.在小苏打溶液中存在下列关系:c(HCO3-)=c(Na+)-c(CO32-)-c(H2CO3) |
| C.向AgCl悬浊液中加入足量的NaI溶液,无明显现象产生 |
| D.常温下,稀释0.1 mol/L的氨水,溶液中所有离子浓度均下降 |
您最近一年使用:0次
4 . 有关硫化物的几个问题。
(1)H2S在空气中可以燃烧。
已知:① 2H2S(g) + O2(g) 2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol
2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol
②S(s) + O2(g) SO2(g) ΔH= -297.04 kJ/mol
SO2(g) ΔH= -297.04 kJ/mol
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是 。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
① SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32—,其电离方程式是 。
② SO32—可以被海水中的溶解氧氧化为SO42—。海水的pH会 (填“升高” 、“不变”或“降低”)。
③ 为调整海水的pH,可加入新鲜的海水,使其中的HCO3—参与反应,其反应的离子方程式是 。
④ 在上述反应的同时需要大量鼓入空气,其原因是 。
(3)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用化学用语表示由ZnS转变为CuS的过程: 。
(1)H2S在空气中可以燃烧。
已知:① 2H2S(g) + O2(g)
 2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol
2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol②S(s) + O2(g)
 SO2(g) ΔH= -297.04 kJ/mol
SO2(g) ΔH= -297.04 kJ/molH2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是 。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
① SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32—,其电离方程式是 。
② SO32—可以被海水中的溶解氧氧化为SO42—。海水的pH会 (填“升高” 、“不变”或“降低”)。
③ 为调整海水的pH,可加入新鲜的海水,使其中的HCO3—参与反应,其反应的离子方程式是 。
④ 在上述反应的同时需要大量鼓入空气,其原因是 。
(3)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用化学用语表示由ZnS转变为CuS的过程: 。
您最近一年使用:0次
11-12高二上·江西·期中
名校
5 . 硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是
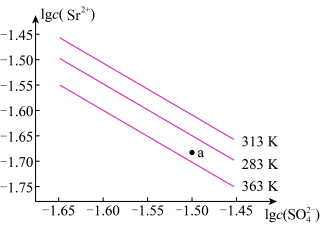

| A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小 |
| B.三个不同温度中,363K时Ksp(SrSO4)最大 |
| C.283K时,图中a点对应的溶液是不饱和溶液 |
| D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液 |
您最近一年使用:0次
2016-12-08更新
|
590次组卷
|
14卷引用:2016届湖南长沙市长郡中学三上学期第四次月考化学试卷
2016届湖南长沙市长郡中学三上学期第四次月考化学试卷(已下线)2011-2012学年江西省白鹭洲中学高二上学期期中考试化学(理)试卷(已下线)2011-2012学年广东省深圳高级中学高二下学期期中化学试卷(已下线)2012-2013学年山东省聊城市某重点中学高二第四次模块检测化学试卷(已下线)2013-2014学年吉林省白山市第一中学高二上学期期末考试化学试卷(已下线)2014秋江西省吉安市白鹭洲中学高二上学期期中化学试卷2016届山东省枣庄八中南校区高三上学期10月阶段测化学试卷2016-2017学年广西柳州铁路一中高二上段考理化学卷黑龙江省齐齐哈尔市第八中学2017-2018学年高二12月月考化学试题(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第5讲 数形结合思想的应用【教学案】广东省深圳市耀华实验学校2018届高三上学期期末考试化学试题云南省会泽县茚旺高级中学2018-2019学年高二上学期12月月考化学试题【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期1月月考化学试题(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
解题方法
6 . 工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)“酸溶”过程中Fe3O4发生反应的离子反应方程式为______________________ ;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有_______________ 、玻璃棒和烧杯等;步骤Ⅳ中应选用_______________ 试剂调节溶液的pH(填字母编号)。
(3)检验步骤Ⅲ已经进行完全的试剂是____________________ ;
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是___________________ ;
(5)步骤Ⅵ中发生反应的化学反应方程式为________________________ ;
(6)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6mol·L-1。试判断所得的FeCO3中是否含有Fe(OH)2___________ (填“是”或“否”),请通过简单计算说明理由。
(已知:Ksp[Fe(OH)2]=4.9×10-17);
(7)欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为____________ 。

试回答下列问题:
(1)“酸溶”过程中Fe3O4发生反应的离子反应方程式为
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有
| A.稀硝酸 | B.氢氧化钠溶液 | C.高锰酸钾溶液 | D.氨水 |
(3)检验步骤Ⅲ已经进行完全的试剂是
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是
(5)步骤Ⅵ中发生反应的化学反应方程式为
(6)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6mol·L-1。试判断所得的FeCO3中是否含有Fe(OH)2
(已知:Ksp[Fe(OH)2]=4.9×10-17);
(7)欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为
您最近一年使用:0次
2016-12-06更新
|
529次组卷
|
4卷引用:2016届湖南省长沙一中高三上学期月考化学试卷
7 . 下列说法正确的是
| A.体积相等pH=12的氨水和NaOH溶液中和盐酸的能力相同 |
| B.室温下,向NH4HSO4溶液中加入NaOH溶液至中性,则c(SO42-)>c(Na+)>c(NH4+) |
| C.物质的量浓度之比为1:2的CH3COOH和CH3COONa的混合溶液中:2[c(CH3COOH)+c(CH3COO-)]=3c(Na+) |
| D.向10mL 0.01mol/L AgNO3溶液中依次滴入2~3滴0.01mol/L NaCl溶液、0.01mol/L NaI溶液,所得沉淀由白色变成黄色,则可推知Ksp(AgI)<Ksp(AgCl) |
您最近一年使用:0次
2016-12-05更新
|
148次组卷
|
3卷引用:2017届湖南长沙市长郡中学高三上第一次周测化学卷
8 . 将氨水滴加到盛有AgCl的试管中直至AgCl完全溶解,对上述过程的有关解释或叙述正确的是
| A.所得溶液中c(Ag+ )· c(Cl-)>Ksp(AgCl) |
| B.上述实验说明Cl-与NH4+间有很强的结合力 |
| C.所得溶液中形成了难电离的物质 |
| D.上述过程中NH3·H2O的电离常数增大 |
您最近一年使用:0次
2016-11-21更新
|
242次组卷
|
6卷引用:湖南省长沙浏阳市2019-2020学年高二上学期期末考试化学试题(高考类)
湖南省长沙浏阳市2019-2020学年高二上学期期末考试化学试题(高考类)2015-2016学年福建省厦门市海沧中学高二下学期期末化学试卷2016-2017学年河北省邢台一中高二上月考二化学卷2018版化学(苏教版)高考总复习专题八课时跟踪训练--难溶电解质的沉淀溶解平衡(已下线)2018年11月18日 《每日一题》人教选修4-每周一测(已下线)专题27 难溶电解质的溶解平衡(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练
2014·江苏南京·二模
名校
9 . H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是


| A.曲线①代表的粒子是HC2O4- |
| B.0.1 mol•L-1NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) |
| C.pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) |
| D.一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变 |
您最近一年使用:0次
2016-06-30更新
|
413次组卷
|
8卷引用:2016届湖南省长沙一中高三上学期月考理综化学试卷
10 . 在t ℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13。下列说法不正确的是( )
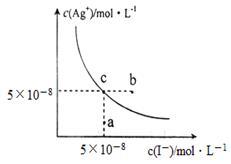

| A.在t℃时,AgI的Ksp=2.5×10-15mol2.L-2 |
| B.图中b点有碘化银晶体析出 |
| C.向c点溶液中加入适量蒸馏水,可使溶液由c点到a点 |
D.在t℃时,反应AgBr(s)+I-(aq) AgI(s)+Br-(aq)的平衡常数K=200 AgI(s)+Br-(aq)的平衡常数K=200 |
您最近一年使用:0次
2016-06-22更新
|
347次组卷
|
5卷引用:湖南广益实验中学2019-2020学年高二上学期期末考试化学试题



