解题方法
1 . 磷酸亚铁锂( )为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池,
)为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池, 废料中(含Al、石墨),其中磷、铁、锂的综合回收工艺流程图如下:
废料中(含Al、石墨),其中磷、铁、锂的综合回收工艺流程图如下: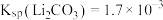
②LiOH、 的溶解度与温度的关系如下表:
的溶解度与温度的关系如下表:
(1)过程I“碱浸”的目的是___________ 。
(2)若浸出液中存在大量 离子,则反应的离子方程式为
离子,则反应的离子方程式为___________ 。
(3)①过程III得到“沉淀Y”的离子方程式为___________ 。
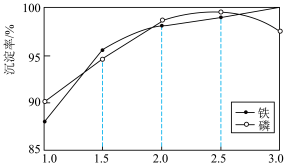
②一定条件下,探究了pH对磷酸铁沉淀的影响,结果如下图所示。由图可知,过程III应选取的最佳沉淀时的pH为___________ 。随pH的增加,磷的沉淀率开始下降,而铁沉淀率未下降,分析原因为___________ 。___________ 。
A.NaOH20-40℃ B.NaOH80-100℃
C. 20-40℃ D.
20-40℃ D. 60-80℃
60-80℃
②常温下,测得滤液1中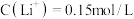 ,某同学取该100ml滤液进行“沉锂”反应。加入50mlX溶液却未见沉淀,若不考虑液体混合时的体积变化,则该同学加入的X溶液最大浓度为
,某同学取该100ml滤液进行“沉锂”反应。加入50mlX溶液却未见沉淀,若不考虑液体混合时的体积变化,则该同学加入的X溶液最大浓度为
___________  。
。
 )为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池,
)为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池, 废料中(含Al、石墨),其中磷、铁、锂的综合回收工艺流程图如下:
废料中(含Al、石墨),其中磷、铁、锂的综合回收工艺流程图如下: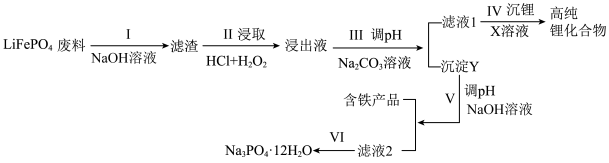
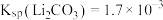
②LiOH、
 的溶解度与温度的关系如下表:
的溶解度与温度的关系如下表:| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | LiOH | 11.9 | 12.4 | 13.2 | 14.6 | 16.6 | 19.1 |
 | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 | |
(1)过程I“碱浸”的目的是
(2)若浸出液中存在大量
 离子,则反应的离子方程式为
离子,则反应的离子方程式为(3)①过程III得到“沉淀Y”的离子方程式为
②一定条件下,探究了pH对磷酸铁沉淀的影响,结果如下图所示。由图可知,过程III应选取的最佳沉淀时的pH为
A.NaOH20-40℃ B.NaOH80-100℃
C.
 20-40℃ D.
20-40℃ D. 60-80℃
60-80℃②常温下,测得滤液1中
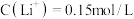 ,某同学取该100ml滤液进行“沉锂”反应。加入50mlX溶液却未见沉淀,若不考虑液体混合时的体积变化,则该同学加入的X溶液最大浓度为
,某同学取该100ml滤液进行“沉锂”反应。加入50mlX溶液却未见沉淀,若不考虑液体混合时的体积变化,则该同学加入的X溶液最大浓度为
 。
。
您最近一年使用:0次
2023-12-05更新
|
361次组卷
|
3卷引用:湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题
湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题山西运城新康国际中学2023-2024学年高三上学期一轮复习检测化学试卷(已下线)大题01 化工流程综合题(逐空突破)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
名校
2 . 某工厂废液经简易处理后的沉淀泥浆中含有大量废铜丝和少量V、Ti、Fe、Si元素氯化物及复杂化合物,一种以该沉淀泥浆为原料回收铜与钒的工艺流程如图所示

已知:常温下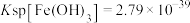 ,
,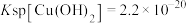 ,溶液中的离子浓度在
,溶液中的离子浓度在 时可以认为已经除尽。下列说法错误的是
时可以认为已经除尽。下列说法错误的是

已知:常温下
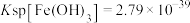 ,
,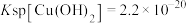 ,溶液中的离子浓度在
,溶液中的离子浓度在 时可以认为已经除尽。下列说法错误的是
时可以认为已经除尽。下列说法错误的是| A.泥浆在空气中堆放后由灰色变为疏松的绿色粉状,是因为铜被氧化,便于后续酸浸时铜进入溶液 |
B.流程中利用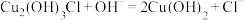 除氯,可以减少酸浸时含氯化合物的挥发 除氯,可以减少酸浸时含氯化合物的挥发 |
C.若浸出液中 的浓度为 的浓度为 ,则酸浸时可调pH=5 ,则酸浸时可调pH=5 |
D.焙烧加入 的目的是使V元素转化成可溶性的钒酸盐 的目的是使V元素转化成可溶性的钒酸盐 |
您最近一年使用:0次
2023-08-30更新
|
669次组卷
|
3卷引用:湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题
名校
解题方法
3 . 下列实验能达到预期目的是
A.向含有酚酞的 溶液中加入少量 溶液中加入少量 固体,溶液红色变浅,证明 固体,溶液红色变浅,证明 溶液中存在水解平衡 溶液中存在水解平衡 |
B.室温下,用pH试纸测定浓度为0.1mol/LNaClO溶液和 溶液的pH,比较HClO和 溶液的pH,比较HClO和 的酸性强弱 的酸性强弱 |
C.等体积 的HX和HY两种酸分别与足量的锌粒反应,排水法收集气体,HX反应结束后放出的氢气多且反应过程中反应速率快,证明HX酸性比HY强 的HX和HY两种酸分别与足量的锌粒反应,排水法收集气体,HX反应结束后放出的氢气多且反应过程中反应速率快,证明HX酸性比HY强 |
D.向10mL0.2mol/LNaOH溶液中滴加2滴 溶液,产生白色沉淀后,再滴加2滴 溶液,产生白色沉淀后,再滴加2滴 溶液,又生成红褐色沉淀,证明在相同温度下Ksp: 溶液,又生成红褐色沉淀,证明在相同温度下Ksp: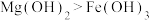 |
您最近一年使用:0次
2023-06-21更新
|
131次组卷
|
16卷引用:湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题
湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题山西省长治市第二中学2019-2020学年高二上学期第一次月考化学试题鲁科版(2019)选择性必修1 模块综合测评人教版(2019)高二选择性必修第一册 模块综合测评广东省梅州市2021-2022学年高二上学期期末考试化学试题河南省南乐县第一高级中学2021-2022学年高二下学期3月月考化学试题江苏省泰州中学2021-2022学年高二下学期期中考试化学试题河南省安阳市第一中学2020-2021学年高二上学期期末考试化学试题湖南省长沙市南雅中学2022-2023学年高二上学期第三次月考化学试题江苏省南通市海安李堡中学2021-2022学年高二上学期期中考试化学试题宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题江苏省徐州市沛县2022-2023学年高二下学期5月月考化学试题广西南宁市2022-2023学年高二下学期开学考试化学试题四川省遂宁市射洪中学校2023-2024学年高二上学期(强基班)11月月考化学试题新疆石河子第一中学2023-2024学年高二上学期12月月考化学试题安徽省合肥市第一中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
4 . 下列实验操作正确且能达到相应实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 混合浓硫酸和浓硝酸 | 先将浓硫酸加入烧杯中,后倒入浓硝酸 |
| B | 检测 产品中是否存在 产品中是否存在 | 取少量产品溶于足量稀盐酸,静置,取上层清液,滴加 溶液 溶液 |
| C | 制备 胶体 胶体 | 将氨水滴加到饱和 溶液中 溶液中 |
| D | 验证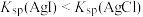 | 向 溶液中先滴入5滴 溶液中先滴入5滴 的 的 溶液,再滴入5滴 溶液,再滴入5滴 的 的 溶液 溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-05-20更新
|
189次组卷
|
2卷引用:湖南省湘西州吉首市2022年基础教育综合实践改革成果展示活动检测高二化学试题
5 . 下列各组离子在指定溶液中能大量共存的是
A.无色透明溶液中: |
B.使甲基橙变红的溶液中: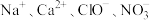 |
C.中性溶液中: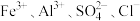 |
D. 溶液中: 溶液中: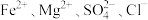 |
您最近一年使用:0次
2022-05-09更新
|
624次组卷
|
3卷引用:湖南省湘西自治州2022届高三下学期4月第三次模拟考试化学试题
湖南省湘西自治州2022届高三下学期4月第三次模拟考试化学试题福建省莆田市2022届高三下学期第三次质量检测化学试题(已下线)微专题07 “五点”破解离子共存-备战2023年高考化学一轮复习考点微专题
6 . 下列实验操作中,对应的现象和结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 用湿润的pH试纸测定NH4Cl溶液的pH | pH=6.5 | NH3是弱电解质 |
| B | 某溶液中先滴加少量氯水,再滴加KSCN溶液 | 溶液变红 | 溶液中含有Fe2+ |
| C | 用洁净的铁丝蘸取少量某物质的溶液进行焰色试验 | 焰色呈黄色 | 该物质中一定含有钠元素 |
| D | 向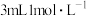 的 的 溶液中滴加5滴 溶液中滴加5滴 溶液,再滴加5滴 溶液,再滴加5滴 的 的 溶液 溶液 | 先产生白色沉淀后又产生红褐色沉淀 | 溶度积常数: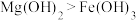 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
7 .  是锂离子电池的活性材料。某小组以含锰矿料(主要成分是
是锂离子电池的活性材料。某小组以含锰矿料(主要成分是 ,含少量
,含少量 、
、 、FeO、CoO和
、FeO、CoO和 )为原料制备
)为原料制备 的流程如图所示(部分条件和产物省略)。
的流程如图所示(部分条件和产物省略)。

已知几种金属氢氧化物沉淀的pH如表所示:
请回答下列问题:
(1)写出一条提高“酸浸”速率的措施:_______ 。
(2)“除杂1”时,加入 的作用是
的作用是_______ (用离子方程式表示)。
(3)“固体1”中除了含有 外,还只含有另外一种固体,其化学式为
外,还只含有另外一种固体,其化学式为_______ ,则“除杂1”过程调节pH范围为_______ 。
(4)在高温下“合成” ,反应的化学方程式为
,反应的化学方程式为_______ 。
(5)已知:常温下,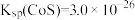 。为了使残液中
。为了使残液中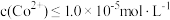 ,必须控制
,必须控制 ≥
≥_______ mol/L。
(6)“浸渣”中含少量锰元素,其测定方法如下:
第1步:称取W g“浸渣”,加酸将锰元素以 形式全部溶出,过滤,将滤液加入250mL容量瓶中,定容;
形式全部溶出,过滤,将滤液加入250mL容量瓶中,定容;
第2步:取25.00mL上述定容后的溶液于锥形瓶中,加入少量催化剂和过量 溶液,加热,充分反应后,煮沸溶液;
溶液,加热,充分反应后,煮沸溶液;
第3步:用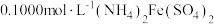 溶液滴定至终点,消耗滴定液V mL,使
溶液滴定至终点,消耗滴定液V mL,使 重新变为
重新变为 。
。
已知: 具有强氧化性,受热易分解。
具有强氧化性,受热易分解。
①“浸渣”中锰元素的质量分数为_______ (用含W、V的代数式表示)。
②如果省略第2步“煮沸溶液”,测得结果将_______ (填“偏高”、“偏低”或“无影响”)。
 是锂离子电池的活性材料。某小组以含锰矿料(主要成分是
是锂离子电池的活性材料。某小组以含锰矿料(主要成分是 ,含少量
,含少量 、
、 、FeO、CoO和
、FeO、CoO和 )为原料制备
)为原料制备 的流程如图所示(部分条件和产物省略)。
的流程如图所示(部分条件和产物省略)。
已知几种金属氢氧化物沉淀的pH如表所示:
| 金属氢氧化物 |  |  |  |  |
| 开始沉淀的pH | 2.7 | 7.6 | 7.6 | 7.7 |
| 完全沉淀的pH | 3.7 | 9.1 | 9.1 | 9.2 |
请回答下列问题:
(1)写出一条提高“酸浸”速率的措施:
(2)“除杂1”时,加入
 的作用是
的作用是(3)“固体1”中除了含有
 外,还只含有另外一种固体,其化学式为
外,还只含有另外一种固体,其化学式为(4)在高温下“合成”
 ,反应的化学方程式为
,反应的化学方程式为(5)已知:常温下,
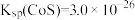 。为了使残液中
。为了使残液中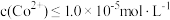 ,必须控制
,必须控制 ≥
≥(6)“浸渣”中含少量锰元素,其测定方法如下:
第1步:称取W g“浸渣”,加酸将锰元素以
 形式全部溶出,过滤,将滤液加入250mL容量瓶中,定容;
形式全部溶出,过滤,将滤液加入250mL容量瓶中,定容;第2步:取25.00mL上述定容后的溶液于锥形瓶中,加入少量催化剂和过量
 溶液,加热,充分反应后,煮沸溶液;
溶液,加热,充分反应后,煮沸溶液;第3步:用
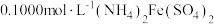 溶液滴定至终点,消耗滴定液V mL,使
溶液滴定至终点,消耗滴定液V mL,使 重新变为
重新变为 。
。已知:
 具有强氧化性,受热易分解。
具有强氧化性,受热易分解。①“浸渣”中锰元素的质量分数为
②如果省略第2步“煮沸溶液”,测得结果将
您最近一年使用:0次
2022-04-18更新
|
350次组卷
|
4卷引用:湖南省湘西自治州2022届高三下学期4月第三次模拟考试化学试题
名校
8 . 三氯氧磷POCl3是一种化工原料,可用于制取有机磷农药、长效磺胺药物等,还可用作染料中间体、有机合成的氯化剂和催化剂、阻燃剂等。利用O2和PCl3为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
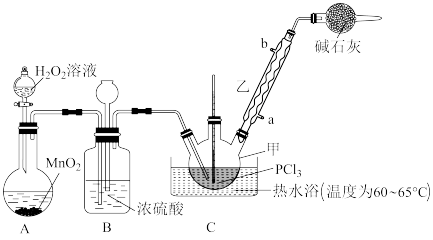
已知 和三氯氧磷的性质如表:
和三氯氧磷的性质如表:
回答下列问题:
(1)装置A中的分液漏斗能否用长颈漏斗代替____ ?做出判断并分析原因:___________ 。
(2)装置B的作用是___________(填标号)。
(3)干燥管中碱石灰的作用___________ 。
(4)写出装置C中发生反应的化学方程式____ 。
(5)通过佛尔哈德法可以测定三氯氧磷产品中Cl素含量,实验步骤如下:
Ⅰ.取ag产品于锥形瓶中,加入足量NaOH溶液待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 的AgNO3溶液40.00 mL,使Cl-完全沉淀。
的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀面被有机物覆盖。
Ⅳ.加入指示剂,用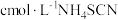 溶液滴过量
溶液滴过量 至终点,记下所用体积为
至终点,记下所用体积为 。
。
已知: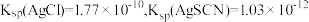
①滴定选用的指示剂是___________ (填标号),滴终点的现象为___________ 。
a. b.
b.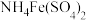 c.淀粉 d.甲基橙
c.淀粉 d.甲基橙
②实验过程中加入硝基苯的目的是___________ ,如无此操作所测Cl元素含量将___________ (填“偏大”“偏小”或“不变”)。
③所测Cl元素含量为___________ 。

已知
 和三氯氧磷的性质如表:
和三氯氧磷的性质如表:| 熔点/℃ | 沸点/℃ | 其他物理或化学性质 | |
| PCl3 | -112.0 | 76.0 | PCl3和POCl3互溶,均为无色液体,遇水均剧烈水解,发生复分解反应生成磷的含氧酸和HCl |
| POCl3 | 1.25 | 106.0 |
(1)装置A中的分液漏斗能否用长颈漏斗代替
(2)装置B的作用是___________(填标号)。
| A.干燥气体 | B.加注浓硫酸 | C.观察气体流出速度 | D.调节气压 |
(4)写出装置C中发生反应的化学方程式
(5)通过佛尔哈德法可以测定三氯氧磷产品中Cl素含量,实验步骤如下:
Ⅰ.取ag产品于锥形瓶中,加入足量NaOH溶液待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000
 的AgNO3溶液40.00 mL,使Cl-完全沉淀。
的AgNO3溶液40.00 mL,使Cl-完全沉淀。Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀面被有机物覆盖。
Ⅳ.加入指示剂,用
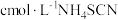 溶液滴过量
溶液滴过量 至终点,记下所用体积为
至终点,记下所用体积为 。
。已知:
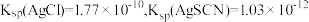
①滴定选用的指示剂是
a.
 b.
b.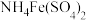 c.淀粉 d.甲基橙
c.淀粉 d.甲基橙②实验过程中加入硝基苯的目的是
③所测Cl元素含量为
您最近一年使用:0次
2022-03-26更新
|
669次组卷
|
3卷引用:湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题
名校
解题方法
9 . 铈可用作优良的环保材料,现以氟碳铈矿(CeFCO3,含Fe2O3、FeO等杂质)为原料制备铈,其工艺流程如图所示:

已知:
①滤渣Ⅰ主要成分是难溶于水的Ce(BF4)3;Ksp[Fe(OH)3]=8×10-38];②Ksp[Ce(OH)3]=1×10-22];③lg2=0.3。
回答下列问题:
(1)粉碎“焙烧”时,氧化数据如表所示:
在对流空气氧化炉中可大大缩短氧化时间的原因是____ 。
(2)用盐酸和H2BO3提取Ce元素时,体现盐酸的性质有____ ,“滤渣Ⅰ”用饱和KCl溶液溶解时发生复分解反应,则“滤渣Ⅱ”主要成分为____ (化学式)。
(3)“滤液Ⅰ”中c(Ce3+)=0.1mol·L-1,用氨水调pH的范围是____ ,“滤液Ⅱ”中加入NH4HCO3反应的离子方程式为____ ,若Ce2(CO3)3经充分焙烧质量减少5.8t,则获得CeO2的质量为____ t。
(4)用过量铝粉还原CeO2即可得Ce,反应的化学方程式为____ ,铝粉必须过量的原因是____ 。

已知:
①滤渣Ⅰ主要成分是难溶于水的Ce(BF4)3;Ksp[Fe(OH)3]=8×10-38];②Ksp[Ce(OH)3]=1×10-22];③lg2=0.3。
回答下列问题:
(1)粉碎“焙烧”时,氧化数据如表所示:
空气氧化法 | 氧化温度/℃ | 氧化率/% | 氧化时间/h |
暴露空气中 | 450~500 | 88 | l4 |
对流空气氧化炉中 | 450~500 | 98 | 6 |
(2)用盐酸和H2BO3提取Ce元素时,体现盐酸的性质有
(3)“滤液Ⅰ”中c(Ce3+)=0.1mol·L-1,用氨水调pH的范围是
(4)用过量铝粉还原CeO2即可得Ce,反应的化学方程式为
您最近一年使用:0次
2022-03-22更新
|
1337次组卷
|
7卷引用:湖南省湘西自治州古丈县第一中学2021-2022学年高三下学期第二次模拟化学试题
湖南省湘西自治州古丈县第一中学2021-2022学年高三下学期第二次模拟化学试题山东省济南市2022届高三3月高考模拟考试(一模)化学试题(已下线)必刷卷02-2022年高考化学考前信息必刷卷(山东专用)(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)北京市八一学校2021-2022学年高三下学期二模前阶段性测试化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(工业流程题)江西省南昌市三校(一中、十中、铁一中)2022-2023学年高三上学期11月期中联考化学试题
名校
解题方法
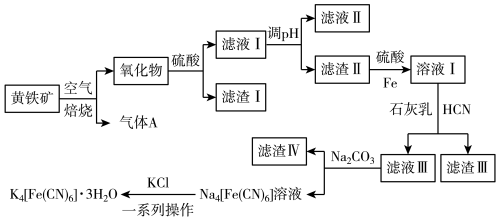
10 . 工业上以黄铁矿(主要成分为FeS2,含有少量NiS、CuS、SiO2等杂质)为原料制备K4[Fe(CN)6]•3H2O,工艺流程如图:
下列说法错误的是

下列说法错误的是
| A.“焙烧”时氧化产物有Fe2O3和SO2 |
| B.“调pH”分离Fe3+与Cu2+、Ni2+是利用了它们氢氧化物Ksp的不同 |
| C.“溶液Ⅰ”中主要反应的离子方程式为6OH-+6HCN+Fe2+=[Fe(CN)6]4-+6H2O |
| D.“一系列操作”为过滤、洗涤、干燥 |
您最近一年使用:0次
2022-03-22更新
|
2179次组卷
|
12卷引用:湖南省湘西自治州古丈县第一中学2021-2022学年高三下学期第二次模拟化学试题
湖南省湘西自治州古丈县第一中学2021-2022学年高三下学期第二次模拟化学试题山东省济南市2022届高三3月高考模拟考试(一模)化学试题湖北省枣阳市第一中学2022届高三下学期5月第三次模拟考试化学试题(已下线)专题13 物质的反应和转化-2022年高考真题模拟题分项汇编(已下线)2022年山东省高考真题变式题(不定项选择题)山东省济南第一中学2023届高三上学期开学考试化学试题湖南省邵阳市第二中学2022-2023学年高三上学期第五次月考化学试题湖南省怀化市会同县第一中学2021-2022学年高三下学期第二次调研考试化学试题湖南省怀化市沅陵县第二中学2021-2022学年高三下学期四月第一次调研考试化学试题(已下线)学科特色7 工艺流程推断(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(不定项选择题)湖南省衡阳市第一中学2023届高三下学期第四次月考化学试题



