解题方法
1 . 下列实验中,对应的现象以及结论都正确的是
| 选项 | 实验 | 现象 | 结论 |
| A | 常温下,往浓硝酸中加入铝片 | 有大量气泡产生 |  具有强氧化性 具有强氧化性 |
| B | 将某有机溶液与新制 浊液混合加热 浊液混合加热 | 有砖红色沉淀生成 | 该有机物中可能不含 |
| C | 往某无色溶液中滴加盐酸酸化的 溶液 溶液 | 有白色沉淀生成 | 原溶液中一定含 |
| D | 往 溶液中滴加5滴 溶液中滴加5滴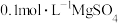 溶液,再滴加5滴 溶液,再滴加5滴 溶液 溶液 | 先有白色沉淀生成,后出现红褐色沉淀 |  的溶度积比 的溶度积比 的小 的小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是


A.图中 和 和 可分别表示 可分别表示 温度下 温度下 饱和溶液中 饱和溶液中 与 与 的浓度 的浓度 |
B.图中各点对应的 的关系为 的关系为 |
C.向 点的溶液中加入少量 点的溶液中加入少量 固体,溶液组成由 固体,溶液组成由 沿 沿 线向 线向 方向移动 方向移动 |
D.温度降低时, 点的饱和溶液的组成由 点的饱和溶液的组成由 沿 沿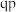 线向 线向 方向移动 方向移动 |
您最近一年使用:0次
3 . 下列事实与水解反应无关 的是
| A.纯碱溶液去除油污的能力强弱:热纯碱液>冷纯碱液 |
B.配制 溶液:将 溶液:将 固体溶于浓盐酸,再稀释至所需浓度 固体溶于浓盐酸,再稀释至所需浓度 |
C.泡沫灭火器的工作原理: 溶液与 溶液与 溶液反应 溶液反应 |
D.除去工业废水中的 :向废水中加入 :向废水中加入 固体 固体 |
您最近一年使用:0次
4 . 下列装置及设计能达到实验目的的是
| 选项 | A | B | C | D |
| 装置 |  | 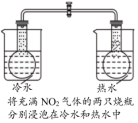 | 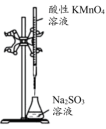 | 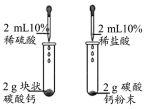 |
| 目的 | 证明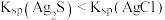 | 探究温度对化学平衡的影响 | 用酸性 溶液滴定 溶液滴定 溶液 溶液 | 探究反应物接触面积对反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 常温下,分别向体积均为10mL、浓度均为0.1mol/L的FeCl2和MnCl2溶液中滴加0.1mol/L的K2S溶液,滴加过程中溶液-1gc(Fe2+)和-1gc(Mn2+)与滴入K2S溶液体积(V)的关系如图所示。[已知:Ksp(MnS)>Ksp(FeS),lg3≈0.5,忽略溶液混合时温度和体积的变化],下列说法正确的是
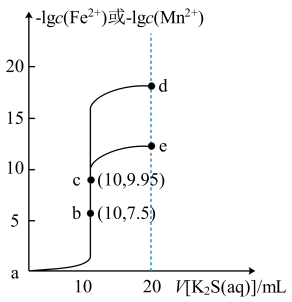

| A.a-b-e为MnCl2溶液的滴定曲线 |
| B.加入过量难溶的FeS可除去FeCl2溶液中混有的Mn2+ |
| C.e点纵坐标约为12.5 |
| D.溶液的pH:c>d>a |
您最近一年使用:0次
2024-01-13更新
|
105次组卷
|
2卷引用:湖南省益阳博雅高级中学2023-2024学年高二上学期期末考试化学试题
解题方法
6 . 二氧化锰是工业上常用的氧化剂、催化剂,以菱锰矿(主要成分 ,还含有
,还含有 、
、 、
、 、
、 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如图:
的工艺流程如图:

已知: 、
、 、
、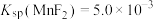
回答下列问题:
(1)酸浸时为了提高浸出效率,除升温外,还可以采取的措施是__________ (任写一种)。
(2)“中和除杂1”是将铁、铝元素转化为沉淀除去,物质X最好选用__________(填标号)。
(3)“除杂2”除去的主要离子是__________ (填离子符号)。
(4)用惰性电极电解 溶液获得
溶液获得 的过程如图所示。
的过程如图所示。

①A为电源__________ 极。
②理论上,当电路中转移10mol电子时,左室产生气体的质量为__________ g。
③右室的电极反应式为__________ 。
(5)电解后的废液中依然存在 ,通常用
,通常用 处理。25℃,向含有
处理。25℃,向含有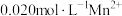 的溶液中通入一定量的
的溶液中通入一定量的 气体,当
气体,当 时,
时, 开始沉淀,此时溶液的pH=
开始沉淀,此时溶液的pH=__________ 。[已知:25℃, 的电离常数
的电离常数 ,
,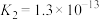 ;
; ]。
]。
 ,还含有
,还含有 、
、 、
、 、
、 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如图:
的工艺流程如图:
已知:
 、
、 、
、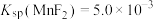
回答下列问题:
(1)酸浸时为了提高浸出效率,除升温外,还可以采取的措施是
(2)“中和除杂1”是将铁、铝元素转化为沉淀除去,物质X最好选用__________(填标号)。
A. | B. | C.NaOH | D. |
(3)“除杂2”除去的主要离子是
(4)用惰性电极电解
 溶液获得
溶液获得 的过程如图所示。
的过程如图所示。
①A为电源
②理论上,当电路中转移10mol电子时,左室产生气体的质量为
③右室的电极反应式为
(5)电解后的废液中依然存在
 ,通常用
,通常用 处理。25℃,向含有
处理。25℃,向含有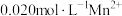 的溶液中通入一定量的
的溶液中通入一定量的 气体,当
气体,当 时,
时, 开始沉淀,此时溶液的pH=
开始沉淀,此时溶液的pH= 的电离常数
的电离常数 ,
,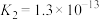 ;
; ]。
]。
您最近一年使用:0次
2024-01-13更新
|
143次组卷
|
2卷引用:湖南省益阳博雅高级中学2023-2024学年高二上学期期末考试化学试题
解题方法
7 . 根据下列实验操作和现象得出的结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向溴水中加入苯,振荡后静置,水层颜色变浅 | 溴与苯发生了加成反应 |
| B | 向FeCl3溶液中滴加KI-淀粉溶液,溶液变蓝 | 氧化性:Fe3+>I2 |
| C | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | X一定具有强氧化性 |
| D | 向2mL1mol/LCuSO4溶液中滴入2滴0.1mol/LNaOH溶液,再滴加2滴0.1mol/LNa2S溶液,先产生蓝色沉淀再产生黑色沉淀 | Ksp[Cu(OH)2] >Ksp(CuS) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 .  广泛用于冶金、化工等行业,主要用于冶炼钒铁。以钒矿石为原料制备
广泛用于冶金、化工等行业,主要用于冶炼钒铁。以钒矿石为原料制备 的工艺如下:
的工艺如下:

已知:
I.“焙烧”后,固体中主要含有 、
、 、
、 、
、 ;“酸浸”后钒以
;“酸浸”后钒以 形式存在,“中和还原”后钒以
形式存在,“中和还原”后钒以 形式存在。
形式存在。
Ⅱ.有机溶剂对四价钒 具有高选择性,且萃取
具有高选择性,且萃取 而不萃取
而不萃取 。
。
Ⅲ.该工艺条件下,溶液中金属离子(浓度均为 )开始沉淀和完全沉淀的
)开始沉淀和完全沉淀的 如下表所示:
如下表所示:
回答下列问题:
(1)基态钒原子的价层电子排布式为_______ 。
(2)“中和还原”时, 参与反应的离子方程式为
参与反应的离子方程式为_______ ,该工序的 低于7.0,试计算出
低于7.0,试计算出
_______ 。
(3)指出 各元素的第一电离能由大到小的顺序
各元素的第一电离能由大到小的顺序_______ , 的空间结构为
的空间结构为_______ 形。
(4)钒的浸出率与焙烧温度、硫酸加入量的关系如图1、2所示。指出适宜的工艺条件为_______ 。

(5)“氧化”时,每消耗 ,可得到
,可得到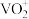
_______  。
。
(6)单质V晶胞属于体心立方晶胞,晶胞参数为 ,两个共顶点的晶胞结构如图3所示,计算出A、B原子的间距为
,两个共顶点的晶胞结构如图3所示,计算出A、B原子的间距为_______ pm。

 广泛用于冶金、化工等行业,主要用于冶炼钒铁。以钒矿石为原料制备
广泛用于冶金、化工等行业,主要用于冶炼钒铁。以钒矿石为原料制备 的工艺如下:
的工艺如下:
已知:
I.“焙烧”后,固体中主要含有
 、
、 、
、 、
、 ;“酸浸”后钒以
;“酸浸”后钒以 形式存在,“中和还原”后钒以
形式存在,“中和还原”后钒以 形式存在。
形式存在。Ⅱ.有机溶剂对四价钒
 具有高选择性,且萃取
具有高选择性,且萃取 而不萃取
而不萃取 。
。Ⅲ.该工艺条件下,溶液中金属离子(浓度均为
 )开始沉淀和完全沉淀的
)开始沉淀和完全沉淀的 如下表所示:
如下表所示:| 金属离子 |  |  |  |  |
开始沉淀 | 1.9 | 7.0 | 11.9 | 8.1 |
完全沉淀 | 3.2 | 9.0 | 13.9 | 10.1 |
(1)基态钒原子的价层电子排布式为
(2)“中和还原”时,
 参与反应的离子方程式为
参与反应的离子方程式为 低于7.0,试计算出
低于7.0,试计算出
(3)指出
 各元素的第一电离能由大到小的顺序
各元素的第一电离能由大到小的顺序 的空间结构为
的空间结构为(4)钒的浸出率与焙烧温度、硫酸加入量的关系如图1、2所示。指出适宜的工艺条件为

(5)“氧化”时,每消耗
 ,可得到
,可得到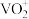
 。
。(6)单质V晶胞属于体心立方晶胞,晶胞参数为
 ,两个共顶点的晶胞结构如图3所示,计算出A、B原子的间距为
,两个共顶点的晶胞结构如图3所示,计算出A、B原子的间距为
您最近一年使用:0次
2023-04-11更新
|
579次组卷
|
3卷引用:湖南省益阳市2023届高三下学期4月教学质量检测化学试题
湖南省益阳市2023届高三下学期4月教学质量检测化学试题(已下线)化学-2023年高考押题预测卷03(云南,安徽,黑龙江,山西,吉林五省通用)(含考试版、全解全析、参考答案、答题卡)甘肃省天水市第一中学 第三中学联考2023-2024学年高三上学期第三次月考 化学试题
9 . 难溶物 可溶于盐酸。常温下,用
可溶于盐酸。常温下,用 调节
调节 浊液的
浊液的 ,测得在不同
,测得在不同 条件下,体系中
条件下,体系中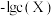 (X为
(X为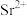 或
或 与
与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

 可溶于盐酸。常温下,用
可溶于盐酸。常温下,用 调节
调节 浊液的
浊液的 ,测得在不同
,测得在不同 条件下,体系中
条件下,体系中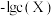 (X为
(X为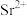 或
或 与
与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A. 代表 代表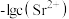 与 与 的变化曲线 的变化曲线 |
B.a、c两点的溶液中均存在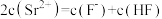 |
C. 的数量级为 的数量级为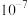 |
D.c点的溶液中存在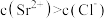 |
您最近一年使用:0次
2023-04-11更新
|
953次组卷
|
6卷引用:湖南省益阳市2023届高三下学期4月教学质量检测化学试题
湖南省益阳市2023届高三下学期4月教学质量检测化学试题新疆乌鲁木齐地区2022届高三第三次质量监测理科综合化学试题(已下线)化学-2023年高考押题预测卷01(辽宁卷)(含考试版、全解全析、参考答案、答题卡)天津市耀华中学2023届高三第一次模拟考试化学试题江西省赣州市2022-2023学年高二下学期期末考试化学试题(已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
解题方法
10 . 某软锰矿含锰为50%,是重要的锰矿石。其主要成分如表:
某科研团队设计制备高纯度MnCO3。反应原理为①MnO2+BaS+H2O=MnO+Ba(OH)2+S;②MnO+H2SO4=MnSO4+H2O;③硫酸锰+碳酸氢铵+一水合氨→MnCO3↓(白色)。工艺流程图如图。

回答下列问题:
(1)软锰矿与硫化钡反应时,适当提高反应液温度的目的是_____ 。
(2)“不溶物”中除SiO2外,还有_____ (“填化学式”)。
(3)工序2中加入H2O2的目的是_____ ,使用氨水调溶液的pH,理论上pH最小值为_____ 。(通常认为溶液中离子浓度小于10-5mol•L-1为沉淀完全;Ksp[Fe(OH)3]=10-38.6、Ksp[Fe(OH)2]=10-16.3、Ksp[Al(OH)3]=10-32.3、Ksp[Mn(OH)2]=10-12.7)
(4)MnF2难溶于水,工序3加入MnF2的目的是除去Mg2+,其反应的离子反应方程式为_____ 。
(5)碳化过程中发生反应的化学方程式为______ 。
(6)由镍、锰、镓制备的磁性形状记忆型合金中,基态Mn原子的价电子的轨道表示式为_____ 。晶胞结构如图,晶胞参数为anm,则该晶体的密度为______ g•cm-3(NA表示阿伏加德罗常数)。

| 软锰矿主要成分 | 杂质 |
| MnO2 | MgO、FeO、Fe2O3、Al2O3、SiO2等杂质 |

回答下列问题:
(1)软锰矿与硫化钡反应时,适当提高反应液温度的目的是
(2)“不溶物”中除SiO2外,还有
(3)工序2中加入H2O2的目的是
(4)MnF2难溶于水,工序3加入MnF2的目的是除去Mg2+,其反应的离子反应方程式为
(5)碳化过程中发生反应的化学方程式为
(6)由镍、锰、镓制备的磁性形状记忆型合金中,基态Mn原子的价电子的轨道表示式为

您最近一年使用:0次
2023-03-15更新
|
888次组卷
|
3卷引用:湖南省益阳市安化县第二中学2023届高三三模化学试题



