1 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.标准状况下 中含有的 中含有的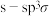 键数为 键数为 |
B. 葡萄糖 葡萄糖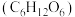 含羟基 含羟基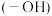 数目为 数目为 |
C.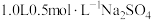 水溶液中含有的氧原子数为 水溶液中含有的氧原子数为 |
D.25℃时, ,则 ,则 饱和溶液中 饱和溶液中 数目为 数目为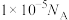 |
您最近一年使用:0次
名校
解题方法
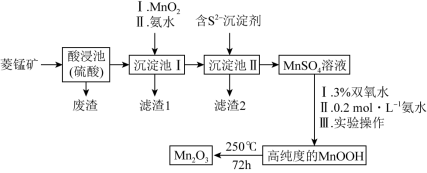
2 . Mn2O3是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有少量Fe3O4、FeO、CoO、Al2O3)为原料制备Mn2O3的工艺流程如图:
已知:氢氧化氧锰(MnOOH)难溶于水和碱性溶液。
(1)MnOOH中Mn的化合价为_______ 价。
(2)向“沉淀池I”中加入MnO2,MnO2的作用是_______ ,在“沉淀池I”中,滴加氨水调节溶液的pH,使溶液中铝、铁元素完全沉淀,则理论上pH的最小值为_______ (当溶液中某离子浓度c≤1.0×10-5mol•L-1时,可认为该离子沉淀完全)。
(3)MnSO4转化为MnOOH的离子方程式为_______ 。
(4)MnSO4转化为MnOOH中“III实验操作”包含过滤、洗涤、干燥,检验MnOOH是否洗涤干净,具体操作为_______ 。
(5)MnS晶胞与NaCl晶胞属于同种类型,MnS晶胞结构如图所示。_______ 。
②已知:MnS晶体的边长为bnm,NA为阿伏加德罗常数的值,则MnS晶胞密度为_______ g•cm-3(列出计算式即可)。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 | 1.09×10-15 |
(1)MnOOH中Mn的化合价为
(2)向“沉淀池I”中加入MnO2,MnO2的作用是
(3)MnSO4转化为MnOOH的离子方程式为
(4)MnSO4转化为MnOOH中“III实验操作”包含过滤、洗涤、干燥,检验MnOOH是否洗涤干净,具体操作为
(5)MnS晶胞与NaCl晶胞属于同种类型,MnS晶胞结构如图所示。
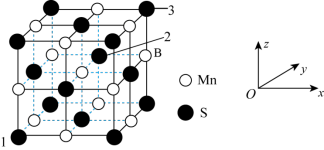
②已知:MnS晶体的边长为bnm,NA为阿伏加德罗常数的值,则MnS晶胞密度为
您最近一年使用:0次
3 . 回答下列问题:
(1)某温度下,向含有AgCl固体的AgCl饱和溶液中加入少量稀盐酸,则AgCl的溶解度______ (填增大,减小或不变,下同),Ksp______ ,c(Ag+)______ 。
(2)现有25℃0.1mol/L的氨水。请回答以下问题:
①若向氨水中加入氯化铵固体,此时溶液中NH3•H2O电离程度_______ (填“增大”、“减小”或“不变”);此时溶液中水的离子积约等于_______ 。
②若向氨水中加入稀硫酸,使其恰好中和,写出离子方程式:______ 所得溶液的pH______ 7(填“>”“=”或“<”),用离子方程式表示其原因:______ 。
(1)某温度下,向含有AgCl固体的AgCl饱和溶液中加入少量稀盐酸,则AgCl的溶解度
(2)现有25℃0.1mol/L的氨水。请回答以下问题:
①若向氨水中加入氯化铵固体,此时溶液中NH3•H2O电离程度
②若向氨水中加入稀硫酸,使其恰好中和,写出离子方程式:
您最近一年使用:0次
4 . 室温下,向Mg(NO3)2溶液、HF溶液、CH3CH2COOH溶液中分别滴加NaOH溶液,测得溶液中pH与pX[pX=-lgX,X代表 、
、 、
、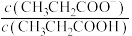 ]的关系如图所示。
]的关系如图所示。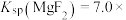
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是
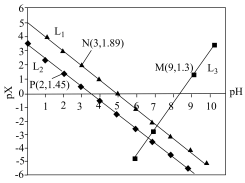
已知:
 、
、 、
、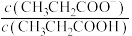 ]的关系如图所示。
]的关系如图所示。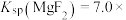
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是已知:

A. 代表的是pH与 代表的是pH与 的关系 的关系 |
B. 的 的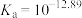 |
C.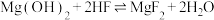 的 的 |
| D.含相同浓度NaF、HF的混合溶液的pH>7 |
您最近一年使用:0次
2024-04-01更新
|
452次组卷
|
5卷引用:湖南省邵阳市第二中学2023-2024学年高二下学期4月期中考试化学试题
解题方法
5 . 高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
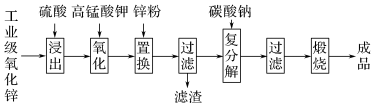
已知Ksp[Fe(OH)3]=8.0×10-38,回答下列问题:
(1)浸出时,为了提高浸出效率可采用的措施有(写一种既可)
(2)浸出步骤中发生主要反应的离子方程式为
(3)氧化时,加入KMnO4溶液是为了除去浸出液中的Fe2+和Mn2+(溶液中Mn全部转化为MnO2),请配平下列除去Fe2+的离子方程式:
□ +□Fe2++□___________=□MnO2↓+□Fe(OH)3↓+□H+
+□Fe2++□___________=□MnO2↓+□Fe(OH)3↓+□H+
(4)加入锌粉的目的是调节溶液pH除去Fe3+,和还原除去溶液中的
(5)已知H2SO4浸出液中,c(Fe2+)=50.4mg·L-1、c(Mn2+)=16.5mg·L-1,若要除尽1m3上述浸出液中的Fe2+和Mn2+,需加入
(6)若用酸性KMnO4标准溶液测定未知溶液中所含Fe2+的物质的量浓度(不含其他还原性粒子,MnO
 转化为Mn2+),不需要选取其他的指示剂,则滴定终点判断依据是
转化为Mn2+),不需要选取其他的指示剂,则滴定终点判断依据是
您最近一年使用:0次
6 . 难溶盐 可溶于盐酸,常温下,用盐酸调节
可溶于盐酸,常温下,用盐酸调节 浊液的pH,测得体系中
浊液的pH,测得体系中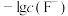 或
或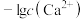 与
与 的关系如图。下列说法错误的是
的关系如图。下列说法错误的是
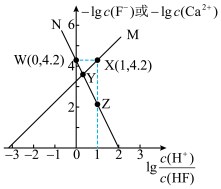
A.随着盐酸的加入,溶液中 和 和 均逐渐增大 均逐渐增大 |
B.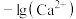 与 与 的关系对应图中曲线M 的关系对应图中曲线M |
C.常温下,难溶盐 的 的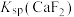 数量级为 数量级为 |
D.Y点的溶液中存在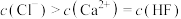 |
您最近一年使用:0次
7 . 由下列实验操作及现象能得出相应结论的是
选项 | 实验操作 | 现象 | 结论 |
A | 向 | 溶液分层,下层呈紫红色 | 氧化性: |
B | 用玻璃棒蘸取待测溶液置于火焰上灼烧 | 火焰呈黄色 | 溶液中含Na元素 |
C | 用pH计测定下列溶液的pH:① | pH:①>② |
|
D | 向浓度均为 | 出现黄色沉淀 |
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
8 . 按如下工艺流程以废旧锌锰干电池的外壳锌皮(含有少量Fe、ZnCl2、MnO2等杂质)为原料制取皓矾(ZnSO4·7H2O)。
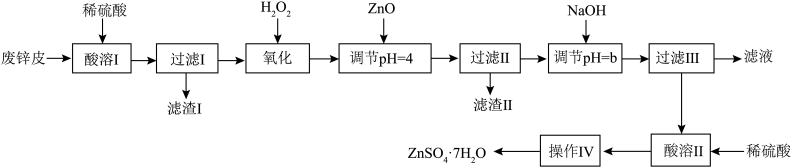
已知:①Ksp[Zn(OH)2]=1.0×10-17,当pH≥12.0时,Zn(OH)2开始转化为 而溶解。
而溶解。
②金属氢氧化物沉淀的pH:
请回答下列问题:
(1)“酸溶I”时,为了提高酸溶速率,可采取的措施有:___________ (任答两点),“滤渣I”的主要成分是___________ 。
(2)“氧化”时,酸性滤液中加入H2O2反应的离子方程式为___________ ,可用NaNO2代替H2O2,但缺点是___________ 。
(3)常温下,加入NaOH调pH=b,b的取值范围是___________ ,若“滤液”的pH=6,则溶液中残留的c(Zn2+)=___________ mol/L。
(4)“操作Ⅳ”的具体操作是___________ ,过滤,洗涤,干燥。

已知:①Ksp[Zn(OH)2]=1.0×10-17,当pH≥12.0时,Zn(OH)2开始转化为
 而溶解。
而溶解。②金属氢氧化物沉淀的pH:
| 氢氧化物 | 开始沉淀的pH | 完全沉淀的pH |
| Zn(OH)2 | 5.7 | 8.0 |
| Fe(OH)3 | 2.7 | 3.7 |
(1)“酸溶I”时,为了提高酸溶速率,可采取的措施有:
(2)“氧化”时,酸性滤液中加入H2O2反应的离子方程式为
(3)常温下,加入NaOH调pH=b,b的取值范围是
(4)“操作Ⅳ”的具体操作是
您最近一年使用:0次
名校
解题方法
9 . 铁、镍及其化合物在工业上有广泛的应用。
Ⅰ.从某矿渣[成分为 (铁酸镍)、
(铁酸镍)、 等]中回收
等]中回收 的工艺流程如下:
的工艺流程如下: 在350℃分解生成
在350℃分解生成 和
和 。回答下列问题:
。回答下列问题:
(1)用95℃热水浸泡的目的是________________ ;
(2)矿渣中部分 焙烧时与
焙烧时与 反应生成
反应生成 的化学方程式是
的化学方程式是________ ;
(3)向“浸取液”中加入 以除去溶液中
以除去溶液中 (浓度为
(浓度为 ),除钙率为
),除钙率为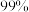 时应控制溶液中
时应控制溶液中 浓度至少是
浓度至少是________  ;
;
(4)从 溶液中获得
溶液中获得 晶体的操作依次是
晶体的操作依次是________ ,过滤,洗涤,干燥;
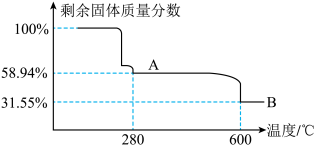
(5)“煅烧”时剩余固体质量分数与温度变化曲线如右图,该曲线中B段所表示的固体物质的化学式是________ ;
(6)基态镍离子 的核外最外层电子排布式是
的核外最外层电子排布式是________ ;
(7) 晶体结构与
晶体结构与 晶体类似,其晶胞的棱长为
晶体类似,其晶胞的棱长为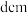 ,则该晶体中距离最近的两个阳离子核间的距离是
,则该晶体中距离最近的两个阳离子核间的距离是________  (用含有
(用含有 的代数式表示)。在一定温度下,
的代数式表示)。在一定温度下, 晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是
晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是________  (已知氧离子的半径为
(已知氧离子的半径为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。
Ⅰ.从某矿渣[成分为
 (铁酸镍)、
(铁酸镍)、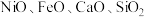 等]中回收
等]中回收 的工艺流程如下:
的工艺流程如下: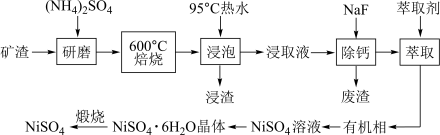
 在350℃分解生成
在350℃分解生成 和
和 。回答下列问题:
。回答下列问题:(1)用95℃热水浸泡的目的是
(2)矿渣中部分
 焙烧时与
焙烧时与 反应生成
反应生成 的化学方程式是
的化学方程式是(3)向“浸取液”中加入
 以除去溶液中
以除去溶液中 (浓度为
(浓度为 ),除钙率为
),除钙率为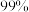 时应控制溶液中
时应控制溶液中 浓度至少是
浓度至少是 ;
;(4)从
 溶液中获得
溶液中获得 晶体的操作依次是
晶体的操作依次是(5)“煅烧”时剩余固体质量分数与温度变化曲线如右图,该曲线中B段所表示的固体物质的化学式是
(6)基态镍离子
 的核外最外层电子排布式是
的核外最外层电子排布式是(7)
 晶体结构与
晶体结构与 晶体类似,其晶胞的棱长为
晶体类似,其晶胞的棱长为 ,则该晶体中距离最近的两个阳离子核间的距离是
,则该晶体中距离最近的两个阳离子核间的距离是 (用含有
(用含有 的代数式表示)。在一定温度下,
的代数式表示)。在一定温度下, 晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是
晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是 (已知氧离子的半径为
(已知氧离子的半径为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
2024-03-22更新
|
346次组卷
|
2卷引用:湖南省邵阳市2024届高三二模化学试题
10 . 五氧化二钒( )为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为
)为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为 ,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备
,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备 的一种流程如图所示:
的一种流程如图所示:
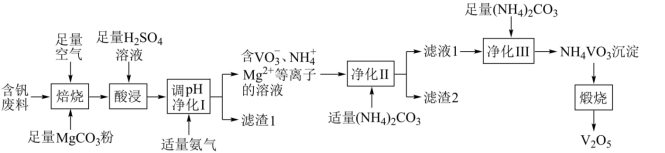
已知:①含钒离子在溶液中的存在形式与溶液pH的关系
②25℃时,难溶电解质的溶度积常数如表所示:
请回答下列问题:
(1)写出基态V原子的价层电子排布式:___________ 。
(2)“焙烧”的目的之一是将 转化成
转化成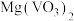 ,请写出转化的化学方程式:
,请写出转化的化学方程式:___________ 。
(3)“酸浸”时,为了提升各物质的浸出速率,除了适当升高温度外,还可以采取的措施是___________ (写一条即可)。
(4)25℃,“调pH净化Ⅰ”时需将 、
、 、
、 三种离子去除干净(浓度
三种离子去除干净(浓度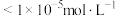 时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为
时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为___________ 。
(5)“净化Ⅱ”的目的是除 、
、 ,若该过程加入过量
,若该过程加入过量 ,可能导致的结果是
,可能导致的结果是___________ 。
(6)“滤液1”中加入 的目的是将
的目的是将 变成沉淀偏钒酸铵(
变成沉淀偏钒酸铵( ),简称“沉钒”。“沉钒”得到的
),简称“沉钒”。“沉钒”得到的 需进行洗涤、干燥,请写出证明
需进行洗涤、干燥,请写出证明 已洗净的实验操作及现象:
已洗净的实验操作及现象:___________ 。
(7)煅烧 得到的产物中,可以在该流程中循环利用的物质是
得到的产物中,可以在该流程中循环利用的物质是___________ 。
(8)为测定该产品的纯度,某同学准确称取 产品1.000g,加入过量稀硫酸使其完全转化成
产品1.000g,加入过量稀硫酸使其完全转化成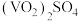 ,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的
,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的 标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中
标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中 被氧化为
被氧化为 ,该产品的纯度为
,该产品的纯度为___________ 。(计算结果保留两位小数)
 )为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为
)为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为 ,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备
,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备 的一种流程如图所示:
的一种流程如图所示:
已知:①含钒离子在溶液中的存在形式与溶液pH的关系
| 溶液pH | <4.0 | 6.0≤pH≤8.0 | >8.0 |
| 钒元素存在形式 |  |  | 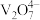 |
| 难溶电解质 |  |  |  |  |  |  |
 | 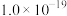 | 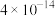 |  |  | 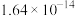 |  |
(1)写出基态V原子的价层电子排布式:
(2)“焙烧”的目的之一是将
 转化成
转化成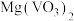 ,请写出转化的化学方程式:
,请写出转化的化学方程式:(3)“酸浸”时,为了提升各物质的浸出速率,除了适当升高温度外,还可以采取的措施是
(4)25℃,“调pH净化Ⅰ”时需将
 、
、 、
、 三种离子去除干净(浓度
三种离子去除干净(浓度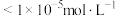 时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为
时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为(5)“净化Ⅱ”的目的是除
 、
、 ,若该过程加入过量
,若该过程加入过量 ,可能导致的结果是
,可能导致的结果是(6)“滤液1”中加入
 的目的是将
的目的是将 变成沉淀偏钒酸铵(
变成沉淀偏钒酸铵( ),简称“沉钒”。“沉钒”得到的
),简称“沉钒”。“沉钒”得到的 需进行洗涤、干燥,请写出证明
需进行洗涤、干燥,请写出证明 已洗净的实验操作及现象:
已洗净的实验操作及现象:(7)煅烧
 得到的产物中,可以在该流程中循环利用的物质是
得到的产物中,可以在该流程中循环利用的物质是(8)为测定该产品的纯度,某同学准确称取
 产品1.000g,加入过量稀硫酸使其完全转化成
产品1.000g,加入过量稀硫酸使其完全转化成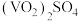 ,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的
,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的 标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中
标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中 被氧化为
被氧化为 ,该产品的纯度为
,该产品的纯度为
您最近一年使用:0次

 、KI混合溶液中依次加入少量氯水和
、KI混合溶液中依次加入少量氯水和 ,振荡,静置
,振荡,静置
 溶液;②
溶液;② 溶液
溶液 酸性弱于
酸性弱于
 的
的 和KI混合溶液中滴加少量
和KI混合溶液中滴加少量 溶液
溶液


