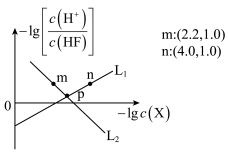
1 . 常温下,用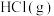 调节
调节 浊液的
浊液的 ,测得在通入
,测得在通入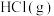 的过程中,体系中
的过程中,体系中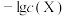 (
( 代表
代表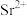 或
或 )与
)与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
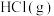 调节
调节 浊液的
浊液的 ,测得在通入
,测得在通入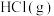 的过程中,体系中
的过程中,体系中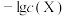 (
( 代表
代表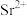 或
或 )与
)与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A.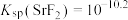 |
B.随着 的加入, 的加入, 溶解度逐渐减小 溶解度逐渐减小 |
C. 点对应的溶液中 点对应的溶液中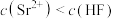 |
D. 、 、 点时的溶液中均存在 点时的溶液中均存在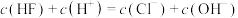 |
您最近一年使用:0次
名校
解题方法
2 . 对于下列实验,能正确描述其反应的离子方程式是
| A.将闪锌矿浸没在足量的蓝矾溶液:ZnS+Cu2+=CuS+Zn2+ |
B.向小苏打溶液中滴加少量苛性钠溶液:HCO +OH-=H2O+CO2↑ +OH-=H2O+CO2↑ |
| C.用醋酸溶液处理水垢中的碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑ |
D.向明矾溶液中加入过量的氨水:Al3++4NH3•H2O=AlO +4NH +4NH +2H2O +2H2O |
您最近一年使用:0次
3 . 纳米氧化锌是一种新型无机功能材料。以氧化锌烟灰(含ZnO及少量Fe2O3、FeO、MnO、CuO)为原料制备纳米氧化锌的工艺流程如图:
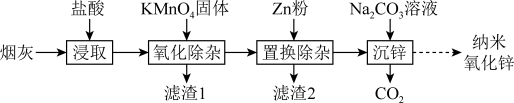
如表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol·L-1计算)。
(1)Cu2+基态核外电子排布式为____ 。
(2)“浸取”过程中盐酸不宜过量太多,其可能原因是____ 。
(3)“滤渣1”的成分是MnO2、Fe(OH)3。“氧化除杂”过程中KMnO4与Mn2+发生反应的离子方程式为____ ,溶液pH范围应控制在____ 。
(4)①“沉锌”得到碱式碳酸锌[化学式为2ZnCO3·3Zn(OH)2·2H2O],该反应的离子方程式为____ 。
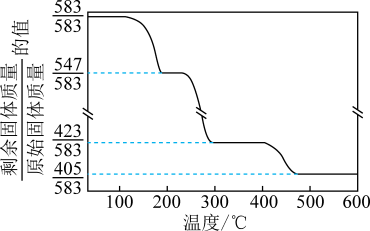
②碱式碳酸锌加热升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体中含有____ (填化学式)。

如表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol·L-1计算)。
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | Zn2+ | Mn2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.0 | 6.2 | 8.1 |
| 完全沉淀的pH | 2.8 | 8.3 | 8.0 | 8.2 | 10.1 |
(1)Cu2+基态核外电子排布式为
(2)“浸取”过程中盐酸不宜过量太多,其可能原因是
(3)“滤渣1”的成分是MnO2、Fe(OH)3。“氧化除杂”过程中KMnO4与Mn2+发生反应的离子方程式为
(4)①“沉锌”得到碱式碳酸锌[化学式为2ZnCO3·3Zn(OH)2·2H2O],该反应的离子方程式为
②碱式碳酸锌加热升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体中含有

您最近一年使用:0次
2022-05-18更新
|
659次组卷
|
2卷引用:湖南省湘潭市第一中学2022届高三下学期第三次模拟考试化学试题
4 . 化学是一门以实验为基础的学科,下列实验操作、现象和结论都正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者大 | 非金属性:S>C |
| B | 将NaCl晶体分散在乙醇中,用激光笔照射 | 出现光亮的通路 | 该分散系为胶体 |
| C | 向硫酸钡沉淀中加入浓碳酸钠充分搅拌后,取沉淀(洗净后)加盐酸 | 有气泡产生 | Ksp(BaCO3)<Ksp(BaSO4) |
| D | 向FeCl2和KSCN的混合溶液中滴入酸化的AgNO3溶液 | 溶液变红 | 氧化性:Ag+>Fe3+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-05-18更新
|
398次组卷
|
4卷引用:湖南省湘潭市湘乡市东山学校2022学年高三下学期期中考试化学试题
5 . 碘在生活中有着广泛应用。一种由含碘废水制取单质碘的工艺流程如下:
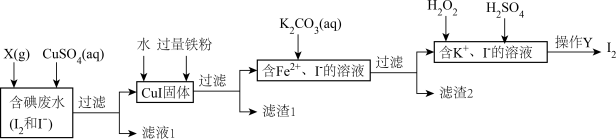
回答下列问题:
(1)检验含碘废水中是否含有I2,常用的试剂是_______ 。
(2)X是一种常见的有刺激性气味的气体,通入X气体的主要目的是将I2还原为I-,反应的离子方程式为_______ 。
(3)分离滤渣1各成分最简便的方法是_______ ;滤渣2在潮湿的空气中能被氧化为红褐色物质,故发生反应的化学方程式为_______ 。
(4)操作Y包括_______ 。
(5)常温下,在得到含K+和I-的溶液时,Fe2+会水解形成胶状物吸附I-,造成I-的损失。若含Fe2+和I-的溶液中c(Fe2+) =0.48 mol·L-1,为减少I-的损失,则必须保持该溶液的pH小于_______ 。(已知常温下Ksp[Fe(OH)2] =4.8×l0-17)

回答下列问题:
(1)检验含碘废水中是否含有I2,常用的试剂是
(2)X是一种常见的有刺激性气味的气体,通入X气体的主要目的是将I2还原为I-,反应的离子方程式为
(3)分离滤渣1各成分最简便的方法是
(4)操作Y包括
(5)常温下,在得到含K+和I-的溶液时,Fe2+会水解形成胶状物吸附I-,造成I-的损失。若含Fe2+和I-的溶液中c(Fe2+) =0.48 mol·L-1,为减少I-的损失,则必须保持该溶液的pH小于
您最近一年使用:0次
名校
6 . 根据下列实验操作和现象所得出的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向硅酸钠溶液中滴加适量的醋酸溶液,溶液变浑浊 | 相同条件下,醋酸的酸性比硅酸的酸性强 |
| B | 向SO2水溶液中滴加Ba( NO3) 2溶液,有白色沉淀产生 | SO2的水溶液中含有一定量的 |
| C | 测定等浓度的Na2CO3溶液和Na2SO3溶液的pH,前者的pH比后者的大 | 元素的非金属性:S>C |
| D | 向5 mL0.1 mol·L-1FeCl3溶液中加入5滴同浓度的KI溶液,再加入几滴 KSCN溶液,溶液显血红色 | FeCl3与KI的反应是可逆反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 实验室以含镍废料(主要成分为NiO,含少量FeO、Fe2O3、CoO、BaO和SiO2)为原料,制备NixOy和CoCO3的工艺流程如图所示。
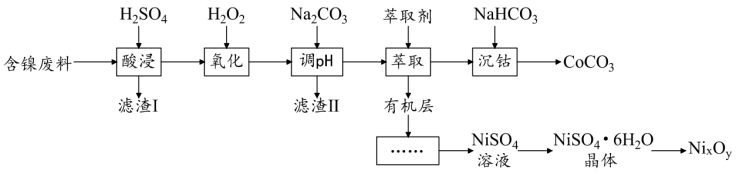
已知:25℃时,Ksp[Co(OH)2]=2.0×10-15.下列说法正确的是

已知:25℃时,Ksp[Co(OH)2]=2.0×10-15.下列说法正确的是
| A.滤渣I中含H2SiO3和BaSO4 |
| B.“氧化”、“调pH”时均需加过量的试剂 |
| C.“萃取”时,待下层液体从分液漏斗下口流出后,上层液体再从下口放出 |
| D.“沉钴”开始时,若溶液中的c(Co2+)=0.02mol·L-1,为防止生成Co(OH)2,应控制溶液pH<7.5 |
您最近一年使用:0次
2022-05-11更新
|
454次组卷
|
2卷引用:湖南省湘潭市湘乡市东山学校2022学年高三下学期期中考试化学试题
名校
8 . 用废铜屑(含Cu、CuO、Fe2O3等)制备胆矾的流程如图:

下列说法不正确的是

下列说法不正确的是
A.“溶解”时,铜发生反应的离子方程式为Cu+4H++O =Cu2++2H2O =Cu2++2H2O |
| B.“调pH"时,可用Cu2(OH)2CO3,代替CuO |
| C.“滤液”中c(Cu2+)·c2(OH-)≤Ksp[Cu(OH)2] |
| D.“酸化”时,加入稀硫酸的目的是抑制Cu2+的水解 |
您最近一年使用:0次
2022-05-07更新
|
524次组卷
|
4卷引用:湖南省湘潭市第一中学2022届高三下学期第三次模拟考试化学试题
湖南省湘潭市第一中学2022届高三下学期第三次模拟考试化学试题江苏省南京市2022届高三下学期第二次(5月)模拟考试化学试题(已下线)专题14 物质的反应和转化-三年(2020-2022)高考真题分项汇编江苏省南京市六校2022-2023学年高二上学期期初联合调研考试化学试题
名校
9 . 工业上用磷铁渣(主要含FeP、Fe2P,以及少量Fe2O3、SiO2等杂质)制备FePO4(磷酸铁)。
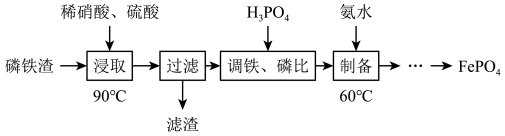
已知:FePO4难溶于水,能溶于无机强酸。
(1)“浸取”时为加速溶解,可以采取的措施有_____ (任写一种):加入硫酸的目的是_____ ;滤渣的主要成分是_____ 。
(2)“浸取”时Fe2P发生反应的离子方程式为______ 。
(3)“制备”过程中溶液的pH对磷酸铁产品中铁和磷的含量及n(Fe)/n(P)比值的影响如图所示[考虑到微量金属杂质,在pH=1时,n(Fe)/n(P)为0.973最接近理论值]。
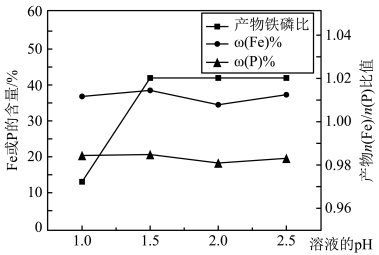
在pH范围为1~1.5时,随pH增大,n(Fe)/n(P)明显增大,其原因是_______ 。
(4)工业上也可以用电解磷铁渣的方法制备FePO4。
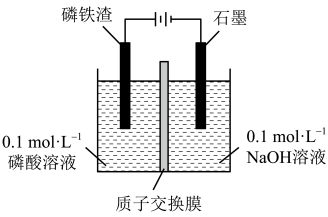
①FeP在阳极放电的电极反应式为_______ 。
②常温电解一段时间,测得溶液中Fe3+浓度约为0.32mol∙L-1,为了避免生成Fe(OH)3沉淀,应控制溶液的pH不大于_______ (已知:Ksp[Fe(OH)3]=4×10-38,lg2=0.3)。

已知:FePO4难溶于水,能溶于无机强酸。
(1)“浸取”时为加速溶解,可以采取的措施有
(2)“浸取”时Fe2P发生反应的离子方程式为
(3)“制备”过程中溶液的pH对磷酸铁产品中铁和磷的含量及n(Fe)/n(P)比值的影响如图所示[考虑到微量金属杂质,在pH=1时,n(Fe)/n(P)为0.973最接近理论值]。

在pH范围为1~1.5时,随pH增大,n(Fe)/n(P)明显增大,其原因是
(4)工业上也可以用电解磷铁渣的方法制备FePO4。

①FeP在阳极放电的电极反应式为
②常温电解一段时间,测得溶液中Fe3+浓度约为0.32mol∙L-1,为了避免生成Fe(OH)3沉淀,应控制溶液的pH不大于
您最近一年使用:0次
2022-04-12更新
|
240次组卷
|
2卷引用:湖南省湘潭市第一中学2022-2023学年高二下学期第一次月考化学试题
10 . NiCl2是一种重要催化剂。某科研小组以废弃催化剂(含Ni2+、Cu2+、Fe3+、Ca2+、Mg2+等)为原料,按如图流程回收NiCl2·6H2O晶体,回答下列问题。
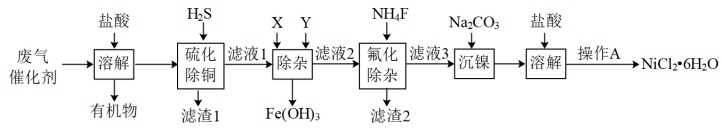
已知:Ksp(CaF2)=4×10-11,Ksp(MgF2)=9×10-9
(1)滤渣1的成分主要是_______ 。
(2)若X为Cl2,则其发生的离子方程式是_______ 。若用H2O2代替Cl2,试剂Y的使用量会减少,原因是_______ 。
(3)氟化除杂时要保证完全除去Ca2+和Mg2+(离子浓度≤10-5mol/L),滤液3中c(F-)不小于_______ mol/L。
(4)实际生产中,产生的滤渣均需进行洗涤,并将洗涤液与滤液合并,此操作的目的是_______ 。操作A为_______ 、冷却结晶、过滤、洗涤。
(5)将所得NiCl2·6H2O与SOCl2混合加热可制备无水 NiCl2并得到两种酸性气体,反应的化学方程式为_______ 。

已知:Ksp(CaF2)=4×10-11,Ksp(MgF2)=9×10-9
(1)滤渣1的成分主要是
(2)若X为Cl2,则其发生的离子方程式是
(3)氟化除杂时要保证完全除去Ca2+和Mg2+(离子浓度≤10-5mol/L),滤液3中c(F-)不小于
(4)实际生产中,产生的滤渣均需进行洗涤,并将洗涤液与滤液合并,此操作的目的是
(5)将所得NiCl2·6H2O与SOCl2混合加热可制备无水 NiCl2并得到两种酸性气体,反应的化学方程式为
您最近一年使用:0次
2022-04-07更新
|
386次组卷
|
5卷引用:湖南省湘潭市第一中学2023届高三上学期第五次月考化学试题
湖南省湘潭市第一中学2023届高三上学期第五次月考化学试题陕西省西安中学2021-2022学年高三下学期第三次模拟考试理科综合化学试题(已下线)秘籍17 工艺流程的条件控制与计算-备战2022年高考化学抢分秘籍(全国通用)(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)四川省泸州市泸县第五中学2022-2023学年高二下学期4月月考化学试题



