1 . 工业生产中利用方铅矿(主要成分为PbS,含有 等杂质)制备
等杂质)制备 晶体的工艺流程如下图:
晶体的工艺流程如下图: [PbCl4]2-(aq);
[PbCl4]2-(aq);
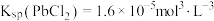 。
。
下列说法错误的是
 等杂质)制备
等杂质)制备 晶体的工艺流程如下图:
晶体的工艺流程如下图: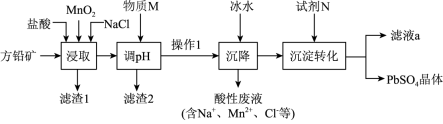
 [PbCl4]2-(aq);
[PbCl4]2-(aq);
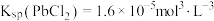 。
。下列说法错误的是
A.由该工艺可知,PbCl2(s)+2Cl-(aq)  [PbCl4]2-(aq)为吸热反应 [PbCl4]2-(aq)为吸热反应 |
| B.滤渣2的主要成分是氢氧化铁 |
C.“沉淀转化”过程达平衡时,溶液中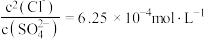 |
D.“浸取”时可发生反应: |
您最近一年使用:0次
2 . 已知:Ksp(AgCl)=1.8×10-10 ,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI>Ag2CrO4 | B.AgCl>Ag2CrO4>AgI |
| C.Ag2CrO4>AgCl>AgI | D.Ag2CrO4>AgI>AgCl |
您最近一年使用:0次
2023-08-14更新
|
1006次组卷
|
54卷引用:2014-2015湖南省怀化市中小学课改高二上学期期末化学试卷
2014-2015湖南省怀化市中小学课改高二上学期期末化学试卷2010年普通高等学校招生全国统一考试化学试题(海南卷)2010年高考化学试题分项专题十 电解质溶液(已下线)2010年北京五中高二下学期期末考试化学试题(已下线)2010—2011学年山西省大同一中高二上学期期末考试化学试卷(已下线)2011-2012学年湖北省襄阳市四校高二上学期期中考试化学试卷(已下线)2011-2012学年江西省九江一中高二上学期第二次月考化学试卷(已下线)2011-2012学年江苏省南京三中高二下学期期末考试化学选修试卷(已下线)2011-2012学年河北省元氏一中高二上学期期中考试化学试卷(已下线)2012-2013学年山东省济宁市泗水一中高二12月质量检测化学试卷(已下线)2012-2013学年福建省南安一中高二上学期期末考试化学试卷(已下线)2013-2014学年湖北省恩施高中高二12月月考化学试卷2014-2015河北省隆化县存瑞中学高二下学期期中考试化学试卷2015-2016学年湖南省衡阳县高二上学期期末统考化学试卷2015-2016学年湖北省武汉三十九中高二上学期期末化学试卷2015-2016学年青海师大附属二中高二下4月月考化学试卷2015-2016学年福建师大附中高二下期中化学试卷2017届湖北省枣阳市高级中学高三上学期8月月考化学试卷2017届内蒙古赤峰二中高三上第二次月考化学试卷广西陆川县中学2017-2018学年高二上学期期中考试化学试题河北省衡水市安平中学2017-2018学年高二上学期期中考试化学试题高中化学人教版 选修四 第三章 水溶液中的离子反应 第四节 难溶电解质的溶解平衡 难溶电解质的溶解平衡内蒙古包头市第四中学2017-2018学年高二上学期期末考试化学试题(已下线)2018年11月15日 《每日一题》人教选修4-溶度积的应用【全国百强校】贵州省铜仁市第一中学2018-2019学年高二下学期开学考试化学试题步步为赢 高二化学暑假作业:作业十 水溶液中的离子平衡陕西省吴起高级中学2019-2020学年高二上学期期中考试化学(基础卷)试题(已下线)2019年11月13日 《每日一题》人教版(选修4)——溶度积的有关计算黑龙江省哈尔滨市第三中学2019-2020学年高二上学期期中考试化学(理)试题陕西省咸阳市西藏民族大学附属中学2019-2020学年高二上学期第二次月考化学试题2019年秋高三化学复习强化练习—— 与浓度积的相关计算(强化练)湖南省雅礼中学2019-2020学年高二上学期第一次月考化学试题吉林省通化市梅河口市博文学校2019-2020学年高二上学期第二次月考化学试题(已下线)山东省邹城市2018-2019学年高二上学期12月月考化学试卷湖北省恩施州清江外国语学校2020-2021学年高二上学期10月月考化学试题河北省石家庄市辛集市第一中学2019-2020学年高二第二次考试(二)化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡湖南省长郡中学2020-2021学年高二上学期期中考试化学试题(已下线)练习14 难溶电解质的沉淀溶解平衡-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)贵州省蟠龙高级中学2020-2021学年高二上学期第二次月考化学试题黑龙江省大庆中学2021-2022学年高二上学期期末考试化学试题(已下线)第33练 沉淀溶解平衡-2023年高考化学一轮复习小题多维练(全国通用)云南省楚雄天人中学2021-2022学年高二上学期12月月考化学试题(B卷)河南省新乡市第一中学2022-2023学年高二上学期第一次月考化学试题湖南省长沙市宁乡市四校联考2022-2023学年高二上学期11月月考化学试题湖北省罗田县第一中学2021-2022学年高二上学期12月月考化学试题山西省太原市英才学校2021-2022学年高二上学期第二次月考化学试题山东省潍坊第一中学2022-2023学年高二上学期期末考试化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)第1课时 沉淀溶解平衡与溶度积作业(二十一) 沉淀溶解平衡与溶度积天津市第一中学2023-2024学年高二上学期期末考试化学试卷山东师大附中幸福柳分校2023-2024学年高二上学期12月份化学学科阶段性测试
3 . 锰酸锂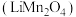 是新一代锂离子电池的正极材料。实验室利用回收的废旧锂离子电池正极材料(锰酸锂、碳粉等涂覆在铝箔上)制取锂的一种流程如图:
是新一代锂离子电池的正极材料。实验室利用回收的废旧锂离子电池正极材料(锰酸锂、碳粉等涂覆在铝箔上)制取锂的一种流程如图:

已知: 在水中的溶解度随着温度的升高而降低。
在水中的溶解度随着温度的升高而降低。
(1)若要增大锂离子电池正极材料的浸取率,可以采取的措施有___________ (写两条)。
(2)滤液 的主要成分是
的主要成分是___________ (填化学式);向滤液A中通入过量二氧化碳的化学方程式为___________ 。
(3)工业上洗涤 用的是热水而不是冷水,其原因是
用的是热水而不是冷水,其原因是___________ 。
(4)写出将 转化成
转化成 的离子方程式
的离子方程式___________ 。
(5)滤液 中
中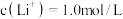 ,向其中再加入等体积的
,向其中再加入等体积的 溶液,生成沉淀。沉淀中
溶液,生成沉淀。沉淀中 元素占原滤液
元素占原滤液 中
中 元素总量的
元素总量的 (忽略混合后溶液的体积变化),则生成的溶液中
(忽略混合后溶液的体积变化),则生成的溶液中 为
为___________ (保留两位有效数字),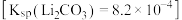 。
。
(6) 的一种配合物化学式为
的一种配合物化学式为 ,则
,则 原子的配位数为
原子的配位数为___________ ;与 互为等电子体的一种阴离子为
互为等电子体的一种阴离子为___________ (填化学式)。
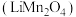 是新一代锂离子电池的正极材料。实验室利用回收的废旧锂离子电池正极材料(锰酸锂、碳粉等涂覆在铝箔上)制取锂的一种流程如图:
是新一代锂离子电池的正极材料。实验室利用回收的废旧锂离子电池正极材料(锰酸锂、碳粉等涂覆在铝箔上)制取锂的一种流程如图:
已知:
 在水中的溶解度随着温度的升高而降低。
在水中的溶解度随着温度的升高而降低。(1)若要增大锂离子电池正极材料的浸取率,可以采取的措施有
(2)滤液
 的主要成分是
的主要成分是(3)工业上洗涤
 用的是热水而不是冷水,其原因是
用的是热水而不是冷水,其原因是(4)写出将
 转化成
转化成 的离子方程式
的离子方程式(5)滤液
 中
中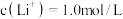 ,向其中再加入等体积的
,向其中再加入等体积的 溶液,生成沉淀。沉淀中
溶液,生成沉淀。沉淀中 元素占原滤液
元素占原滤液 中
中 元素总量的
元素总量的 (忽略混合后溶液的体积变化),则生成的溶液中
(忽略混合后溶液的体积变化),则生成的溶液中 为
为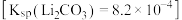 。
。(6)
 的一种配合物化学式为
的一种配合物化学式为 ,则
,则 原子的配位数为
原子的配位数为 互为等电子体的一种阴离子为
互为等电子体的一种阴离子为
您最近一年使用:0次
解题方法
4 . 以菱镁矿(主要成分为 ,含少量
,含少量 、
、 和
和 )为原料制备高纯镁砂的工艺流程如下:
)为原料制备高纯镁砂的工艺流程如下:

已知:①相关金属离子完全沉淀(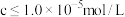 )的pH如下:
)的pH如下:
②废渣的主要成分为: 、
、 和
和
请回答:
(1)A的化学式为___________ 。
(2)为提高“浸出”效率,可采取的措施有___________ (写两条);浸出镁的离子反应方程式为___________ 。
(3) 中的大
中的大 键类型为
键类型为___________ (已知: 中含有的大
中含有的大 键类型为
键类型为 );
); 的核外电子排布式为
的核外电子排布式为___________ 。
(4)该流程中可循环使用的物质为___________ 。
(5)加入氨水的目的是沉镁,该操作不宜在较高温度下进行的原因是___________ 。
(6)若浸出液中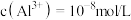 ,则
,则
___________ (已知: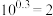 )
)
 ,含少量
,含少量 、
、 和
和 )为原料制备高纯镁砂的工艺流程如下:
)为原料制备高纯镁砂的工艺流程如下:
已知:①相关金属离子完全沉淀(
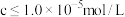 )的pH如下:
)的pH如下:| 金属离子 |  |  |  |
| 沉淀完全的pH | 2.8 | 4.7 | 10.9 |
 、
、 和
和
请回答:
(1)A的化学式为
(2)为提高“浸出”效率,可采取的措施有
(3)
 中的大
中的大 键类型为
键类型为 中含有的大
中含有的大 键类型为
键类型为 );
); 的核外电子排布式为
的核外电子排布式为(4)该流程中可循环使用的物质为
(5)加入氨水的目的是沉镁,该操作不宜在较高温度下进行的原因是
(6)若浸出液中
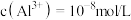 ,则
,则
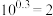 )
)
您最近一年使用:0次
解题方法
5 . 用RSR工艺从废旧铅蓄电池回收铅的化工流程如下:

已知: 是强酸;铅膏的主要成分是
是强酸;铅膏的主要成分是 和
和 ;
;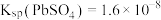 、
、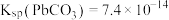 。
。
下列有关说法正确的是

已知:
 是强酸;铅膏的主要成分是
是强酸;铅膏的主要成分是 和
和 ;
;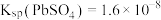 、
、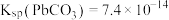 。
。下列有关说法正确的是
A. 的作用是将 的作用是将 氧化为 氧化为 |
B.②中反应的离子方程式为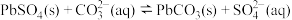 |
C.④中反应的离子方程式为 |
D.⑤中阳极电极反应式为 |
您最近一年使用:0次
6 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。回答下列问题:
(1)已知 在水中存在以下平衡:
在水中存在以下平衡: ,
, ,
, 溶液显
溶液显_______ (填“酸性”、“碱性”、“中性”);等体积等物质的量浓度的 和
和 溶液混合后,所得溶液中离子浓度由大到小顺序是
溶液混合后,所得溶液中离子浓度由大到小顺序是_______ 。
(2) 时,次氯酸的
时,次氯酸的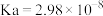 ;亚硫酸的
;亚硫酸的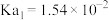 、
、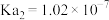 。将少量的
。将少量的 通入
通入 溶液中反应的离子方程式为
溶液中反应的离子方程式为_______ 。
(3)常温下,向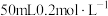 的氨水中逐滴加入
的氨水中逐滴加入 的盐酸,所得溶液的
的盐酸,所得溶液的 、溶液中
、溶液中 和
和 的物质的量分数与加入盐酸的体积的关系如下图所示。
的物质的量分数与加入盐酸的体积的关系如下图所示。

① 的电离常数为
的电离常数为_______ 。
②当加入盐酸的体积为 时,溶液中
时,溶液中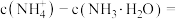
_______  (用计算式表示)。
(用计算式表示)。
(4) 溶液与
溶液与 溶液反应会生成
溶液反应会生成 沉淀。已知:常温下
沉淀。已知:常温下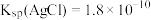 ,
, ,则
,则 转化为
转化为 的平衡常数
的平衡常数
_______ 。
(1)已知
 在水中存在以下平衡:
在水中存在以下平衡: ,
, ,
, 溶液显
溶液显 和
和 溶液混合后,所得溶液中离子浓度由大到小顺序是
溶液混合后,所得溶液中离子浓度由大到小顺序是(2)
 时,次氯酸的
时,次氯酸的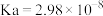 ;亚硫酸的
;亚硫酸的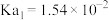 、
、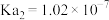 。将少量的
。将少量的 通入
通入 溶液中反应的离子方程式为
溶液中反应的离子方程式为(3)常温下,向
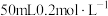 的氨水中逐滴加入
的氨水中逐滴加入 的盐酸,所得溶液的
的盐酸,所得溶液的 、溶液中
、溶液中 和
和 的物质的量分数与加入盐酸的体积的关系如下图所示。
的物质的量分数与加入盐酸的体积的关系如下图所示。
①
 的电离常数为
的电离常数为②当加入盐酸的体积为
 时,溶液中
时,溶液中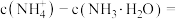
 (用计算式表示)。
(用计算式表示)。(4)
 溶液与
溶液与 溶液反应会生成
溶液反应会生成 沉淀。已知:常温下
沉淀。已知:常温下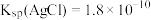 ,
, ,则
,则 转化为
转化为 的平衡常数
的平衡常数
您最近一年使用:0次
7 . 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向某溶液中滴加 溶液,产生蓝色沉淀 溶液,产生蓝色沉淀 | 原溶液中有 ,无 ,无 |
| B | 向浓度均为 的 的 、 、 混合溶液中滴加少量 混合溶液中滴加少量 溶液,有黄色沉淀生成 溶液,有黄色沉淀生成 | 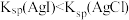 |
| C | 用注射器吸入 由 由 和 和 组成的混合气体,向外拉动注射器活塞至气体体积为原来的2倍,气体颜色变浅 组成的混合气体,向外拉动注射器活塞至气体体积为原来的2倍,气体颜色变浅 | 反应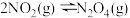 的平衡正向移动 的平衡正向移动 |
| D | 用 试纸测得: 试纸测得: 溶液的 溶液的 约为9, 约为9, 溶液的 溶液的 约为8 约为8 |  电离出 电离出 的能力比 的能力比 的强 的强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 天然水体中的H2CO3与空气中的(CO2保持平衡。已知Ksp(CaCO3)=2.8×10-9,某溶洞水体中lgc(X)(X为H2CO3、 、
、 或Ca2+)与pH的关系如图所示。下列说法正确的是
或Ca2+)与pH的关系如图所示。下列说法正确的是

 、
、 或Ca2+)与pH的关系如图所示。下列说法正确的是
或Ca2+)与pH的关系如图所示。下列说法正确的是
A.曲线①代表 |
| B.H2CO3的一级电离常数为10-8.3 |
| C.c(Ca2+)随pH升高而增大 |
| D.pH=10.3时,c(Ca2+)=2.8×10-7.9mol·L-1 |
您最近一年使用:0次
2022-12-04更新
|
1305次组卷
|
22卷引用:湖南省怀化市通道县第一中学2021-2022学年高三下学期4月月考化学试题
湖南省怀化市通道县第一中学2021-2022学年高三下学期4月月考化学试题辽宁省2021年普通高中学业水平选择考适应性测试化学试题(已下线)难点8 水溶液中的四大平衡常数-2021年高考化学【热点·重点·难点】专练(新高考)四川省射洪市2021届高考考前模拟测试理综化学试题选择性必修1(SJ)专题3专项拓展训练 水溶液中离子平衡图象分析安徽省示范高中培优联盟20212022学年高二上学期冬季联赛化学试题江苏省南京师范大学附属中学2021-2022学年高三下学期开学考试化学试题 江西省抚州市临川第一中学2022届高三下学期4月模拟考试理科综合化学试题第三章水溶液中的离子反应与平衡福建省泉州科技中学2021-2022学年高三上学期期中考试化学试题福建省泉州科技中学2021-2022学年高三上学期期中考试化学试题(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第八章 水溶液中的离子反应与平衡 第54讲 水溶液中四大平衡常数的综合应用(已下线)易错点3不会利用“特殊点”解电解质溶液图像题(已下线)题型141 Ksp的相关计算(已下线)T15-溶液中的离子平衡(已下线)第5讲 难溶电解质的溶解平衡黑龙江省哈尔滨市第一中学校2022-2023学年高三上学期12月月考化学试题辽宁师范大学附属中学2021-2022学年高三上学期阶段测试化学试题重庆市第一中学校2023-2024学年高二上学期第一次月考化学试题(已下线)选择题11-15湖南省邵阳市邵东市创新高级中学2023-2024学年高二上学期创高杯考试化学试题
解题方法
9 . 草酸( ,二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用,常温下,
,二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用,常温下, ∶
∶
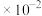 ,
, ;
; :
: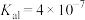 ,
, 。
。
(1)写出草酸在水中的电离方程式_______ 。
(2)在 溶液稀释过程中,下列物理量始终增大的是_______(填字母序号)。
溶液稀释过程中,下列物理量始终增大的是_______(填字母序号)。
(3)常温下,0.18mol/L  溶液中第二步电离出来的
溶液中第二步电离出来的 ,则0.18mol/L
,则0.18mol/L  溶液中
溶液中 电离出来的
电离出来的
_______ a mol/L(填“>”“<”或“=”)。
(4)常温下,向20mL 0.1
 溶液中缓慢滴加pH=13的NaOH溶液,混合溶液的温度与滴加NaOH溶液体积的关系如图一所示:
溶液中缓慢滴加pH=13的NaOH溶液,混合溶液的温度与滴加NaOH溶液体积的关系如图一所示:

①试分析图中E、F、G三点,水的电离程度最大的是_______ 点。
②下列关系式正确的是_______ (填字母序号)。
a.E点存在:
b.F点存在:
c.G点对应的溶液中,
(5)已知25℃草酸钙的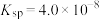 ,碳酸钙的
,碳酸钙的 。25℃时,向20mL碳酸钙的饱和溶液中逐滴加入20mL
。25℃时,向20mL碳酸钙的饱和溶液中逐滴加入20mL  mol/L的草酸钾溶液
mol/L的草酸钾溶液_______ (填“能”或“否”)产生草酸钙沉淀,并说明理由_______ (写出计算过程)。
(6) 辅助的Al-
辅助的Al- 电池工作原理如图二所示。该电池电容量大,能有效利用
电池工作原理如图二所示。该电池电容量大,能有效利用 电池反应产物
电池反应产物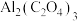 是重要的化工原料。已知:电池正极发生的反应有:
是重要的化工原料。已知:电池正极发生的反应有: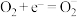 、
、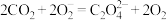 ,反应过程中
,反应过程中 的作用是
的作用是_______ ;电池的总反应式为_______ 。

 ,二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用,常温下,
,二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用,常温下, ∶
∶
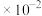 ,
, ;
; :
: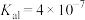 ,
, 。
。(1)写出草酸在水中的电离方程式
(2)在
 溶液稀释过程中,下列物理量始终增大的是_______(填字母序号)。
溶液稀释过程中,下列物理量始终增大的是_______(填字母序号)。A. | B. | C. | D.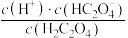 |
 溶液中第二步电离出来的
溶液中第二步电离出来的 ,则0.18mol/L
,则0.18mol/L  溶液中
溶液中 电离出来的
电离出来的
(4)常温下,向20mL 0.1

 溶液中缓慢滴加pH=13的NaOH溶液,混合溶液的温度与滴加NaOH溶液体积的关系如图一所示:
溶液中缓慢滴加pH=13的NaOH溶液,混合溶液的温度与滴加NaOH溶液体积的关系如图一所示:
①试分析图中E、F、G三点,水的电离程度最大的是
②下列关系式正确的是
a.E点存在:

b.F点存在:

c.G点对应的溶液中,

(5)已知25℃草酸钙的
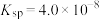 ,碳酸钙的
,碳酸钙的 。25℃时,向20mL碳酸钙的饱和溶液中逐滴加入20mL
。25℃时,向20mL碳酸钙的饱和溶液中逐滴加入20mL  mol/L的草酸钾溶液
mol/L的草酸钾溶液(6)
 辅助的Al-
辅助的Al- 电池工作原理如图二所示。该电池电容量大,能有效利用
电池工作原理如图二所示。该电池电容量大,能有效利用 电池反应产物
电池反应产物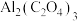 是重要的化工原料。已知:电池正极发生的反应有:
是重要的化工原料。已知:电池正极发生的反应有: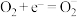 、
、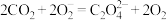 ,反应过程中
,反应过程中 的作用是
的作用是
您最近一年使用:0次
名校
10 . 根据下列实验操作和现象能达到实验目的或推出相应结论的是
| 选项 | 实验操作和现象 | 实验目的或结论 |
| A | 向 溶液中滴加 溶液中滴加 溶液,产生白色沉淀 溶液,产生白色沉淀 |  与 与 发生了相互促进的双水解反应 发生了相互促进的双水解反应 |
| B |  溶液蒸发结晶后得到白色固体 溶液蒸发结晶后得到白色固体 | 该固体成分为 |
| C | 向2mL 0.l  溶液中加入1mL 0.1 溶液中加入1mL 0.1 NaOH溶液,再加入4滴0.1 NaOH溶液,再加入4滴0.1  溶液,白色沉淀转化为红褐色 溶液,白色沉淀转化为红褐色 | 沉淀存在溶解平衡 |
| D | 室温下用pH试纸测0.1mol/L NaClO溶液和0.1mol/L  溶液的pH,比较溶液pH大小 溶液的pH,比较溶液pH大小 | 判断 、HClO酸性强弱 、HClO酸性强弱 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-16更新
|
169次组卷
|
2卷引用:湖南省怀化市2022-2023学年高二上学期期中考试化学试题



