1 . 下列解释事实的方程式不正确的是
A.测得0. Imol/L氨水的pH为11:  |
B.用NaCl溶液做铁的吸氧腐蚀实验,O2减少: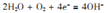 |
C.用H2、O2进行氢氧燃料电池实验,产生电流: |
D.用NH4Cl溶液溶解Mg(OH)2,沉淀溶解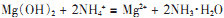 |
您最近一年使用:0次
名校
解题方法
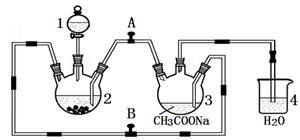
2 . 醋酸亚铬水合物 {[(CH3COO)2Cr]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
Zn(s)+ 2HCl(aq)=ZnCl2(aq)+ H2(g);
2CrCl3(aq)+Zn(s)= 2CrCl2(aq)+ ZnCl2(aq)
2Cr2+(aq)+ 4CH3COO—(aq)+ 2H2O(l)=[(CH3COO)2Cr]2·2H2O(s)
请回答下列问题:
(1)仪器1的名称是______________________________________ 。
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是____________ (填序号);目的是_________________________ 。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门_____ (填“A”或“B",下同),打开阀门____ 。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是_____________________________________________ 。
(5)已知其他反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[(CH3COO)2Cr]2·2H2O 9.4g,则该实验所得产品的产率为____________ (不考虑溶解的醋酸亚铬水合物)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的_______ ,再加入碱液,调节pH至少为_______ 才能是铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。【已知Cr(OH)3的溶度积为6.3×10-31,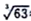 ≈4,lg2≈0.3】
≈4,lg2≈0.3】

Zn(s)+ 2HCl(aq)=ZnCl2(aq)+ H2(g);
2CrCl3(aq)+Zn(s)= 2CrCl2(aq)+ ZnCl2(aq)
2Cr2+(aq)+ 4CH3COO—(aq)+ 2H2O(l)=[(CH3COO)2Cr]2·2H2O(s)
请回答下列问题:
(1)仪器1的名称是
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是
(5)已知其他反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[(CH3COO)2Cr]2·2H2O 9.4g,则该实验所得产品的产率为
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的
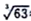 ≈4,lg2≈0.3】
≈4,lg2≈0.3】
您最近一年使用:0次
2018-01-17更新
|
1015次组卷
|
3卷引用:湖南省郴州市2018届高三第二次教学质量监测理科综合化学试题
3 . (1)25℃时,M(OH)2的Ksp=4.0×10-12 ,求饱和溶液中的c(H+)___________ 。
(2)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是_______________________ 。
(3)830 K时,已知可逆反应CO(g)+H2O(g) CO2(g)+H2(g)。若起始时c(CO)=2 mol/L,c(H2O)= 3 mol/L,平衡时CO的转化率为60%,则平衡时K值为
CO2(g)+H2(g)。若起始时c(CO)=2 mol/L,c(H2O)= 3 mol/L,平衡时CO的转化率为60%,则平衡时K值为_____________ 。
(2)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(3)830 K时,已知可逆反应CO(g)+H2O(g)
 CO2(g)+H2(g)。若起始时c(CO)=2 mol/L,c(H2O)= 3 mol/L,平衡时CO的转化率为60%,则平衡时K值为
CO2(g)+H2(g)。若起始时c(CO)=2 mol/L,c(H2O)= 3 mol/L,平衡时CO的转化率为60%,则平衡时K值为
您最近一年使用:0次
名校
解题方法
4 . 298 K时,AgSCN的沉淀溶解平衡曲线如图所示,下列判断错误的是
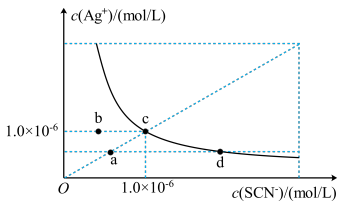

| A.298 K时,Ksp(AgSCN)=1.0×10-12 |
| B.欲使溶液由c点移到d点,可滴入少量KSCN浓溶液 |
| C.向a点溶液中加入等物质的量的AgNO3、KSCN固体后,可能使a点移动到c点 |
| D.b点溶液蒸发部分水后恢复至室温可移动到c点 |
您最近一年使用:0次
2018-01-05更新
|
213次组卷
|
2卷引用:湖南省临武一中、嘉禾一中2017-2018学年高二12月联考化学试题
5 . 化学与生产生活联系紧密,下列有关说法正确的是
| A.只用淀粉溶液即可检验食盐是否为加碘盐 |
| B.氢氟酸刻蚀水晶饰品体现其酸性 |
| C.水垢中的CaSO4,可先转化为CaCO3,再用酸除去 |
| D.煤经过气化和液化等物理变化可转为清洁能源 |
您最近一年使用:0次
名校
解题方法
6 . 乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸,其K1=5.4×10-2,K2=5.4×10-5,已知碳酸的K1=4.4×10-7,K2=4.7×10-11,
草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9,试回答下列问题:
(1)0.1mol/LNa2CO3溶液的pH_________ 0.1mol/LNa2C2O4溶液的pH(选填“大于”、“小于”或“等于”)。
(2)下列化学方程式正确的是_______ (填选项序号)
A. H2C2O4+CO32-=HCO3-+HC2O4- B.HC2O4-+CO32-=HCO3-+C2O42-
C.H2O+CO2+C2O42-=HC2O4-+HCO3- D.C2O42-+CO2+H2O=H2C2O4+CO32-
(3)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(已知杂质不与KMnO4和H2SO4溶液反应)。 实验步骤:准确以1g样品Na2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中。再向瓶中加入足量稀H2SO4溶液,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL.
(已知:5H2C2O4+2KMnO4+3H2SO4===10CO2↑+2MnSO4+K2SO4+8H2O)
①高锰酸钾溶液应装在_________ 滴定管中。(填“酸式”或“碱式”)
②滴定至终点时的实验现象是:__________________________ 。
③计算样品中Na2C2O4的纯度是_______________________ 。
(4)草酸钙结石是五种肾结石里最为常见的一种.患草酸钙结石的病人多饮白开水有利于结石的消融.请用化学用语和简要的文字说明其原因:______ .
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入cmol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为______ .
草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9,试回答下列问题:
(1)0.1mol/LNa2CO3溶液的pH
(2)下列化学方程式正确的是
A. H2C2O4+CO32-=HCO3-+HC2O4- B.HC2O4-+CO32-=HCO3-+C2O42-
C.H2O+CO2+C2O42-=HC2O4-+HCO3- D.C2O42-+CO2+H2O=H2C2O4+CO32-
(3)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(已知杂质不与KMnO4和H2SO4溶液反应)。 实验步骤:准确以1g样品Na2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中。再向瓶中加入足量稀H2SO4溶液,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL.
(已知:5H2C2O4+2KMnO4+3H2SO4===10CO2↑+2MnSO4+K2SO4+8H2O)
①高锰酸钾溶液应装在
②滴定至终点时的实验现象是:
③计算样品中Na2C2O4的纯度是
(4)草酸钙结石是五种肾结石里最为常见的一种.患草酸钙结石的病人多饮白开水有利于结石的消融.请用化学用语和简要的文字说明其原因:
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入cmol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为
您最近一年使用:0次
名校
7 . 已知25℃时,Ksp(AgC1)=1.8×10-10,Ksp(AgBr)=5.0×10-13。该温度下,下列说法错误的是
| A.AgC1的悬浊液中通入少量的HCl,c(Ag+)减少 |
B.AgC1和AgBr共存的悬浊液中, =360 =360 |
| C.AgC1和AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,生成AgBr沉淀多于AgCl沉淀 |
| D.等浓度的NaCl和NaBr混合溶液中滴加AgNO3溶液,先析出AgBr沉淀 |
您最近一年使用:0次
2017-11-14更新
|
604次组卷
|
2卷引用:湖南省嘉禾一中、临武一中2017-2018学年高二上学期期中联考化学试题
8 . 关于溶液的下列说法正确的是
| A.用湿润的pH试纸测稀碱液的pH,测定值偏大 |
| B.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
| C.用pH试纸可测定新制氯水的pH |
| D.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
您最近一年使用:0次
2017-11-14更新
|
294次组卷
|
2卷引用:湖南省嘉禾一中、临武一中2017-2018学年高二上学期期中联考化学试题
名校
9 . 利用化学原理对工厂排放的废水等进行有效检测与合理处理。某工厂处理含+6价铬的污水工艺的流程如下:

(1)请写出N2H4的电子式____________________ 。
(2)下列溶液中,可以代替上述流程中N2H4的是______________ (填选项序号)。
A. FeSO4溶液 B.浓硝酸 C.酸性KMnO4溶液 D. Na2SO3溶液
(3)已知加入N2H4的流程中,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为________________ 。
(4)Cr(OH)3的化学性质与A1(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示为_______________________________ 。
(5)实际工业生产中,有时还可采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子(此时氢离子不参与交换)。常温下,将pH=5的废水经过阳离子交换树脂后,测得溶液中Na+比交换前增加了0.046 g·L-1,则该条件下Cr(OH)3的Ksp的值为___________________________ 。
(6)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。
①已知含铬废水中存在着平衡,Cr2O 和CrO
和CrO 在溶液中可相互转化,请用离子方程式表示它们之间的转化反应
在溶液中可相互转化,请用离子方程式表示它们之间的转化反应____________________________ 。
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为__________________________________ 。

(1)请写出N2H4的电子式
(2)下列溶液中,可以代替上述流程中N2H4的是
A. FeSO4溶液 B.浓硝酸 C.酸性KMnO4溶液 D. Na2SO3溶液
(3)已知加入N2H4的流程中,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为
(4)Cr(OH)3的化学性质与A1(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示为
(5)实际工业生产中,有时还可采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子(此时氢离子不参与交换)。常温下,将pH=5的废水经过阳离子交换树脂后,测得溶液中Na+比交换前增加了0.046 g·L-1,则该条件下Cr(OH)3的Ksp的值为
(6)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。
①已知含铬废水中存在着平衡,Cr2O
 和CrO
和CrO 在溶液中可相互转化,请用离子方程式表示它们之间的转化反应
在溶液中可相互转化,请用离子方程式表示它们之间的转化反应②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
您最近一年使用:0次
2017-04-07更新
|
654次组卷
|
3卷引用:2017届湖南省郴州市高三第三次质量检测理科综合化学试卷
名校
10 . AlPO4的沉淀溶解平衡曲线如图所示(T2>T1).下列说法正确的是( )


| A.图像中四个点的Ksp:a=b>c>d |
| B.AlPO4在b点对应的溶解度大于c点 |
| C.AlPO4(s)⇌Al3+(aq)+PO43-(aq)△H<0 |
| D.升高温度可使d点移动到b点 |
您最近一年使用:0次
2016-12-09更新
|
835次组卷
|
11卷引用:湖南省郴州市2020-2021学年高二上学期期末考试化学(选考)试题
湖南省郴州市2020-2021学年高二上学期期末考试化学(选考)试题2016届贵州省遵义一中高三押题卷理综化学试卷湖北省沙市中学2017-2018学年高二上学期期末考试化学试题【全国百强校】广东省深圳外国语学校2017-2018学年高二上学期期中化学试题(已下线)第8章 单元测试(测)-《2020年高考一轮复习讲练测》安徽省淮北市濉溪县2018-2019学年高二上学期期末考试化学试题湖北省黄石市2018-2019学年高二上学期期末质量监测考试化学试题(已下线)第八章 能力提升检测卷-2021年高考化学一轮复习讲练测(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)四川省宜宾市叙州区第一中学校2024届高三上学期一诊模拟考试理综化学试题广东省广州市白云中学2023-2024学年高二上学期12月月考化学试题



