名校
1 . 用含铬不锈钢废渣(含 、
、 、
、 、
、 等)制取
等)制取 (铬绿)的工艺流程如图所示:
(铬绿)的工艺流程如图所示:

回答下列问题:
(1)“碱熔”时,为使废渣充分氧化可采取的措施是___________ 。
(2) 、KOH、
、KOH、 反应生成
反应生成 的化学方程式为
的化学方程式为___________ 。
(3)“水浸”时,碱熔渣中的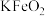 强烈水解生成的难溶物为
强烈水解生成的难溶物为___________ (填化学式);
(4)常温下“酸化”时,pH不宜过低的原因是___________ ;
(5)“还原”时,发生反应的离子方程式为___________ 。
(6)由 制取铬绿的方法是
制取铬绿的方法是___________ 。
 、
、 、
、 、
、 等)制取
等)制取 (铬绿)的工艺流程如图所示:
(铬绿)的工艺流程如图所示:
回答下列问题:
(1)“碱熔”时,为使废渣充分氧化可采取的措施是
(2)
 、KOH、
、KOH、 反应生成
反应生成 的化学方程式为
的化学方程式为(3)“水浸”时,碱熔渣中的
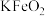 强烈水解生成的难溶物为
强烈水解生成的难溶物为(4)常温下“酸化”时,pH不宜过低的原因是
(5)“还原”时,发生反应的离子方程式为
(6)由
 制取铬绿的方法是
制取铬绿的方法是
您最近一年使用:0次
2023-10-26更新
|
92次组卷
|
2卷引用:河北省秦皇岛市青龙满族自治县2校联考2023-2024学年高一上学期12月月考化学试题
名校
2 . 根据以下实验操作及现象能得出正确结论的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向溶有SO2的BaCl2溶液中通入气体X | 有白色沉淀产生 | 气体X一定有强氧化性 |
| B | 向等浓度等体积的H2O2中分别加入等浓度等体积的KMnO4溶液和CuSO4溶液 | 前者产生气泡速率快 | KMnO4的催化效果比CuSO4好 |
| C | 将银粉加到HI溶液中 | 产生无色气体和黄色沉淀 | I-和Ag+形成沉淀,促进Ag和H+反应 |
| D | 用铂电极电解等物质的量浓度的Fe(NO3)3和Cu(NO3)2混合溶液 | 开始时阴极无红色物质析出 | 氧化性:Cu2+<Fe2+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-10-13更新
|
235次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高一上学期11月期中考试化学试题
名校
3 . 综合利用粉煤灰既有利于环境保护,又有利于资源节约。某种粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下:

(1)“酸浸”时Fe2O3发生反应的离子方程式为___________ 。
(2)当硫酸浓度大于9.2molL1时,铝、铁的浸出率下降。可能原因是___________ 。
(3)有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图所示。“还原”操作加入的试剂为___________ 。“沉铝”过程中加入氨水调pH的范围是___________ ,“沉铝”反应的方程式为___________ 。

(4)“再生”过程中,[Fe(NO)2]2在微生物的作用下与C6H12O6发生反应,生成N2与CO2的物质的量之比为___________ 。

(1)“酸浸”时Fe2O3发生反应的离子方程式为
(2)当硫酸浓度大于9.2molL1时,铝、铁的浸出率下降。可能原因是
(3)有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图所示。“还原”操作加入的试剂为

(4)“再生”过程中,[Fe(NO)2]2在微生物的作用下与C6H12O6发生反应,生成N2与CO2的物质的量之比为
您最近一年使用:0次
2023-09-06更新
|
110次组卷
|
2卷引用:陕西省西安国际港务区铁一中陆港高级中学2023-2024学年高一上学期期末化学试题
4 . 25℃,向1.0L某盐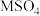 溶液中加入浓氢氧化钠溶液,先出现沉淀,随着氢氧化钠的加入沉淀逐渐溶解得到澄清溶液,假设体积不变;
溶液中加入浓氢氧化钠溶液,先出现沉淀,随着氢氧化钠的加入沉淀逐渐溶解得到澄清溶液,假设体积不变; 与pH的关系如图所示,c为
与pH的关系如图所示,c为 或
或 物质的量浓度的值。回答以下问题:
物质的量浓度的值。回答以下问题:___________ (填“ ”或“
”或“ ”)的
”)的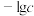 与pH的关系。
与pH的关系。
(2)写出向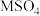 溶液中加入NaOH先沉淀后溶解的离子方程式:
溶液中加入NaOH先沉淀后溶解的离子方程式:_______ ,________ 。
(3) 的溶度积常数
的溶度积常数
___________ 。
(4)pH=10时,溶液中M元素的存在形式为___________ 。(填化学式)
(5)pH=13.5时 物质的量浓度为
物质的量浓度为___________ 。
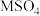 溶液中加入浓氢氧化钠溶液,先出现沉淀,随着氢氧化钠的加入沉淀逐渐溶解得到澄清溶液,假设体积不变;
溶液中加入浓氢氧化钠溶液,先出现沉淀,随着氢氧化钠的加入沉淀逐渐溶解得到澄清溶液,假设体积不变;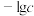 与pH的关系如图所示,c为
与pH的关系如图所示,c为 或
或 物质的量浓度的值。回答以下问题:
物质的量浓度的值。回答以下问题:
 ”或“
”或“ ”)的
”)的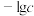 与pH的关系。
与pH的关系。(2)写出向
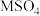 溶液中加入NaOH先沉淀后溶解的离子方程式:
溶液中加入NaOH先沉淀后溶解的离子方程式:(3)
 的溶度积常数
的溶度积常数
(4)pH=10时,溶液中M元素的存在形式为
(5)pH=13.5时
 物质的量浓度为
物质的量浓度为
您最近一年使用:0次
2023-07-29更新
|
288次组卷
|
4卷引用:江西省宜春市丰城市第九中学2023-2024学年高一下学期第一次月考化学试题(日新班)
江西省宜春市丰城市第九中学2023-2024学年高一下学期第一次月考化学试题(日新班)河南省郑州市2022-2023学年高二上学期期末化学试题(已下线)专题08 沉淀溶解平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)山东省菏泽市东明县第一中学2023-2024学年高二上学期12月月考化学试题
名校
5 . 某含砷( )的有毒工业废水经如图流程转化为粗
)的有毒工业废水经如图流程转化为粗 ,已知:亚砷酸钙微溶于水,砷酸钙难溶于水。
,已知:亚砷酸钙微溶于水,砷酸钙难溶于水。

(1)砷是氮的同族元素,且比氮多2个电子层,则 在元素周期表中的位置为
在元素周期表中的位置为___________ ; 的电子式为
的电子式为___________ 。
(2)“碱浸”的目的是将废水中的 和
和 转化为盐。
转化为盐。 属于
属于___________ 电解质(填“强”或“弱”), 转化为
转化为 的离子方程式为
的离子方程式为___________ 。
(3)“氧化”时,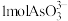 转化为
转化为 至少需要
至少需要
___________  。
。
(4)“沉砷”是将砷元素转化为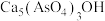 沉淀,发生的主要反应有
沉淀,发生的主要反应有
①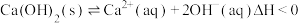
②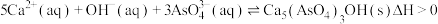
资料表明:“沉砷”的最佳温度是 ,温度高于
,温度高于 时,随温度升高,沉淀率减小,从平衡移动角度分析其原因是
时,随温度升高,沉淀率减小,从平衡移动角度分析其原因是___________ 。
(5)从绿色化学和综合利用的角度考虑,滤液2需要处理,可将滤液2返回___________ 环节循环使用。
 )的有毒工业废水经如图流程转化为粗
)的有毒工业废水经如图流程转化为粗 ,已知:亚砷酸钙微溶于水,砷酸钙难溶于水。
,已知:亚砷酸钙微溶于水,砷酸钙难溶于水。
(1)砷是氮的同族元素,且比氮多2个电子层,则
 在元素周期表中的位置为
在元素周期表中的位置为 的电子式为
的电子式为(2)“碱浸”的目的是将废水中的
 和
和 转化为盐。
转化为盐。 属于
属于 转化为
转化为 的离子方程式为
的离子方程式为(3)“氧化”时,
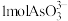 转化为
转化为 至少需要
至少需要
 。
。(4)“沉砷”是将砷元素转化为
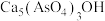 沉淀,发生的主要反应有
沉淀,发生的主要反应有①
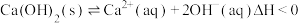
②
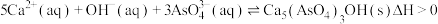
资料表明:“沉砷”的最佳温度是
 ,温度高于
,温度高于 时,随温度升高,沉淀率减小,从平衡移动角度分析其原因是
时,随温度升高,沉淀率减小,从平衡移动角度分析其原因是(5)从绿色化学和综合利用的角度考虑,滤液2需要处理,可将滤液2返回
您最近一年使用:0次
解题方法
6 . 有色金属冶炼废水中的砷元素主要以亚砷酸(H3AsO3)和砷酸(H3AsO4)形式存在,酸性废水中砷元素回收再利用的工业流程如图所示。回答下列问题:
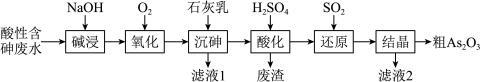
(1)写出As在元素周期表中的位置___________ ,砷虽然是非金属元素,但已表现出一些金属的性质,结合其在元素周期表的位置,说明原因___________ 。
(2)H3AsO4的酸性___________ H3PO4的酸性(填“强于”或“弱于”),依据是___________ 。
(3)“氧化”过程发生的离子方程式是___________ 。
(4)“沉砷”的反应为5Ca2++3AsO +OH-=Ca5(AsO4)3OH(s),最佳温度是85℃。温度高于85℃后,沉淀率下降的原因可能为
+OH-=Ca5(AsO4)3OH(s),最佳温度是85℃。温度高于85℃后,沉淀率下降的原因可能为___________ 。
A.升高温度,反应速率降低
B.85℃,该反应此时反应速率最快
C.升高温度,Ca2+和OH-浓度降低
(5)As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如右图所示,

结合图像分析,“结晶”的具体操作是加热亚砷酸,__________ 过滤得粗As2O3。

(1)写出As在元素周期表中的位置
(2)H3AsO4的酸性
(3)“氧化”过程发生的离子方程式是
(4)“沉砷”的反应为5Ca2++3AsO
 +OH-=Ca5(AsO4)3OH(s),最佳温度是85℃。温度高于85℃后,沉淀率下降的原因可能为
+OH-=Ca5(AsO4)3OH(s),最佳温度是85℃。温度高于85℃后,沉淀率下降的原因可能为A.升高温度,反应速率降低
B.85℃,该反应此时反应速率最快
C.升高温度,Ca2+和OH-浓度降低
(5)As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如右图所示,

结合图像分析,“结晶”的具体操作是加热亚砷酸,
您最近一年使用:0次
7 . 下列说法正确的是
A.常温下,某难溶物的 为 为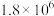 |
B.增大醋酸溶液的浓度,溶液中 减小的原因是水的离子积 减小的原因是水的离子积 减小 减小 |
C.反应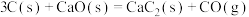 在常温下不能自发进行,说明该反应的 在常温下不能自发进行,说明该反应的 |
D.反应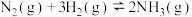 ;达到平衡后,降低温度,v(正)增大,v(逆)减小,平衡向正反应方向移动 ;达到平衡后,降低温度,v(正)增大,v(逆)减小,平衡向正反应方向移动 |
您最近一年使用:0次
8 . 已知:25℃时,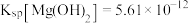 ,
,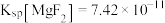 。下列说法正确的是
。下列说法正确的是
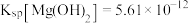 ,
,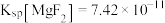 。下列说法正确的是
。下列说法正确的是A.25℃时,在 的悬浊液中加入少量的 的悬浊液中加入少量的 固体, 固体,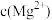 增大 增大 |
B.25℃时,饱和 溶液与饱和 溶液与饱和 溶液相比,前者的 溶液相比,前者的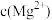 大 大 |
C.25℃时,在 悬浊液中加入NaF溶液后, 悬浊液中加入NaF溶液后, 不可能转化为 不可能转化为 |
D.25℃时, 固体在 固体在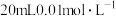 氨水中的 氨水中的 比在 比在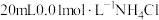 溶液中的 溶液中的 小 小 |
您最近一年使用:0次
9 . 冬奥会国家速滑馆又称为“冰丝带”,所用的碲化镉(CdTe)发电玻璃被誉为“挂在墙上的油田”。镉(Cd)可用于制作发光电子组件,以铜镉废渣(含Cu、Cd、Zn、Fe等单质)为原料制备镉的工艺流程如下:

浸出后的溶液中含有 、
、 、
、 等金属离子,相关金属离子形成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L
等金属离子,相关金属离子形成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L 计算)如下表:
计算)如下表:
(1)可加快“浸出”速率的措施有:___________ (任写一条);“浸出”时通入氮气而不是通入空气的原因是:___________ 。
(2)“氧化”时发生反应的离子方程式为:___________ ;使用 为氧化剂的优点是:
为氧化剂的优点是:___________ 。
(3)“调pH”时控制溶液pH在3.3~5.9之间,“滤渣”的主要成分是___________ (填化学式)。
(4)“置换”时发生反应的离子方程式为:___________ 。

浸出后的溶液中含有
 、
、 、
、 等金属离子,相关金属离子形成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L
等金属离子,相关金属离子形成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L 计算)如下表:
计算)如下表:| 氢氧化物 |  |  |  |
| 开始沉淀的pH | 1.5 | 5.9 | 7.2 |
| 沉淀完全的pH | 3.3 | 8.9 | 9.9 |
(2)“氧化”时发生反应的离子方程式为:
 为氧化剂的优点是:
为氧化剂的优点是:(3)“调pH”时控制溶液pH在3.3~5.9之间,“滤渣”的主要成分是
(4)“置换”时发生反应的离子方程式为:
您最近一年使用:0次
解题方法
10 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料工业上可由天然二氧化锰粉与硫化锰矿(主要成分为 ,还含
,还含 等元素的氧化物)制备,工艺流程如图所示。回答下列问题:
等元素的氧化物)制备,工艺流程如图所示。回答下列问题:

相关金属离子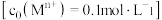 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下表:
范围如下表:
(1)已知“溶浸”中发生反应的化学方程式为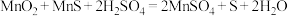 ,当生成
,当生成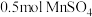 时,该反应中转移
时,该反应中转移___________  电子,该反应中n(还原剂):n(氧化剂)=
电子,该反应中n(还原剂):n(氧化剂)=___________ ,“滤渣1”的主要成分为___________ (填化学式)
(2)“氧化”中添加适量的 的作用是将
的作用是将 氧化为
氧化为 ,酸性条件下
,酸性条件下 氧化
氧化 反应的离子方程式为
反应的离子方程式为___________ (已知: 被还原为
被还原为 )。
)。
(3)“除杂1”的目的是除去 和
和 ,“除杂2”的目的是将
,“除杂2”的目的是将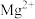 转化为
转化为 沉淀从而除去
沉淀从而除去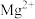 ﹐试推测“调
﹐试推测“调 ”是为了除
”是为了除___________ (填元素符号),溶液的 范围应调节在
范围应调节在___________ ~6(当某金属离子沉淀完全视作该金属离子已除净)。
(4)写出“沉锰”时发生反应的离子方程式:___________ 。
(5)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为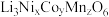 ,其中
,其中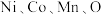 的化合价依次为
的化合价依次为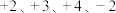 。当
。当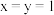 时,
时,
___________ ,试用氧化物的形式表示镍钴锰三元材料:___________ [某些含氧酸盐可以写成氧化物的形式(例如: 可以表示为
可以表示为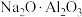 )]。
)]。
 ,还含
,还含 等元素的氧化物)制备,工艺流程如图所示。回答下列问题:
等元素的氧化物)制备,工艺流程如图所示。回答下列问题:
相关金属离子
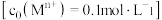 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下表:
范围如下表:| 金属离子 |  |  |  |  |  |  |  |
开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的 | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
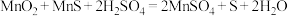 ,当生成
,当生成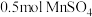 时,该反应中转移
时,该反应中转移 电子,该反应中n(还原剂):n(氧化剂)=
电子,该反应中n(还原剂):n(氧化剂)=(2)“氧化”中添加适量的
 的作用是将
的作用是将 氧化为
氧化为 ,酸性条件下
,酸性条件下 氧化
氧化 反应的离子方程式为
反应的离子方程式为 被还原为
被还原为 )。
)。(3)“除杂1”的目的是除去
 和
和 ,“除杂2”的目的是将
,“除杂2”的目的是将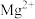 转化为
转化为 沉淀从而除去
沉淀从而除去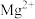 ﹐试推测“调
﹐试推测“调 ”是为了除
”是为了除 范围应调节在
范围应调节在(4)写出“沉锰”时发生反应的离子方程式:
(5)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为
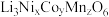 ,其中
,其中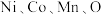 的化合价依次为
的化合价依次为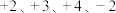 。当
。当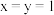 时,
时,
 可以表示为
可以表示为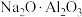 )]。
)]。
您最近一年使用:0次
2023-07-04更新
|
165次组卷
|
2卷引用:河北省保定市2022~2023学年高一下学期期末调研考试化学试题



