解题方法
1 . 常温时,采用甲基橙和酚酞双指示剂,用盐酸滴定Na2CO3溶液,溶液中lgc(H2CO3)、lgc(HCO )、lgc(H+)、lgc(OH-)随溶液pH的变化及滴定曲线如图所示,下列说法不正确的是
)、lgc(H+)、lgc(OH-)随溶液pH的变化及滴定曲线如图所示,下列说法不正确的是
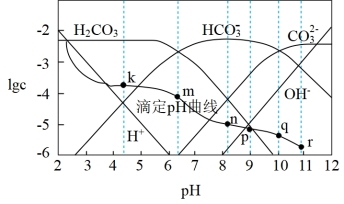
 )、lgc(H+)、lgc(OH-)随溶液pH的变化及滴定曲线如图所示,下列说法不正确的是
)、lgc(H+)、lgc(OH-)随溶液pH的变化及滴定曲线如图所示,下列说法不正确的是
| A.整个滴定过程中可先用酚酞再用甲基橙作指示剂 |
| B.n点的pH为m点和q点pH的平均值 |
C.r点溶液中c(OH-)=c(H+)+c(HCO )+2c(H2CO3) )+2c(H2CO3) |
| D.r点到k点对应的变化过程中,溶液中水的电离程度先减小后增大 |
您最近一年使用:0次
名校
解题方法
2 . 常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1mol•L-1的(NH4)2SO4溶液中:Na+、Cu2+、Cl-、OH- |
B. =10-12的溶液中:Na+、NO =10-12的溶液中:Na+、NO 、[Al(OH)4]-、CO 、[Al(OH)4]-、CO |
C.水电离的c(H+)=1×10-13mol•L-1溶液中:Na+、K+、NO 、HCO 、HCO |
D.0.1mol•L-1的FeCl3溶液中:K+、Mg2+、SO 、SCN- 、SCN- |
您最近一年使用:0次
解题方法
3 . 室温下,向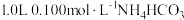 溶液中加入
溶液中加入 稀溶液,溶液中主要微粒的分布系数【如
稀溶液,溶液中主要微粒的分布系数【如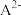 的分布系数
的分布系数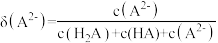 】以及
】以及 随
随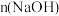 变化如图。
变化如图。
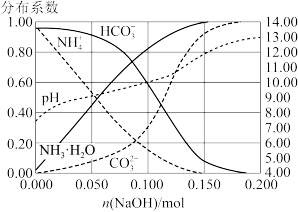
下列叙述错误的是
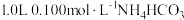 溶液中加入
溶液中加入 稀溶液,溶液中主要微粒的分布系数【如
稀溶液,溶液中主要微粒的分布系数【如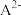 的分布系数
的分布系数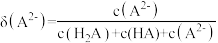 】以及
】以及 随
随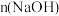 变化如图。
变化如图。
下列叙述错误的是
A.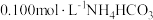 溶液中 溶液中 ,水电离受到促进 ,水电离受到促进 |
B.加入 稀溶液过程中,溶液满足关系式 稀溶液过程中,溶液满足关系式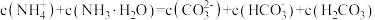 |
C.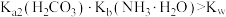 |
D.加入少量 时, 时, 先与 先与 发生主要反应 发生主要反应 |
您最近一年使用:0次
2023高三·全国·专题练习
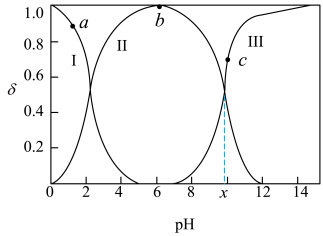
4 . 室温下,甘氨酸在水溶液中主要以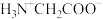 、
、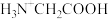 和
和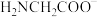 的形式存在,在甘氨酸水溶液中加入
的形式存在,在甘氨酸水溶液中加入 或盐酸调节
或盐酸调节 ,实验测得甘氨酸溶液中各微粒分布分数
,实验测得甘氨酸溶液中各微粒分布分数 与
与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
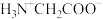 、
、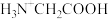 和
和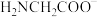 的形式存在,在甘氨酸水溶液中加入
的形式存在,在甘氨酸水溶液中加入 或盐酸调节
或盐酸调节 ,实验测得甘氨酸溶液中各微粒分布分数
,实验测得甘氨酸溶液中各微粒分布分数 与
与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
| A.a点对应溶液中,水的电离程度大于b点 |
B.c点对应溶液中,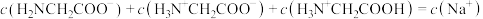 |
C.甘氨酸电离出 的平衡常数 的平衡常数 为 为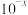 |
D. 点溶液中,存在关系式: 点溶液中,存在关系式: |
您最近一年使用:0次
5 . T℃时,在20.00mL0.10mol·L-1的一元酸HR溶液中滴入0.10mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示。
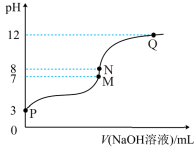
下列说法不正确的是( )

下列说法不正确的是( )
| A..T℃时,HR电离常数Ka≈1.0×10-5 |
| B.M点对应的NaOH溶液体积为20.00mL |
| C.N点与Q点所示溶液中水的电离程度:N>Q |
| D.M点所示溶液中c(Na+)=c(R-) |
您最近一年使用:0次
2020-03-26更新
|
670次组卷
|
6卷引用:广东省兴宁一中2020届高三年级3月质量检测考试(全国I卷)理综化学试题
名校
解题方法
6 . 常温下,用物质的量浓度为amol•L-1的NaOH稀溶液滴定0.1mol•L-1某酸HA溶液,溶液中水电离出的c水(H+)的负对数[-lgc水(H+)]与所加NaOH溶液体积的关系如图所示。下列说法正确
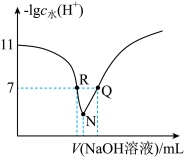

| A.N点溶液显酸性 |
| B.Ka(HA)的值约为10-5 |
| C.R点溶液中:c(Na+)<c(A-) |
| D.Q点溶液中:c(Na+)=c(A-)+c(HA) |
您最近一年使用:0次
2020-11-07更新
|
871次组卷
|
8卷引用:河南省三门峡市外国语高级中学2020-2021学年高二上学期期中考试化学试题
2022高三·全国·专题练习
解题方法
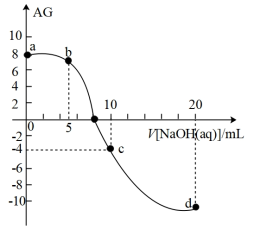
7 . 室温下,向10mL0.1mol·L-1HA溶液中滴加0.1mol·L-1的NaOH溶液,溶液的酸度(AG)与NaOH溶液体积的关系如图所示。已知:AG=lg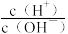 。
。
下列说法错误的是
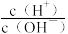 。
。
下列说法错误的是
| A.在a、b、c、d点对应的溶液中,c点时水的电离程度最大 |
| B.b点对应的溶液中:c(A-)>c(Na+)>c(H+)>c(OH-) |
| C.d点对应的溶液中:c(OH-)=c(H+)+c(HA)+c(A-) |
| D.室温下,HA的电离常数Ka约为1.0×10-4 |
您最近一年使用:0次
2022-04-30更新
|
354次组卷
|
3卷引用:押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)
(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)河北省保定市部分学校2021-2022学年高三上学期期中考试化学试题广东省韶关市2021-2022学年高三上学期期中考试化学试题
解题方法
8 . 下列说法错误的是
A.叠氮酸(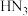 )与 )与 酸性相近,则 酸性相近,则 溶液中离子浓度大小顺序为: 溶液中离子浓度大小顺序为: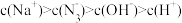 |
B.①100mL0.1mol/L 、②100mL0.1mol/L 、②100mL0.1mol/L 两种溶液中水电离出的 两种溶液中水电离出的 个数:②>① 个数:②>① |
C. 、 、 、 、 、 、 溶于水,对水的电离都有促进作用 溶于水,对水的电离都有促进作用 |
D.室温下,向0.01mol/L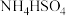 溶液中滴加NaOH溶液至中性: 溶液中滴加NaOH溶液至中性: |
您最近一年使用:0次
名校
9 . 已知: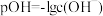 ,它也能较方便地表示溶液的酸碱性。室温下,将稀NaOH溶液滴加到一元酸HB溶液中,混合溶液的pOH随
,它也能较方便地表示溶液的酸碱性。室温下,将稀NaOH溶液滴加到一元酸HB溶液中,混合溶液的pOH随 上的变化如图所示。下列说法错误的是
上的变化如图所示。下列说法错误的是
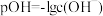 ,它也能较方便地表示溶液的酸碱性。室温下,将稀NaOH溶液滴加到一元酸HB溶液中,混合溶液的pOH随
,它也能较方便地表示溶液的酸碱性。室温下,将稀NaOH溶液滴加到一元酸HB溶液中,混合溶液的pOH随 上的变化如图所示。下列说法错误的是
上的变化如图所示。下列说法错误的是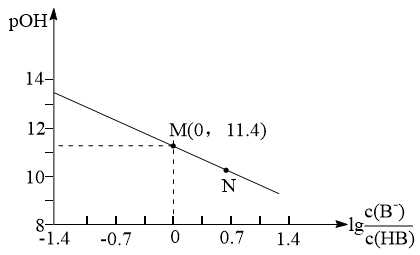
| A.当酸碱完全中和时,水的电离程度最大 |
B.室温下,HB的Ka数量级为 |
| C.将HB与NaB两溶液等体积等浓度混合,所得溶液呈碱性 |
D.N点对应溶液中: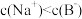 |
您最近一年使用:0次
2022-01-02更新
|
345次组卷
|
4卷引用:河南省名校联盟2021-2022学年高二上学期联考化学试题
名校
解题方法
10 . 已知水的电离平衡曲线如图所示:
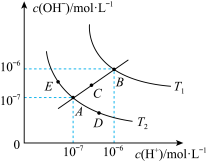
试回答下列问题:
(1)图中
_______  (用“>”、“<”、“=”回答)
(用“>”、“<”、“=”回答)
(2)图中五点的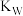 间的关系是
间的关系是_______ 。
(3)若从A点到E点,可采用的措施是_______ 。
a.升温 b.加入少量的盐酸 c.加入少量的NaOH溶液
(4)点E对应的温度下,将 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为_______ 。
(5)点B对应的温度下,若100体积 的某强酸溶液与1体积
的某强酸溶液与1体积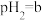 的某强碱溶液混合后溶液呈中性,则混合前,该强酸的
的某强碱溶液混合后溶液呈中性,则混合前,该强酸的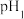 与强碱的
与强碱的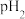 之间应满足的关系是
之间应满足的关系是_______ 。
(6)写出用pH试纸测溶液pH的操作_______ 。

试回答下列问题:
(1)图中

 (用“>”、“<”、“=”回答)
(用“>”、“<”、“=”回答)(2)图中五点的
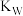 间的关系是
间的关系是(3)若从A点到E点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的NaOH溶液
(4)点E对应的温度下,将
 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为(5)点B对应的温度下,若100体积
 的某强酸溶液与1体积
的某强酸溶液与1体积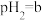 的某强碱溶液混合后溶液呈中性,则混合前,该强酸的
的某强碱溶液混合后溶液呈中性,则混合前,该强酸的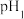 与强碱的
与强碱的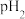 之间应满足的关系是
之间应满足的关系是(6)写出用pH试纸测溶液pH的操作
您最近一年使用:0次
2022-11-10更新
|
348次组卷
|
3卷引用:山东省菏泽市2022-2023学年高二上学期期中考试(B)化学试题



