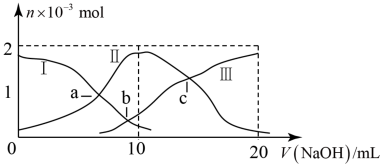
1 . 常温下,向10mL某浓度的二元弱酸 溶液中滴加
溶液中滴加 NaOH溶液,含A微粒的物质的量变化曲线如图所示,下列有关说法不正确的是
NaOH溶液,含A微粒的物质的量变化曲线如图所示,下列有关说法不正确的是
 溶液中滴加
溶液中滴加 NaOH溶液,含A微粒的物质的量变化曲线如图所示,下列有关说法不正确的是
NaOH溶液,含A微粒的物质的量变化曲线如图所示,下列有关说法不正确的是
A.曲线Ⅱ代表 的物质的量 的物质的量 |
B.水的电离程度大小:a点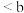 点 点 点 点 |
C. 时,溶液温度最高, 时,溶液温度最高,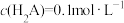 |
D.若c点溶液的 ,则 ,则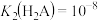 |
您最近一年使用:0次
2 . R、X、Y、Z四种短周期主族元素,其原子半径与原子序数关系如图所示。已知:它们的原子序数之和等于51,R的原子序数与Z的最子外层电子数均为7。下列叙述错误的是
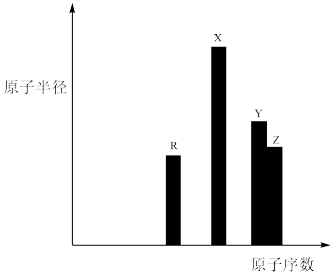
| A.最简单氢化物的稳定性:Y< Z |
| B.同浓度的最简单氢化物水溶液的pH:R> Z> Y |
| C.化合物X2Y2中含两种化学键 |
| D.等浓度的X、Z最高价氧化物对应的水化物的稀溶液中,水的电离程度相同 |
您最近一年使用:0次
2023-06-03更新
|
129次组卷
|
3卷引用:广西壮族自治区玉林市2023届高三下学期学业水平考试理综化学试题
3 . 在25℃时,将1.0 L y mol·L-1 HF溶液与0.1 mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HF或加入NaF固体(忽略体积和温度变化),溶液pH随通入HF(或加入NaF固体)物质的量的变化如图所示。下列叙述正确的是
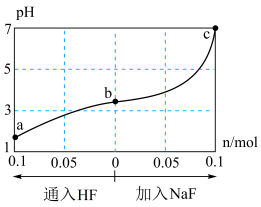

| A.水的电离程度:c>b>a |
| B.a点对应的混合溶液中,c(Na+)=c(HF) |
C.从b到a的过程中,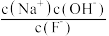 逐渐减小 逐渐减小 |
D.该温度下,氢氟酸的电离平衡常数Ka= |
您最近一年使用:0次
2020-09-25更新
|
569次组卷
|
4卷引用:北京市清华大学附属中学中学生标准学术能力基础性测试2021届高三9月测试化学试题
北京市清华大学附属中学中学生标准学术能力基础性测试2021届高三9月测试化学试题(已下线)北京市清华大学附属中学2021届高三上学期9月月考化学试题(已下线)学科网2021年高三3月大联考考后强化卷(山东卷)山东省济南市历城第二中学2022届高三上学期开学考试化学试卷(A)
解题方法
4 . 室温下,以酚酞为指示剂,用 溶液滴定
溶液滴定 二元酸
二元酸 溶液。溶液pH随滴加NaOH溶液体积
溶液。溶液pH随滴加NaOH溶液体积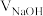 的变化关系如图所示。已知
的变化关系如图所示。已知 的电离过程为:
的电离过程为: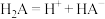 ,
, 。下列叙述正确的是
。下列叙述正确的是

 溶液滴定
溶液滴定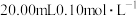 二元酸
二元酸 溶液。溶液pH随滴加NaOH溶液体积
溶液。溶液pH随滴加NaOH溶液体积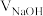 的变化关系如图所示。已知
的变化关系如图所示。已知 的电离过程为:
的电离过程为: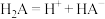 ,
, 。下列叙述正确的是
。下列叙述正确的是
A.室温下,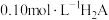 溶液 溶液 |
| B.滴定过程中,水的电离程度一直在增大 |
C.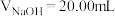 时,溶液中 时,溶液中 |
D.滴定终点时,溶液中 |
您最近一年使用:0次
名校
5 . 常温下,用NaOH溶液分别滴定等物质的量浓度的HX(弱酸)、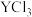 (可溶性盐)和
(可溶性盐)和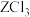 (可溶性盐)三种溶液。
(可溶性盐)三种溶液。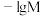 [M表示
[M表示 、
、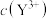 、
、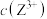 ]随溶液pH的变化如图所示。已知:
]随溶液pH的变化如图所示。已知: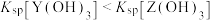 。下列说法错误的是
。下列说法错误的是
 (可溶性盐)和
(可溶性盐)和 (可溶性盐)三种溶液。
(可溶性盐)三种溶液。 [M表示
[M表示 、
、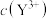 、
、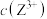 ]随溶液pH的变化如图所示。已知:
]随溶液pH的变化如图所示。已知: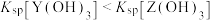 。下列说法错误的是
。下列说法错误的是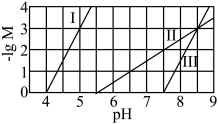
A.曲线I代表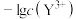 随溶液pH的变化关系 随溶液pH的变化关系 |
B. 的数量级是 的数量级是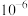 |
C. 固体能完全溶解在 固体能完全溶解在 溶液中 溶液中 |
D.滴定HX溶液至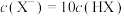 时,溶液中: 时,溶液中: |
您最近一年使用:0次
2024-06-11更新
|
130次组卷
|
2卷引用:湖南省2024届普通高中高三下学期学业水平选择性考试临考预测押题密卷化学试题(B卷)
名校
6 . 常温时,分别向10mL浓度均为1mol/L的HCOOH和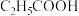 两种酸溶液加水稀释,所得pH与
两种酸溶液加水稀释,所得pH与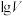 (V为溶液的体积)的关系如图所示。下列说法正确的是
(V为溶液的体积)的关系如图所示。下列说法正确的是
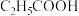 两种酸溶液加水稀释,所得pH与
两种酸溶液加水稀释,所得pH与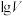 (V为溶液的体积)的关系如图所示。下列说法正确的是
(V为溶液的体积)的关系如图所示。下列说法正确的是
A.1mol/L溶液中水的电离程度: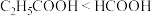 |
B.当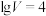 时,HCOOH的 时,HCOOH的 |
C.加入0.4g NaOH后,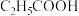 溶液中存在 溶液中存在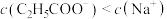 |
D.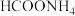 中 中 浓度小于 浓度小于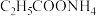 中 中 浓度 浓度 |
您最近一年使用:0次
2023-07-07更新
|
128次组卷
|
3卷引用:云南省大理白族自治州2022-2023学年高二下学期7月期末化学试题
名校
7 . 研究电解质在水溶液中的离子反应与平衡有重要的意义。
Ⅰ.室温下,有浓度均为0.1 mol·L 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。
①HCl②NaCl③ ④
④ ⑤
⑤
资料:室温下电离常数,醋酸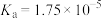 ;碳酸
;碳酸 ,
, 。
。
(1)上述溶液中水的电离被抑制的是_______ (填序号,下同),水的电离被促进的是_______ ,溶液⑤中溶质与水作用的离子方程式表示为_______ 。
(2)上述溶液的pH由大到小的顺序为_______ 。
(3)比较溶液③和④中 的物质的量浓度:③
的物质的量浓度:③_______ ④(填“<”、“=”或“>”)。
(4)室温下,向溶液①中加水稀释至原体积的10倍,所得溶液的pH为_______ 。
(5)向20 mL 0.1 mol/L 中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。

①滴加过程中发生反应的离子方程式是_______ 。
②下列说法正确的是_______ 。
a. A、C两点水的电离程度:
b.B点溶液中微粒浓度满足: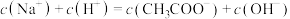
c.D点溶液中微粒浓度满足:
Ⅱ.已知:25°C时 、
、 和HClO的电离平衡常数如下表。
和HClO的电离平衡常数如下表。
(6) 的电离平衡常数表达式
的电离平衡常数表达式
_______ 。
(7)25℃时,等物质的量浓度的NaClO溶液和 溶液中,碱性较强的是
溶液中,碱性较强的是_______ 。
(8)25℃时,若初始时醋酸中 的物质的量浓度为0.01 mol⋅L
的物质的量浓度为0.01 mol⋅L ,达到电离平衡时溶液中
,达到电离平衡时溶液中
_______ mol⋅L 。(已知:
。(已知: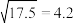 )
)
(9)依据上表数据,下列方程式书写合理的是_______ 。(填字母)(已知: )
)
a. 溶液中滴加次氯酸:
溶液中滴加次氯酸:
b. 溶液中滴加少量醋酸:
溶液中滴加少量醋酸: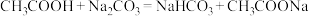
c.NaClO溶液中通入 :
: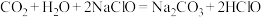
d. 溶液中滴加过量氯水:
溶液中滴加过量氯水: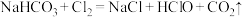
Ⅰ.室温下,有浓度均为0.1 mol·L
 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。①HCl②NaCl③
 ④
④ ⑤
⑤
资料:室温下电离常数,醋酸
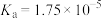 ;碳酸
;碳酸 ,
, 。
。(1)上述溶液中水的电离被抑制的是
(2)上述溶液的pH由大到小的顺序为
(3)比较溶液③和④中
 的物质的量浓度:③
的物质的量浓度:③(4)室温下,向溶液①中加水稀释至原体积的10倍,所得溶液的pH为
(5)向20 mL 0.1 mol/L
 中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
①滴加过程中发生反应的离子方程式是
②下列说法正确的是
a. A、C两点水的电离程度:

b.B点溶液中微粒浓度满足:
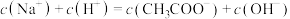
c.D点溶液中微粒浓度满足:

Ⅱ.已知:25°C时
 、
、 和HClO的电离平衡常数如下表。
和HClO的电离平衡常数如下表。| 化学式 |  |  | HClO |
电离平衡常数( ) ) |  |   |  |
(6)
 的电离平衡常数表达式
的电离平衡常数表达式
(7)25℃时,等物质的量浓度的NaClO溶液和
 溶液中,碱性较强的是
溶液中,碱性较强的是(8)25℃时,若初始时醋酸中
 的物质的量浓度为0.01 mol⋅L
的物质的量浓度为0.01 mol⋅L ,达到电离平衡时溶液中
,达到电离平衡时溶液中
 。(已知:
。(已知: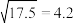 )
)(9)依据上表数据,下列方程式书写合理的是
 )
)a.
 溶液中滴加次氯酸:
溶液中滴加次氯酸:
b.
 溶液中滴加少量醋酸:
溶液中滴加少量醋酸: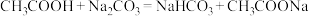
c.NaClO溶液中通入
 :
: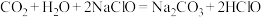
d.
 溶液中滴加过量氯水:
溶液中滴加过量氯水: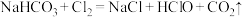
您最近一年使用:0次
8 . 常温下,有以下五种溶液:
请回答以下问题:
(1)向等体积的①和②溶液中分别加入形状、大小一样的锌块(足量),反应一段时间后的速率v①_______ (填“>”、“<”或“=”)v②,若收集等体积的 ,则消耗时间更短的是
,则消耗时间更短的是_______ (填化学式),醋酸和锌反应的离子方程式为_______ 。
(2)若向⑤溶液中加入少量④,⑤的 将
将_______ (填“增大”、“减小”或“不变”,下同);若加入少量②,⑤的水解程度将_______ 。
(3)将等体积的①,②,③,④溶液分别加水稀释至原来的100倍,溶液的 由大到小的顺序是
由大到小的顺序是_______ (填编号)。
(4)分别向等体积的③和④溶液中加入②至恰好完全反应,消耗②更多的是_______ (填化学名称)。
(5)将等体积的①和②溶液混合后,加入 蒸馏水,溶液中
蒸馏水,溶液中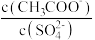 将
将_______ (填“增大”、“减小”或“不变”)。
(6)①,②,③,④,⑤五种溶液中由水电离出的 浓度由大到小的顺序是
浓度由大到小的顺序是_______ (填编号)。
| 编号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | 醋酸 | 硫酸 | 氨水 | 氢氧化钠 | 氯化铵 |
 | 3 | 3 | 11 | 11 | 3 |
(1)向等体积的①和②溶液中分别加入形状、大小一样的锌块(足量),反应一段时间后的速率v①
 ,则消耗时间更短的是
,则消耗时间更短的是(2)若向⑤溶液中加入少量④,⑤的
 将
将(3)将等体积的①,②,③,④溶液分别加水稀释至原来的100倍,溶液的
 由大到小的顺序是
由大到小的顺序是(4)分别向等体积的③和④溶液中加入②至恰好完全反应,消耗②更多的是
(5)将等体积的①和②溶液混合后,加入
 蒸馏水,溶液中
蒸馏水,溶液中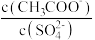 将
将(6)①,②,③,④,⑤五种溶液中由水电离出的
 浓度由大到小的顺序是
浓度由大到小的顺序是
您最近一年使用:0次
2022-01-15更新
|
164次组卷
|
2卷引用:河北省定州市2021-2022学年高二上学期期末考试化学试题
名校
9 . 通过下列实验探究草酸(H2C2O4)的性质。
下列有关说法正确的是
| 实验 | 实验操作和现象 |
| 1 | 加热草酸晶体,将产生的气体通入澄清石灰水中,石灰水变浑浊 |
| 2 | 室温下,用pH计测得0.1mol·L-1H2C2O4溶液的pH约为1.3 |
| 3 | 室温下,向25.00mL0.1mol·L-1H2C2O4溶液中逐滴加入0.1mol·L-1NaOH溶液,得到如图滴定曲线 |

| A.依据实验1的现象,无法确定气体的成分 |
B.0.1 mol·L-1H2C2O4溶液中存在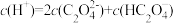 |
| C.a、b、c对应的溶液中,水的电离程度:c>b>a |
D.V(NaOH)=25.00mL时的溶液中: |
您最近一年使用:0次
2021-05-08更新
|
435次组卷
|
3卷引用:江苏省七市(南通、扬州、泰州、淮安、徐州、宿迁、连云港)2021届高三第三次调研考试化学试题
江苏省七市(南通、扬州、泰州、淮安、徐州、宿迁、连云港)2021届高三第三次调研考试化学试题(已下线)化学(江苏卷01)-2024年高考押题预测卷江苏省盐城市五校联盟2023-2024学年高二下学期5月月考化学试题
10 . 化学是一门实验的科学,滴定法是一种常用的化学定量分析的方法。室温下,用 溶液分别滴定体积均为20.00mL、浓度均为
溶液分别滴定体积均为20.00mL、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液的pH随加入NaOH溶液体积而变化的两条滴定曲线。
的盐酸和醋酸溶液,得到滴定过程中溶液的pH随加入NaOH溶液体积而变化的两条滴定曲线。
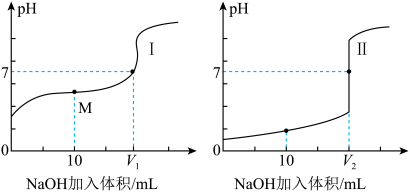
(1)滴定醋酸溶液的曲线是___________ 。(填“Ⅰ”或“Ⅱ”)。
(2)若采用氨水滴定醋酸,写出氨水与醋酸反应的离子反应方程式___________ 。
(3)滴定开始前,三种溶液中由水电离出的 最大的是
最大的是______ 。
A. 溶液 B.
溶液 B. 盐酸 C.
盐酸 C. 醋酸
醋酸
(4)该 溶液的pH为
溶液的pH为______ ;给该溶液加热,pH______ (填“变大”“变小”或“不变”)。
(5)在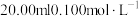 的盐酸中,滴加
的盐酸中,滴加 溶液后,此时溶液的pH=
溶液后,此时溶液的pH=___________ 。
(6)取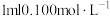 的盐酸稀释1000倍后,溶液pH=
的盐酸稀释1000倍后,溶液pH=___________ ,此时水电离出的 浓度为
浓度为___________ 。
(7)下列离子一定能大量共存的是___________。
(8)下列叙述正确的是___________。
(9)下列有关实验的说法,正确的是___________。
 溶液分别滴定体积均为20.00mL、浓度均为
溶液分别滴定体积均为20.00mL、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液的pH随加入NaOH溶液体积而变化的两条滴定曲线。
的盐酸和醋酸溶液,得到滴定过程中溶液的pH随加入NaOH溶液体积而变化的两条滴定曲线。
(1)滴定醋酸溶液的曲线是
(2)若采用氨水滴定醋酸,写出氨水与醋酸反应的离子反应方程式
(3)滴定开始前,三种溶液中由水电离出的
 最大的是
最大的是A.
 溶液 B.
溶液 B. 盐酸 C.
盐酸 C. 醋酸
醋酸(4)该
 溶液的pH为
溶液的pH为(5)在
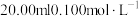 的盐酸中,滴加
的盐酸中,滴加 溶液后,此时溶液的pH=
溶液后,此时溶液的pH=(6)取
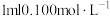 的盐酸稀释1000倍后,溶液pH=
的盐酸稀释1000倍后,溶液pH= 浓度为
浓度为(7)下列离子一定能大量共存的是___________。
A.甲基橙呈黄色的溶液中: 、 、 、 、 、 、 |
B.加入铝粉后产生大量氢气的溶液中: 、 、 、 、 、 、 |
C.石蕊呈蓝色的溶液中: 、 、 、 、 、 、 |
D.pH=1的溶液中: 、 、 、 、 、 、 |
(8)下列叙述正确的是___________。
A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下其 |
B.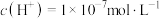 的溶液一定是中性溶液 的溶液一定是中性溶液 |
C.向水中加入少量固体 ,水的电离平衡逆向移动, ,水的电离平衡逆向移动, 减小 减小 |
D.将水加热, 增大,pH不变 增大,pH不变 |
(9)下列有关实验的说法,正确的是___________。
| A.测定HClO溶液pH时,用玻璃棒蘸取溶液,点在干燥pH试纸上 |
| B.等体积、等pH的硫酸与醋酸溶液分别与足量锌反应,醋酸产生的氢气多 |
| C.等体积、等浓度的盐酸和醋酸分别与相同大小的锌粒反应,醋酸初始反应速率快 |
| D.使用pH试纸测定溶液的pH时,若先润湿,则测得溶液的pH一定有误差 |
您最近一年使用:0次



