名校
1 . 某化学兴趣小组在学习完温度对盐类水解的影响后,测定了0.1mol·L-1Na2CO3溶液的pH随温度的变化,结果如下图所示。下列分析正确的是

A.升温前溶液呈碱性的原因是:CO +2H2O +2H2O H2CO3+2OH- H2CO3+2OH- |
B.常温下,0.1 mol·L-1Na2CO3溶液中:c(Na+)>2c(CO )+c(HCO )+c(HCO ) ) |
| C.温度升高,Na2CO3水解程度增大,溶液pH增大,故图1实验数据一定错误 |
| D.降低温度,Na2CO3水解平衡移动和水的电离平衡移动对溶液pH的影响一致 |
您最近一年使用:0次
2022-05-22更新
|
440次组卷
|
5卷引用:河南省郑州市2022届高三第三次质量预测理综化学试题
河南省郑州市2022届高三第三次质量预测理综化学试题河南省驻马店市2021-2022学年高二下学期期末考试化学试题(已下线)专题13 水溶液中的离子平衡-备战2023年高考化学母题题源解密(全国通用)河南省洛阳市第一高级中学2023届高三上学期8月调研考试化学试题河南省封丘县2022-2023学年高三上学期9月第一次月考化学试题
解题方法
2 . 已知25℃时, 的
的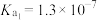

 的
的 溶液用
溶液用 固体调整溶液的
固体调整溶液的 值,设体积不发生改变,下列说法正确的是
值,设体积不发生改变,下列说法正确的是
 的
的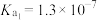

 的
的 溶液用
溶液用 固体调整溶液的
固体调整溶液的 值,设体积不发生改变,下列说法正确的是
值,设体积不发生改变,下列说法正确的是A.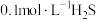 溶液的电离度约为1.0% 溶液的电离度约为1.0% |
B.NaHS水溶液呈现碱性,温度升高溶液 一定升高 一定升高 |
C.当溶液的 时,溶液中的 时,溶液中的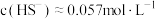 |
D.当溶液的 时,溶液中的 时,溶液中的 |
您最近一年使用:0次
3 . 常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的一元酸HX溶液和HY溶液(两溶液水的电离程度:HX>HY,当Ka≤10-5时可以认为电解质达到电离平衡时的浓度近似等于起始浓度),其滴定曲线如图所示
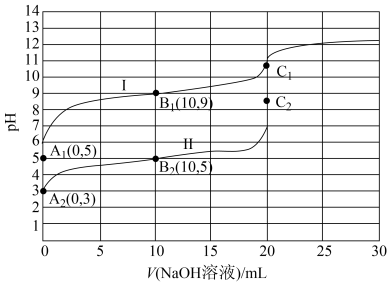
已知:弱电解质在溶液里达到电离平衡时,已电离的电解质分子数占起始时总分子数的百分数称为电离度,下列说法正确的是

已知:弱电解质在溶液里达到电离平衡时,已电离的电解质分子数占起始时总分子数的百分数称为电离度,下列说法正确的是
| A.曲线I和II对应的酸分别为HY和HX |
| B.相比曲线I,曲线II选用酚酞作终点指示剂误差更小 |
| C.把曲线上加入40mLNaOH溶液的点称为E点,则B1、C1和E三点溶液中由水电离出的c(H+)大小关系为C1>E>B1 |
| D.0.10mol/L弱酸HX和HY电离度之比为1:10 |
您最近一年使用:0次
4 . 25°C时,下列说法正确的是
| A.N2H4的水溶液呈弱碱性,Kb1≈1.0×10-6,则0.01mol·L-1 N2H4水溶液的pH≈10 |
B.向NaHSO3溶液中加入少量的I2,则溶液中 将减小 将减小 |
| C.中和等pH的盐酸和醋酸时,醋酸消耗NaOH的物质的量更多 |
| D.pH=7的某溶液,溶质对水的电离平衡肯定无影响 |
您最近一年使用:0次
解题方法
5 . 25℃, 向 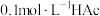 溶液中滴入等浓度的
溶液中滴入等浓度的  溶液, 下列判断一定正确的是
溶液, 下列判断一定正确的是
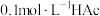 溶液中滴入等浓度的
溶液中滴入等浓度的  溶液, 下列判断一定正确的是
溶液, 下列判断一定正确的是A.若最终溶液含等摩尔  和 和 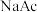 , 则 , 则  |
B.若  溶液过量, 则 溶液过量, 则  |
C.若  溶液不足量, 则 溶液不足量, 则  溶液加入越少水的电离程度越大 溶液加入越少水的电离程度越大 |
D.若恰好完全反应, 则 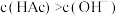 |
您最近一年使用:0次
2022-04-20更新
|
342次组卷
|
4卷引用:上海市长宁区2022届高三二模考试化学试题
上海市长宁区2022届高三二模考试化学试题上海市长宁区2022届高三下学期二模考试化学试题(已下线)秘籍16 电解质溶液微粒变化及图象分析-备战2022年高考化学抢分秘籍(全国通用)(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)
6 . 常温下,向500mL一定物质的量浓度KAl(SO4)2溶液中逐滴加入0.1mol·L-1Ba(OH)2溶液,加入Ba(OH)2溶液的体积和所得沉淀的质量关系如图,(忽略混合时溶液体积的变化),已知:Ksp(BaSO4)=1.1×10-10。下列说法正确的是


A.ab段发生离子反应有:SO +Ba2+=BaSO4↓、Al3++3OH-=Al(OH)3↓ +Ba2+=BaSO4↓、Al3++3OH-=Al(OH)3↓ |
| B.a点、b点、c点三点所对应的溶液的水的电离程度:a>b>c |
C.若V2=1;V3=1.5时,c点溶液中c(SO )=4.4×10-9mol·L-1 )=4.4×10-9mol·L-1 |
| D.若V2=1时,m2=27.2 |
您最近一年使用:0次
解题方法
7 . 已知25℃时,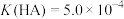 ,
, 。下列说法
。下列说法不正确 的是
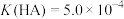 ,
, 。下列说法
。下列说法A.25C时,等浓度的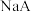 和 和 两溶液,水的电离程度前者小于后者 两溶液,水的电离程度前者小于后者 |
B.25℃时,等pH值的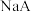 和 和 两溶液, 两溶液, |
C.25℃时,等物质的量浓度的 和 和 两溶液加水稀释10倍后,电离度 两溶液加水稀释10倍后,电离度 |
D.25℃时,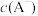 和 和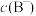 相等的两种酸溶液pH相等,混合后pH不变 相等的两种酸溶液pH相等,混合后pH不变 |
您最近一年使用:0次
2022-04-14更新
|
483次组卷
|
2卷引用:浙江省台州市2022届高三下学期4月教学质量评估(二模)化学试题
2022·河北·模拟预测
解题方法
8 . 25℃时,关于pH均为11、体积均为15mL的氨水与NaOH溶液的下列说法中不正确的是
| A.温度不变,加水稀释至1500mL后,氨水中c(OH-)>1×10-5mol·L-1 |
| B.分别加入pH=3、V=15mL的盐酸,所得溶液的pH:氨水>NaOH溶液 |
C.氨水中n(NH )<NaOH溶液中n(Na+) )<NaOH溶液中n(Na+) |
| D.当温度由25℃升高到80℃时,溶液中水的电离程度均增大,且水的电离程度:NaOH溶液>氨水(不考虑溶质挥发损失) |
您最近一年使用:0次
2022·河北·模拟预测
解题方法
9 . 下列各项叙述正确的是
| A.物质的量浓度相同的NaCl、CH3COONa两种溶液,两溶液中全部离子物质的量浓度之和也相同 |
| B.室温下,将醋酸溶液加水稀释,溶液中c(H+)和c(OH-)均减小 |
| C.常温下,溶液中水电离出来的c(H+)与水电离出来的c(OH-)乘积不一定等于10-14 |
| D.已知AgCl、AgBr的Ksp分别为1.8×10-10和5.0×10-13,故在AgCl的悬浊液中滴入0.1mol·L-1NaBr溶液一定产生AgBr沉淀,而在AgBr的悬浊液中滴入0.1mol·L-1NaCl溶液不可能产生AgCl沉淀 |
您最近一年使用:0次
2022·全国·模拟预测
解题方法
10 . 常温下,用不同浓度的NaOH溶液滴定对应浓度的盐酸,pH变化曲线如图所示,下列叙述错误的是(已知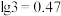 )
)
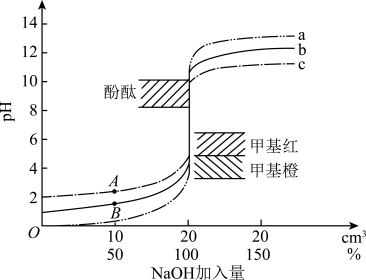
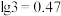 )
)
| A.B点对应溶液不能选用甲基红为指示剂 | B.B点水的电离程度大于A点 |
| C.A的pH为2.47 | D.浓度越大pH的突变范围越小 |
您最近一年使用:0次



