名校
1 . 硼酸( )在水溶液中存在电离平衡:
)在水溶液中存在电离平衡: 。用
。用
 溶液分别滴定体积均为
溶液分别滴定体积均为 的
的 硼酸溶液、
硼酸溶液、 硼酸和甘露醇混合溶液,滴定过程中硼酸溶液
硼酸和甘露醇混合溶液,滴定过程中硼酸溶液 、混合溶液的
、混合溶液的 随加入的
随加入的 溶液体积的变化如图。
溶液体积的变化如图。
 )在水溶液中存在电离平衡:
)在水溶液中存在电离平衡: 。用
。用
 溶液分别滴定体积均为
溶液分别滴定体积均为 的
的 硼酸溶液、
硼酸溶液、 硼酸和甘露醇混合溶液,滴定过程中硼酸溶液
硼酸和甘露醇混合溶液,滴定过程中硼酸溶液 、混合溶液的
、混合溶液的 随加入的
随加入的 溶液体积的变化如图。
溶液体积的变化如图。已知: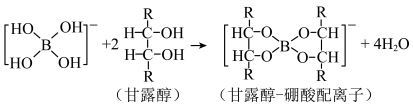
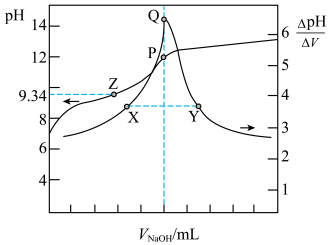
| A.滴定硼酸时加入甘露醇可获得更显著的滴定突跃 | B.溶液 :X点<Y点 :X点<Y点 |
C.Z点: | D.P点和Q点均代表反应终点 |
您最近一年使用:0次
解题方法
2 . 某小组同学用 的
的 溶液滴定未知浓度的一种酸
溶液滴定未知浓度的一种酸 ,滴定过程的曲线如图所示,B点为两者恰好反应的点。下列有关说法正确的是
,滴定过程的曲线如图所示,B点为两者恰好反应的点。下列有关说法正确的是

 的
的 溶液滴定未知浓度的一种酸
溶液滴定未知浓度的一种酸 ,滴定过程的曲线如图所示,B点为两者恰好反应的点。下列有关说法正确的是
,滴定过程的曲线如图所示,B点为两者恰好反应的点。下列有关说法正确的是
| A.这种酸可能是醋酸 |
| B.若用酚酞作指示剂,滴定终点在A处,若用甲基橙为指示剂,滴定终点在C处 |
C.若酸为硫酸,B点溶液中有: |
D.若酸为盐酸,C处溶液离子浓度大小关系为: |
您最近一年使用:0次
名校
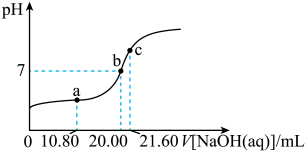
3 . 常温下,用某未知浓度的 溶液滴定
溶液滴定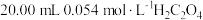 溶液,滴定曲线如图所示,c点溶液中,
溶液,滴定曲线如图所示,c点溶液中,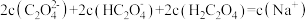 。下列说法错误的是
。下列说法错误的是
 溶液滴定
溶液滴定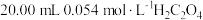 溶液,滴定曲线如图所示,c点溶液中,
溶液,滴定曲线如图所示,c点溶液中,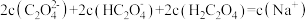 。下列说法错误的是
。下列说法错误的是
| A.c点为反应终点 |
B.该 溶液的物质的量浓度为 溶液的物质的量浓度为 |
C.b点溶液中,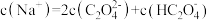 |
D.a点溶液中, |
您最近一年使用:0次
2024-03-04更新
|
116次组卷
|
3卷引用:江西省部分学校2023-2024学年高二下学期开学考试化学试题
名校
4 . 根据所学知识填空。
Ⅰ、某化学兴趣小组的同学用量热计来测定稀盐酸与氢氧化钠溶液中和反应的反应热:装置如图所示。
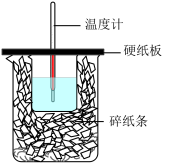
(1)从实验装置上看,图中尚缺少的一种仪器是______________ 。
(2)现用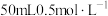 的稀盐酸与
的稀盐酸与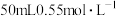 氢氧化钠溶液反应测定,以下操作可能会导致测得的中和反应放出热量数值偏大的是
氢氧化钠溶液反应测定,以下操作可能会导致测得的中和反应放出热量数值偏大的是___________ 。
A.实验装置保温、隔热效果差
B.量取稀盐酸的体积时仰视读数
C.分多次把氢氧化钠溶液倒入盛有稀盐酸的小烧杯中
Ⅱ、某同学欲用物质的量浓度为 的氢氧化钠溶液测定未知物质的量浓度的醋酸溶液。其操作步骤可分为以下几步:
的氢氧化钠溶液测定未知物质的量浓度的醋酸溶液。其操作步骤可分为以下几步:
①取 待测醋酸溶液注入洁净的锥形瓶中,并滴加2~3滴指示剂。
待测醋酸溶液注入洁净的锥形瓶中,并滴加2~3滴指示剂。
②用标准溶液润洗滴定管2~3次。
③把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液。
④取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上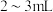 处。
处。
⑤调节液面至“0”或“0”以下刻度,记下读数。
⑥把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点,并记下滴定管液面的刻度。
请回答下列问题:
(3)为减小实验误差,步骤①中滴加的指示剂为___________。
(4)上述滴定实验正确的操作步骤的顺序是___________________。
(5)步骤⑥达到滴定终点的标志是:_______________________________ 。
(6)结合下表数据,计算待测醋酸溶液的物质的量浓度是___________  (保留4位有效数字)。
(保留4位有效数字)。
(7)以下操作会导致测定结果偏低的是_____________。
Ⅰ、某化学兴趣小组的同学用量热计来测定稀盐酸与氢氧化钠溶液中和反应的反应热:装置如图所示。

(1)从实验装置上看,图中尚缺少的一种仪器是
(2)现用
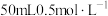 的稀盐酸与
的稀盐酸与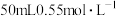 氢氧化钠溶液反应测定,以下操作可能会导致测得的中和反应放出热量数值偏大的是
氢氧化钠溶液反应测定,以下操作可能会导致测得的中和反应放出热量数值偏大的是A.实验装置保温、隔热效果差
B.量取稀盐酸的体积时仰视读数
C.分多次把氢氧化钠溶液倒入盛有稀盐酸的小烧杯中
Ⅱ、某同学欲用物质的量浓度为
 的氢氧化钠溶液测定未知物质的量浓度的醋酸溶液。其操作步骤可分为以下几步:
的氢氧化钠溶液测定未知物质的量浓度的醋酸溶液。其操作步骤可分为以下几步:①取
 待测醋酸溶液注入洁净的锥形瓶中,并滴加2~3滴指示剂。
待测醋酸溶液注入洁净的锥形瓶中,并滴加2~3滴指示剂。②用标准溶液润洗滴定管2~3次。
③把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液。
④取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上
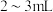 处。
处。⑤调节液面至“0”或“0”以下刻度,记下读数。
⑥把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点,并记下滴定管液面的刻度。
请回答下列问题:
(3)为减小实验误差,步骤①中滴加的指示剂为___________。
| A.甲基橙 | B.石蕊 | C.酚酞 |
(4)上述滴定实验正确的操作步骤的顺序是___________________。
| A.②④③⑤①⑥ | B.①②③④⑤⑥ | C.②③④⑤①⑥ | D.②⑤④③①⑥ |
(5)步骤⑥达到滴定终点的标志是:
(6)结合下表数据,计算待测醋酸溶液的物质的量浓度是
 (保留4位有效数字)。
(保留4位有效数字)。滴定次数 | 待测醋酸溶液的体积 | 标准氢氧化钠溶液的体积 | |
滴定前的刻度 | 滴定后的刻度 | ||
第一次 | 20.00 | 2.34 | 20.39 |
第二次 | 20.00 | 3.20 | 23.20 |
第三次 | 20.00 | 0.60 | 20.80 |
(7)以下操作会导致测定结果偏低的是_____________。
| A.滴定前盛放醋酸溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| B.碱式滴定管读数时滴定前仰视,滴定后俯视 |
| C.滴定前碱式滴定管尖嘴处有气泡,滴定后滴定管尖嘴气泡消失 |
| D.酸式滴定管使用前,水洗后未用待测醋酸润洗 |
您最近一年使用:0次
2024-03-01更新
|
44次组卷
|
2卷引用:江西省上饶市2023-2024学年高二上学期期末教学质量测试化学试卷
名校
5 . 为检测某品牌银耳中添加剂亚硫酸盐的含量,取 银耳样品和
银耳样品和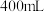 蒸馏水放入三颈瓶中;取
蒸馏水放入三颈瓶中;取 碘标准溶液和
碘标准溶液和 淀粉溶液加入锥形瓶中,并加入适量蒸馏水搅拌,部分装置如图。向三颈瓶中通氮气,再加入过量磷酸,加热并保持微沸,同时用
淀粉溶液加入锥形瓶中,并加入适量蒸馏水搅拌,部分装置如图。向三颈瓶中通氮气,再加入过量磷酸,加热并保持微沸,同时用 碘标准溶液滴定,至终点时滴定消耗了
碘标准溶液滴定,至终点时滴定消耗了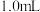 碘标准液。另做空白实验,消耗
碘标准液。另做空白实验,消耗 碘标准溶液。下列说法正确的是
碘标准溶液。下列说法正确的是
 银耳样品和
银耳样品和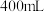 蒸馏水放入三颈瓶中;取
蒸馏水放入三颈瓶中;取 碘标准溶液和
碘标准溶液和 淀粉溶液加入锥形瓶中,并加入适量蒸馏水搅拌,部分装置如图。向三颈瓶中通氮气,再加入过量磷酸,加热并保持微沸,同时用
淀粉溶液加入锥形瓶中,并加入适量蒸馏水搅拌,部分装置如图。向三颈瓶中通氮气,再加入过量磷酸,加热并保持微沸,同时用 碘标准溶液滴定,至终点时滴定消耗了
碘标准溶液滴定,至终点时滴定消耗了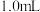 碘标准液。另做空白实验,消耗
碘标准液。另做空白实验,消耗 碘标准溶液。下列说法正确的是
碘标准溶液。下列说法正确的是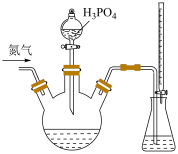
A.选择的三颈瓶规格为 |
| B.滴定终点溶液变为蓝色,读数时应双手上下持滴定管 |
| C.“不通氮气”或者“先加磷酸再通氮气”,这两种做法都会使测定结果偏高 |
D.银耳样品中亚硫酸盐的百分含量(以 质量计)为 质量计)为 |
您最近一年使用:0次
2024-02-06更新
|
344次组卷
|
3卷引用:江西省鹰潭市2024届高三下学期第一次模拟考试化学试题
名校
6 . 某学习小组用 标准溶液来测定未知物质的量浓度的盐酸时,选择酚酞作指示剂.请回答下列问题:
标准溶液来测定未知物质的量浓度的盐酸时,选择酚酞作指示剂.请回答下列问题:
(1)盛装 标准溶液的仪器名称为
标准溶液的仪器名称为___________________ ,若滴定开始和结束时,该仪器中溶液读数如图所示,所用 标准溶液的体积为
标准溶液的体积为_______________  .
.

(2)下列操作会使所测结果偏高的是_______________ (填字母).
A.滴定前用蒸馏水冲洗锥形瓶
B.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
C.滴定过程中不慎将数滴碱液滴在锥形瓶外
D.碱式滴定管在滴定前有气泡,滴定后气泡消失
E.读取 体积时,开始仰视读数,滴定结束时俯视读数
体积时,开始仰视读数,滴定结束时俯视读数
(3)用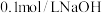 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液
的盐酸和醋酸溶液,得到滴定过程中溶液 随加入
随加入 溶液体积而变化的两条滴定曲线.
溶液体积而变化的两条滴定曲线.

①滴定醋酸的曲线是_______________ (填“Ⅰ”或“Ⅱ”).
② 和
和 的关系:
的关系:
________  (填“>”、“=”或“<”).
(填“>”、“=”或“<”).
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是________________________________ .
(4)氧化还原滴定法是氧化还原反应为基础的一种滴定分析方法,某同学用 的酸性
的酸性 标准溶液滴定某试样中过氧化氢的含量,反应原理为
标准溶液滴定某试样中过氧化氢的含量,反应原理为

①到达滴定终点时的现象为________________________________
②用滴定管量取 试样置于锥形瓶中,重复滴定四次,每次消耗的酸性标准
试样置于锥形瓶中,重复滴定四次,每次消耗的酸性标准 溶液的体积如表所示:测试样中过氧化氢的浓度为
溶液的体积如表所示:测试样中过氧化氢的浓度为________________  .
.
 标准溶液来测定未知物质的量浓度的盐酸时,选择酚酞作指示剂.请回答下列问题:
标准溶液来测定未知物质的量浓度的盐酸时,选择酚酞作指示剂.请回答下列问题:(1)盛装
 标准溶液的仪器名称为
标准溶液的仪器名称为 标准溶液的体积为
标准溶液的体积为 .
.
(2)下列操作会使所测结果偏高的是
A.滴定前用蒸馏水冲洗锥形瓶
B.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
C.滴定过程中不慎将数滴碱液滴在锥形瓶外
D.碱式滴定管在滴定前有气泡,滴定后气泡消失
E.读取
 体积时,开始仰视读数,滴定结束时俯视读数
体积时,开始仰视读数,滴定结束时俯视读数(3)用
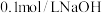 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液
的盐酸和醋酸溶液,得到滴定过程中溶液 随加入
随加入 溶液体积而变化的两条滴定曲线.
溶液体积而变化的两条滴定曲线.
①滴定醋酸的曲线是
②
 和
和 的关系:
的关系:
 (填“>”、“=”或“<”).
(填“>”、“=”或“<”).③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是
(4)氧化还原滴定法是氧化还原反应为基础的一种滴定分析方法,某同学用
 的酸性
的酸性 标准溶液滴定某试样中过氧化氢的含量,反应原理为
标准溶液滴定某试样中过氧化氢的含量,反应原理为
①到达滴定终点时的现象为
②用滴定管量取
 试样置于锥形瓶中,重复滴定四次,每次消耗的酸性标准
试样置于锥形瓶中,重复滴定四次,每次消耗的酸性标准 溶液的体积如表所示:测试样中过氧化氢的浓度为
溶液的体积如表所示:测试样中过氧化氢的浓度为 .
.第一次 | 第二次 | 第三次 | 第四次 | |
体积 | 17.04 | 18.00 | 17.00 | 16.96 |
您最近一年使用:0次
2024-02-01更新
|
81次组卷
|
2卷引用:江西省新余市2023-2024学年高二上学期期末质量检测化学试卷
7 . 一定条件下,利用浓溴水与苯酚反应,可测定工业废水中苯酚的含量(其他杂质不与浓溴水反应)。实验步骤如下:
①用酸式滴定管准确量取20.00mL待测废水于100mL锥形瓶中;
②向锥形瓶中迅速加入过量的 浓溴水,塞紧瓶塞,振荡;
浓溴水,塞紧瓶塞,振荡;
③打开瓶塞,向锥形瓶中迅速加入过量的 溶液,塞紧瓶塞,振荡;
溶液,塞紧瓶塞,振荡;
④滴入2~3滴指示剂,再用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 ,发生反应:
,发生反应: ;
;
⑤待测废水换为蒸馏水进行空白实验,重复上述步骤,消耗 溶液
溶液 。
。
废水中苯酚含量( )表达式正确的是
)表达式正确的是
①用酸式滴定管准确量取20.00mL待测废水于100mL锥形瓶中;
②向锥形瓶中迅速加入过量的
 浓溴水,塞紧瓶塞,振荡;
浓溴水,塞紧瓶塞,振荡;③打开瓶塞,向锥形瓶中迅速加入过量的
 溶液,塞紧瓶塞,振荡;
溶液,塞紧瓶塞,振荡;④滴入2~3滴指示剂,再用
 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 ,发生反应:
,发生反应: ;
;⑤待测废水换为蒸馏水进行空白实验,重复上述步骤,消耗
 溶液
溶液 。
。废水中苯酚含量(
 )表达式正确的是
)表达式正确的是A.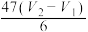 | B. | C.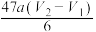 | D. |
您最近一年使用:0次
名校
解题方法
8 . 用0.1000 mol-1的NaOH溶液分别滴定0.1000 mol/L、20.00mLHX、HY、HZ三种酸溶液。溶液pH与加入NaOH体积之间的关系如图所示,下列说法错误的是


| A.HX为一元强酸,电离常数Ka(HY)>Ka(HZ) |
| B.a.b.c三点中,b点所对应的水溶液里阴离子的物质的量浓度最大 |
| C.d点所对应的水溶液里,c(OH-)约为0.02 mol/L |
| D.滴定时可使用酚酞作指示剂 |
您最近一年使用:0次
2023-12-18更新
|
189次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
9 . 室温时,将0.10 mol·L-1 NaOH溶液滴入20.00 mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积的变化曲线如图所示(忽略溶液混合时体积的变化)。当V(NaOH)=20.00 mL(图中c点),二者恰好完全反应。下列有关说法不正确的是

| A.HA为弱酸,其物质的量浓度为0.10 mol·L-1 |
| B.a点时:c(A-)+c(HA)=2c(H+)+2c(OH-) |
| C.c点时:c(Na+)> c(A-) >c(OH-)> c(H+) |
| D.d点时:3c(HA)+3c(A-)=2c(Na+) |
您最近一年使用:0次
2023-09-14更新
|
415次组卷
|
3卷引用:江西省宜春市丰城市第九中学2023-2024学年高一下学期第一次月考化学试题(日新班)
名校
10 . 滴定法是实验室和工业生产中常用的一种简便、快速和应用广泛的定量分析方法,常见的有:酸碱中和滴定法、氧化还原滴定法、沉淀滴定法等。
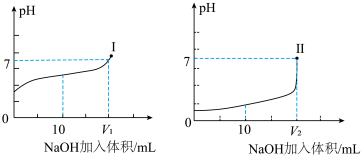
(1)酸碱中和滴定:在实验室用
 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到溶液
的盐酸和醋酸溶液,得到溶液 随加入
随加入 溶液体积而变化的两条滴定曲线。
溶液体积而变化的两条滴定曲线。
①用 溶液滴定醋酸溶液选择的指示剂为
溶液滴定醋酸溶液选择的指示剂为___________ ,滴定终点的现象是___________ ;符合其滴定曲线的是___________ (填“Ⅰ”或“Ⅱ”),。
②图中 和
和 大小的比较:
大小的比较:
___________  (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(2)氧化还原滴定法: 、
、 对环境具有极强的污染性,含有
对环境具有极强的污染性,含有 、
、 的工业废水常采用
的工业废水常采用 沉淀法除去。
沉淀法除去。
已知:常温下,当溶液的 为5时,
为5时, 恰好完全沉淀
恰好完全沉淀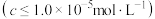 ;
; 过量时
过量时 溶解生成
溶解生成 。(2)
。(2) 还原产物为
还原产物为 。
。
①常温下, 的溶度积常数
的溶度积常数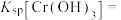
___________ 。
为测定工业废水中 的物质的量浓度,操作步骤如下:
的物质的量浓度,操作步骤如下:
Ⅰ.取 禠液
禠液
Ⅱ.用 标准
标准 酸性溶液滴定
酸性溶液滴定 某浓度
某浓度 溶液,消耗
溶液,消耗 溶液
溶液 ;
;
Ⅲ.取 滤液,用上述
滤液,用上述 溶液滴定,达到滴定终点时,消耗
溶液滴定,达到滴定终点时,消耗
 溶液
溶液
②步骤Ⅱ中的滴定过程应选用___________ (填“酸式”或“碱式”)滴定管。
③步骤Ⅲ的滤液中 物质的量浓度为
物质的量浓度为___________  。
。
(3)沉淀滴定——利用沉淀反应进行滴定、测量溶液物质的量浓度的方法,所用指示剂本身就是沉淀剂,滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用 溶液滴定
溶液滴定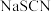 溶液,可选用的指示剂是
溶液,可选用的指示剂是___________ (填选项字母)。
a. b.
b. c.
c. d.
d.

(1)酸碱中和滴定:在实验室用

 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到溶液
的盐酸和醋酸溶液,得到溶液 随加入
随加入 溶液体积而变化的两条滴定曲线。
溶液体积而变化的两条滴定曲线。①用
 溶液滴定醋酸溶液选择的指示剂为
溶液滴定醋酸溶液选择的指示剂为②图中
 和
和 大小的比较:
大小的比较:
 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。(2)氧化还原滴定法:
 、
、 对环境具有极强的污染性,含有
对环境具有极强的污染性,含有 、
、 的工业废水常采用
的工业废水常采用 沉淀法除去。
沉淀法除去。已知:常温下,当溶液的
 为5时,
为5时, 恰好完全沉淀
恰好完全沉淀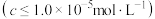 ;
; 过量时
过量时 溶解生成
溶解生成 。(2)
。(2) 还原产物为
还原产物为 。
。①常温下,
 的溶度积常数
的溶度积常数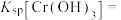
为测定工业废水中
 的物质的量浓度,操作步骤如下:
的物质的量浓度,操作步骤如下:Ⅰ.取
 禠液
禠液Ⅱ.用
 标准
标准 酸性溶液滴定
酸性溶液滴定 某浓度
某浓度 溶液,消耗
溶液,消耗 溶液
溶液 ;
;Ⅲ.取
 滤液,用上述
滤液,用上述 溶液滴定,达到滴定终点时,消耗
溶液滴定,达到滴定终点时,消耗
 溶液
溶液②步骤Ⅱ中的滴定过程应选用
③步骤Ⅲ的滤液中
 物质的量浓度为
物质的量浓度为 。
。(3)沉淀滴定——利用沉淀反应进行滴定、测量溶液物质的量浓度的方法,所用指示剂本身就是沉淀剂,滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用
 溶液滴定
溶液滴定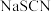 溶液,可选用的指示剂是
溶液,可选用的指示剂是| 难溶物 |  |  |  |  |  |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
 | 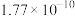 | 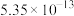 | 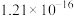 | 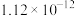 |  |
 b.
b. c.
c. d.
d.
您最近一年使用:0次
2023-08-05更新
|
356次组卷
|
2卷引用:2023-2024学年高二化学下学期月考1试卷





