名校
解题方法
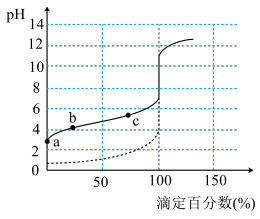
1 . 常温下,向20mL0.1mol/L一元碱MOH溶液中滴加等浓度的一元酸HX溶液,滴定过程中溶液pH值的变化曲线如下图所示,已知4<m<6,下列说法不正确的是

| A.该滴定过程中应选用酚酞作指示剂 | B.一元酸HX的Ka=5×10-5 |
| C.溶液中水的电离程度:b>c>a | D.c点溶液中:c(M+)>c(X-)>c(H+)>c(OH-) |
您最近一年使用:0次
2024-01-15更新
|
340次组卷
|
4卷引用:专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024届陕西省宝鸡市高考模拟监测(一) 理科综合试题湖南省常德市第一中学2023-2024学年高二上学期期末考试化学试题广东省梅州市大埔县虎山中学2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
2 . 常温下,用 的
的 溶液分别滴定
溶液分别滴定 的
的 溶液和
溶液和 的醋酸溶液,滴定曲线如下图。下列有关说法正确的是
的醋酸溶液,滴定曲线如下图。下列有关说法正确的是
 的
的 溶液分别滴定
溶液分别滴定 的
的 溶液和
溶液和 的醋酸溶液,滴定曲线如下图。下列有关说法正确的是
的醋酸溶液,滴定曲线如下图。下列有关说法正确的是
| A.实线表示滴定盐酸的曲线 |
| B.酸的强弱是影响突跃范围大小的重要因素 |
C.ab段的离子反应式是 |
| D.两个体系滴定终点的确定都可用甲基橙作指示剂 |
您最近一年使用:0次
2023-04-16更新
|
384次组卷
|
2卷引用:甘肃省会宁县第一中学2023-2024学年高三下学期第一次月考化学试题
名校
解题方法
3 . 化学是一门以实验为基础的学科。回答下列问题:
Ⅰ.中和反应反应热的测定。
测定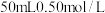 盐酸和
盐酸和 溶液中和反应时放出的热量。
溶液中和反应时放出的热量。
(1)采用稍过量的 溶液的原因是
溶液的原因是_______ 。
(2)若两种溶液的密度均为 ,反应后生成溶液的比热容
,反应后生成溶液的比热容 ,反应过程中测得体系温度升高
,反应过程中测得体系温度升高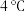 ,则该反应放出
,则该反应放出_______  热量。
热量。
Ⅱ.简易原电池反应。
(3)培养皿内装有含 饱和溶液的琼脂,再滴入5~6滴酚酞溶液和
饱和溶液的琼脂,再滴入5~6滴酚酞溶液和 溶液,混合均匀,铁钉用砂纸磨光,缠上铜丝放入培养皿中。一段时间后,可观察到没有缠铜丝的铁钉附近产生蓝色的
溶液,混合均匀,铁钉用砂纸磨光,缠上铜丝放入培养皿中。一段时间后,可观察到没有缠铜丝的铁钉附近产生蓝色的_______ (填化学式)沉淀;铜丝周围的现象是_______ ,发生的电极反应式为_______ 。

Ⅲ.某同学用中和滴定法测定某烧碱溶液的浓度。
(4)实验步骤:用图1中仪器_______ (填“A”或“B”)取待测烧碱溶液 于锥形瓶中,滴加2滴酚酞作指示剂。记录盛装
于锥形瓶中,滴加2滴酚酞作指示剂。记录盛装 盐酸标准溶液的酸式滴定管的初始读数。如果某时刻液面位置如图2所示,则此时的读数为
盐酸标准溶液的酸式滴定管的初始读数。如果某时刻液面位置如图2所示,则此时的读数为_______  。
。

(5)滴定。滴定过程中,眼睛应始终注视锥形瓶内溶液颜色变化,滴定终点的现象是_______ 。
(6)数据记录与处理
计算该烧碱溶液的浓度
_______  (精确到小数点后4位)。
(精确到小数点后4位)。
(7)误差分析。以下操作会导致测定结果偏高的是_______(填字母)。
Ⅰ.中和反应反应热的测定。
测定
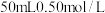 盐酸和
盐酸和 溶液中和反应时放出的热量。
溶液中和反应时放出的热量。(1)采用稍过量的
 溶液的原因是
溶液的原因是(2)若两种溶液的密度均为
 ,反应后生成溶液的比热容
,反应后生成溶液的比热容 ,反应过程中测得体系温度升高
,反应过程中测得体系温度升高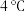 ,则该反应放出
,则该反应放出 热量。
热量。Ⅱ.简易原电池反应。
(3)培养皿内装有含
 饱和溶液的琼脂,再滴入5~6滴酚酞溶液和
饱和溶液的琼脂,再滴入5~6滴酚酞溶液和 溶液,混合均匀,铁钉用砂纸磨光,缠上铜丝放入培养皿中。一段时间后,可观察到没有缠铜丝的铁钉附近产生蓝色的
溶液,混合均匀,铁钉用砂纸磨光,缠上铜丝放入培养皿中。一段时间后,可观察到没有缠铜丝的铁钉附近产生蓝色的
Ⅲ.某同学用中和滴定法测定某烧碱溶液的浓度。
(4)实验步骤:用图1中仪器
 于锥形瓶中,滴加2滴酚酞作指示剂。记录盛装
于锥形瓶中,滴加2滴酚酞作指示剂。记录盛装 盐酸标准溶液的酸式滴定管的初始读数。如果某时刻液面位置如图2所示,则此时的读数为
盐酸标准溶液的酸式滴定管的初始读数。如果某时刻液面位置如图2所示,则此时的读数为 。
。
(5)滴定。滴定过程中,眼睛应始终注视锥形瓶内溶液颜色变化,滴定终点的现象是
(6)数据记录与处理
| 实验编号 | 烧碱待测液体 | 盐酸标准液体积(消耗) |
| 1 | 25.00 | 18.05 |
| 2 | 25.00 | 18.00 |
| 3 | 25.00 | 17.95 |
| 4 | 25.00 | 18.95 |
计算该烧碱溶液的浓度

 (精确到小数点后4位)。
(精确到小数点后4位)。(7)误差分析。以下操作会导致测定结果偏高的是_______(填字母)。
| A.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 |
| B.装待测液前,锥形瓶中有少量蒸馏水 |
| C.未用盐酸标准溶液润洗滴定管 |
| D.观察读数时,滴定前仰视,滴定后俯视 |
您最近一年使用:0次
4 . 实验室常利用甲醛法测定 样品中氮的质量分数,其反应原理为:
样品中氮的质量分数,其反应原理为: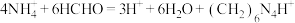 [滴定时,1 mol
[滴定时,1 mol 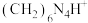 与1 mol
与1 mol  相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500 g。
步骤II:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III:移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①样品溶液用_______ (A.酸式滴定管B.碱式滴定管)来量取。
②碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数_______ (填“偏高”、“偏低”或“无影响”)。
③锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积_______ (填“偏大”、“偏小”或“无影响”)。
④滴定时边滴边摇动锥形瓶,眼睛应观察_______ 。
⑤滴定达到终点时,酚酞指示剂由_______ 色变成_______ 色。
(2)滴定结果如下表所示:
若NaOH标准溶液的浓度为0.1010 mol•L ,则该样品中氮的质量分数为
,则该样品中氮的质量分数为_______ 。(保留4位有效数字)
 样品中氮的质量分数,其反应原理为:
样品中氮的质量分数,其反应原理为: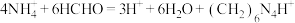 [滴定时,1 mol
[滴定时,1 mol 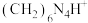 与1 mol
与1 mol  相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:步骤I:称取样品1.500 g。
步骤II:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III:移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①样品溶液用
②碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数
③锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积
④滴定时边滴边摇动锥形瓶,眼睛应观察
⑤滴定达到终点时,酚酞指示剂由
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
 ,则该样品中氮的质量分数为
,则该样品中氮的质量分数为
您最近一年使用:0次
10-11高二下·浙江杭州·阶段练习
名校
解题方法
5 . 下列是一段关于中和滴定的实验叙述,其中错误的是
①取一锥形瓶,用待测NaOH溶液润洗两次;
②在锥形瓶中放入25.00 mL待测NaOH溶液;
③加入几滴石蕊溶液作指示剂;
④取一支酸式滴定管,洗涤干净;
⑤直接往酸式滴定管中注入标准酸溶液,进行滴定;
⑥左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶;
⑦两眼注视着滴定管内盐酸液面下降,直至滴定终点.
①取一锥形瓶,用待测NaOH溶液润洗两次;
②在锥形瓶中放入25.00 mL待测NaOH溶液;
③加入几滴石蕊溶液作指示剂;
④取一支酸式滴定管,洗涤干净;
⑤直接往酸式滴定管中注入标准酸溶液,进行滴定;
⑥左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶;
⑦两眼注视着滴定管内盐酸液面下降,直至滴定终点.
| A.④⑥⑦ | B.①⑤⑥⑦ | C.③⑤⑦ | D.①③⑤⑦ |
您最近一年使用:0次
2023-01-12更新
|
852次组卷
|
23卷引用:甘肃省张掖市第二中学2019-2020学年高二上学期10月月考化学试题
甘肃省张掖市第二中学2019-2020学年高二上学期10月月考化学试题甘肃天祝藏族自治县第一中学2022-2023学年高二上学期1月期末考试化学试题(已下线)2010—2011届浙江省杭州市西湖高级中学高二4月月考化学试卷(已下线)2013届安徽省蚌埠二中高三12月月考化学试卷(已下线)2014秋广东省揭阳一中高二上学期期中考试(理)化学试卷2015-2016学年安徽省铜陵一中高二上期中测试化学试卷天津市静海区第四中学等四校2019-2020学年高二11月联考化学试题云南省福贡县一中2019-2020学年高二上学期期末考试化学试题湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题4 酸碱中和滴定(已下线)【南昌新东方】2019 南昌一中 高二上 第二次月考(已下线)易错15 酸碱中和滴定及应用-备战2021年高考化学一轮复习易错题(已下线)练习12 酸碱中和滴定-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)广西梧州市蒙山中学2020-2021学年高二下学期4月月考化学试题湖南省嘉禾县第一中学2021-2022学年高二上学期10月月考化学试题(已下线)3.2.2 pH计算和酸碱中和滴定-同步学习必备知识四川省成都市树德中学2022-2023学年高二上学期期末考试化学试题四川省凉山州宁南中学2022-2023学年高二上学期期末考试化学试题黑龙江省哈尔滨市德强学校2022-2023学年高二上学期期末考试化学试题内蒙古呼伦贝尔市满洲里市第一中学2022-2023学年高二下学期第一次月考化学试题第3课时 酸碱中和滴定作业(二十五) 酸碱中和滴定第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 第2课时 酸碱中和滴定【精品卷】3.2.3 酸碱中和滴定课堂例题-人教版2023-2024学年选择性必修1
6 . 工业上常用含钒炉渣(主要含FeO·V2O3,还有少量MnO、Al2O3、SiO2等杂质)提取V2O5,提取流程如图:

已知:V2O3难溶于水和碱,可溶于酸,灼烧可生成V2O5。
(1)为提高含钒炉渣的浸取率,可采取的措施为_______ 。
(2)“滤液1”中除了含有过量的NaOH外,还含有的溶质为_______ (填化学式)。
(3)灼烧的目的是将FeO·V2O3转化为可溶性NaVO3,写出该反应的化学方程式:_______ ;该过程中被氧化的元素是_______ (填元素符号)。
(4)“沉锰”时需将温度控制在70°C左右,温度不能过高的原因为_______ ;“滤渣2”的主要成分是MnCO3,写出生成MnCO3的离子方程式:_______ 。
(5)将V2O3溶于足量稀硫酸得到250mL (VO2)2SO4溶液。取25.00mL该溶液于锥形瓶中,用0.1000mol·L-1的Na2SO3标准溶液进行滴定,达到滴定终点时消耗标准溶液的体积为20.00mL。已知: 呈黄色、VO2+呈蓝色。
呈黄色、VO2+呈蓝色。
①该滴定实验不需要另外加入指示剂,达到滴定终点的颜色变化为_______ 。
②(VO2)2SO4溶液中溶质的物质的量浓度为_______ 。
③达到滴定终点时,俯视滴定管读数将使结果_______ (填“偏高”、“偏低”或“无影响”)。

已知:V2O3难溶于水和碱,可溶于酸,灼烧可生成V2O5。
(1)为提高含钒炉渣的浸取率,可采取的措施为
(2)“滤液1”中除了含有过量的NaOH外,还含有的溶质为
(3)灼烧的目的是将FeO·V2O3转化为可溶性NaVO3,写出该反应的化学方程式:
(4)“沉锰”时需将温度控制在70°C左右,温度不能过高的原因为
(5)将V2O3溶于足量稀硫酸得到250mL (VO2)2SO4溶液。取25.00mL该溶液于锥形瓶中,用0.1000mol·L-1的Na2SO3标准溶液进行滴定,达到滴定终点时消耗标准溶液的体积为20.00mL。已知:
 呈黄色、VO2+呈蓝色。
呈黄色、VO2+呈蓝色。①该滴定实验不需要另外加入指示剂,达到滴定终点的颜色变化为
②(VO2)2SO4溶液中溶质的物质的量浓度为
③达到滴定终点时,俯视滴定管读数将使结果
您最近一年使用:0次
名校
解题方法
7 . 25℃时,向20mL0.1mol/L 溶液中逐滴加入0.1mo/L NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法错误的是
溶液中逐滴加入0.1mo/L NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法错误的是

 溶液中逐滴加入0.1mo/L NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法错误的是
溶液中逐滴加入0.1mo/L NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法错误的是
| A.a点的pH>1 |
| B.c点时,V(NaOH)=20mL |
C.反应过程中 的值逐渐增大 的值逐渐增大 |
| D.a、b、c点溶液中,水的电离程度逐渐增大 |
您最近一年使用:0次
2022-07-10更新
|
1803次组卷
|
9卷引用:甘肃省兰州市第二中学2022-2023学年高二上学期期中考试化学试题
甘肃省兰州市第二中学2022-2023学年高二上学期期中考试化学试题四川省南充市2021-2022学年高二下学期期末考试化学试题(已下线)3.2.3 酸碱中和滴定-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)吉林省吉林松花江中学2022-2023学年高二上学期1月期末考试化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)黑龙江省鹤岗市第一中学2022-2023学年高二上学期11月期中考试化学试题宁夏吴忠中学2023-2024学年高二上学期11月期中考试化学试题(已下线)宁夏石嘴山市第三中学2023-2024学年高二上学期11月期中考试化学试题四川省遂宁市射洪中学校2023-2024学年高二上学期10月月考化学试题
名校
解题方法
8 . 苹果酸( )是应用广泛的植物酸味剂,某同学利用电位滴定法滴加0.18 mol·L-1的NaOH溶液以测定5.60mL苹果酸溶液中的苹果酸浓度。电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。滴定时电位滴定曲线如图所示。下列说法正确的是
)是应用广泛的植物酸味剂,某同学利用电位滴定法滴加0.18 mol·L-1的NaOH溶液以测定5.60mL苹果酸溶液中的苹果酸浓度。电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。滴定时电位滴定曲线如图所示。下列说法正确的是

(注:——表示电极电位曲线图;……示电极电压曲线图)
 )是应用广泛的植物酸味剂,某同学利用电位滴定法滴加0.18 mol·L-1的NaOH溶液以测定5.60mL苹果酸溶液中的苹果酸浓度。电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。滴定时电位滴定曲线如图所示。下列说法正确的是
)是应用广泛的植物酸味剂,某同学利用电位滴定法滴加0.18 mol·L-1的NaOH溶液以测定5.60mL苹果酸溶液中的苹果酸浓度。电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。滴定时电位滴定曲线如图所示。下列说法正确的是
(注:——表示电极电位曲线图;……示电极电压曲线图)
| A.该滴定过程中需加入甲基橙作指示剂 |
| B.b点溶液中c(H+)> c(OH-) |
C.原苹果酸溶液中c(C4H6O5)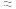 0.36 mol·L-1 0.36 mol·L-1 |
D.a点溶液中存在: c(OH- )+c(C4H6O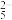 )=c(C4H6O5)+c(H+) )=c(C4H6O5)+c(H+) |
您最近一年使用:0次
名校
9 . 常温下,向 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,混合溶液的
溶液,混合溶液的 随所加
随所加 溶液体积的变化曲线如图所示(溶液体积的变化忽略不计)。下列说法中正确的是
溶液体积的变化曲线如图所示(溶液体积的变化忽略不计)。下列说法中正确的是

 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,混合溶液的
溶液,混合溶液的 随所加
随所加 溶液体积的变化曲线如图所示(溶液体积的变化忽略不计)。下列说法中正确的是
溶液体积的变化曲线如图所示(溶液体积的变化忽略不计)。下列说法中正确的是
A. 为一元强碱 为一元强碱 |
B.K点对应的溶液中: |
C.K点对应的溶液中: |
| D.N点水的电离程度小于K点水的电离程度 |
您最近一年使用:0次
2022-01-01更新
|
395次组卷
|
3卷引用:甘肃省临洮中学2021-2022学年高二下学期期中考试化学试题
名校
10 . 常温下用0.10 mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10)溶液所得滴定曲线如图。下列说法正确的是


| A.曲线I和曲线II分别代表的是CH3COOH和HCN |
| B.点③和点④所示溶液中由水电离出的c(H+): ③>④ |
C.点①和点②所示溶液中: |
D.在点②和③之间(不包括端点)存在关系: (A-代表溶液中的酸根离子) (A-代表溶液中的酸根离子) |
您最近一年使用:0次
2021-09-07更新
|
589次组卷
|
5卷引用:甘肃省嘉峪关市第一中学2021届高三下学期七模考试理综化学试题



