名校
解题方法
1 . 用NaOH标准溶液滴定食用白醋,测定其中醋酸含量的操作中正确的是
| A.盛白醋溶液的锥形瓶滴定前用白醋溶液润洗2~3次 |
| B.酸式滴定管在装液前要用白醋溶液润洗2~3次 |
| C.配标准溶液是称取4.0g NaOH固体放入1000mL容量瓶中,然后加水至刻度 |
| D.用甲基橙作指示剂,溶液恰好由红色变为黄色,为滴定终点 |
您最近一年使用:0次
2024-04-21更新
|
258次组卷
|
2卷引用:上海市延安中学2023-2024学年高二下学期期中考试 化学试卷(等级)
名校
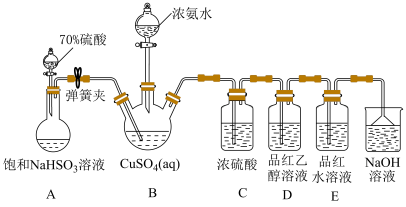
2 . NH4CuSO3(亚硫酸亚铜铵)是一种白色难溶于水、难溶于酒精的化工产品。某小组设计如下实验装置制备NH4CuSO3并探究SO2的漂白性。
ⅱ.然后向三颈烧瓶中通入SO2直至不再产生白色沉淀;
ⅲ.反应完毕后,将装置B中混合物过滤、酒精洗涤、干燥,即得成品。
已知:实验中还观察到装置D中溶液无明显现象,装置E中溶液红色褪去。
请回答下列问题:
(1)检查装置A气密性的操作方法为_____ 。
(2)装置C的目的是_____ 。
(3)实验步骤ⅱ中生成白色沉淀的离子方程式为_____ 。
(4)实验步骤ⅲ中用酒精替代水洗涤的优点是_____ 。
(5)为探究装置D、E中实验现象,化学兴趣小组对装置E中品红褪色的原因猜想如下:
猜想ⅰ:甲同学认为使品红褪色的微粒主要是 ;
;
猜想ⅱ:乙同学认为使品红褪色的微粒主要是 ;。
;。
为了验证猜想ⅰ和ⅱ,进行以下实验:
将10mL品红水溶液分成两份,在两份溶液中分别加入0.1mol·L-1的_____ 溶液(填化学式,下同)和0.1mol·L-1_____ 溶液,发现前者褪色快,后者褪色慢,说明上述猜想i比ⅱ合理。
(6)测定产品中 的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是
的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是_____ %(结果保留三位有效数字)。下列操作使测得的NH4CuSO3质量分数偏大的为_____ (填字母)。
a.滴定前仰视滴定管读数,滴定后读数正确
b.NaOH标准溶液使用前敞口放置于空气中一段时间
c.滴定结束读数时,发现滴定管尖嘴处还悬有一滴标准氢氧化钠溶液
d.用H2SO4溶液吸收NH3操作缓慢,导致部分NH3外逸到空气中
ⅱ.然后向三颈烧瓶中通入SO2直至不再产生白色沉淀;
ⅲ.反应完毕后,将装置B中混合物过滤、酒精洗涤、干燥,即得成品。
已知:实验中还观察到装置D中溶液无明显现象,装置E中溶液红色褪去。
请回答下列问题:
(1)检查装置A气密性的操作方法为
(2)装置C的目的是
(3)实验步骤ⅱ中生成白色沉淀的离子方程式为
(4)实验步骤ⅲ中用酒精替代水洗涤的优点是
(5)为探究装置D、E中实验现象,化学兴趣小组对装置E中品红褪色的原因猜想如下:
猜想ⅰ:甲同学认为使品红褪色的微粒主要是
 ;
;猜想ⅱ:乙同学认为使品红褪色的微粒主要是
 ;。
;。为了验证猜想ⅰ和ⅱ,进行以下实验:
将10mL品红水溶液分成两份,在两份溶液中分别加入0.1mol·L-1的
(6)测定产品中
 的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是
的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是a.滴定前仰视滴定管读数,滴定后读数正确
b.NaOH标准溶液使用前敞口放置于空气中一段时间
c.滴定结束读数时,发现滴定管尖嘴处还悬有一滴标准氢氧化钠溶液
d.用H2SO4溶液吸收NH3操作缓慢,导致部分NH3外逸到空气中
您最近一年使用:0次
名校
解题方法
3 . 化学是一门实验的科学,滴定法是化学上常用的定量分析的方法,有酸碱中和滴定、氧化还原滴定、沉淀滴定等。
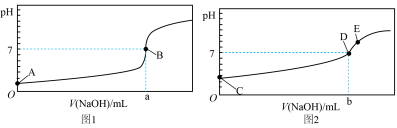
I.酸碱中和滴定:常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:________ (填“1”或“2”),滴加2~3滴________ 作指示剂(填“甲基橙”或“酚酞”)。
(2)达到B、D状态时,反应消耗NaOH溶液的体积a___________b(填编号)。
(3)A、B、C、E四点水的电离程度由大到小顺序为:E>________ 。
(4)某次用氢氧化钠滴定未知浓度的醋酸的滴定结果如表所示:
________ mL。
(5)下列操作中造成第2次所测测定结果明显偏差的是___________。
Ⅱ.氧化还原滴定:
如测定血液中钙的含量时,进行如下实验:
i.可将amL血液用蒸馏水稀释后,向其中加入足量草酸铵 晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。
晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。
ii.将i得到的H2C2O4溶液,再用KMnO4酸性溶液滴定,氧化产物为CO2,还原产物为 。
。
iii.终点时用去bmL 的KMnO4溶液。
的KMnO4溶液。
(6)写出用KMnO4酸性溶液滴定H2C2O4的离子方程式___________ 。
(7)如何判定滴定终点___________ 。
(8)计算:血液中含钙离子的浓度为___________ mol/L(用字母表示)。
Ⅲ.沉淀滴定法:
(9)用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。当溶液中
生成砖红色沉淀,指示到达滴定终点。当溶液中 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于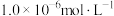 )时,溶液中
)时,溶液中 为
为___________  (已知
(已知 )。
)。
I.酸碱中和滴定:常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:
(2)达到B、D状态时,反应消耗NaOH溶液的体积a___________b(填编号)。
| A.> | B.< | C.= | D.不确定 |
(3)A、B、C、E四点水的电离程度由大到小顺序为:E>
(4)某次用氢氧化钠滴定未知浓度的醋酸的滴定结果如表所示:
| 滴定次数 | 待测液体积(mL) | 标准溶液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 1.02 | 18.97 |
| 2 | 20.00 | 0.60 | 见图 |
| 3 | 20.00 | 0.20 | 18.25 |

(5)下列操作中造成第2次所测测定结果明显偏差的是___________。
| A.盛放醋酸溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| B.配制标准溶液的固体NaOH中混有KOH杂质 |
| C.盛装NaOH标准溶液的滴定管在滴定前尖嘴处有气泡,滴定后气泡消失 |
| D.读取NaOH标准溶液的体积时,开始时仰视读数,滴定结束时俯视读数 |
Ⅱ.氧化还原滴定:
如测定血液中钙的含量时,进行如下实验:
i.可将amL血液用蒸馏水稀释后,向其中加入足量草酸铵
 晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。
晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。ii.将i得到的H2C2O4溶液,再用KMnO4酸性溶液滴定,氧化产物为CO2,还原产物为
 。
。iii.终点时用去bmL
 的KMnO4溶液。
的KMnO4溶液。(6)写出用KMnO4酸性溶液滴定H2C2O4的离子方程式
(7)如何判定滴定终点
(8)计算:血液中含钙离子的浓度为
Ⅲ.沉淀滴定法:
(9)用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中
 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。当溶液中
生成砖红色沉淀,指示到达滴定终点。当溶液中 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于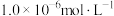 )时,溶液中
)时,溶液中 为
为 (已知
(已知 )。
)。
您最近一年使用:0次
2023-12-18更新
|
311次组卷
|
2卷引用:上海市七宝中学2023-2024学年高三上学期期中考试化学试题
2020·浙江·模拟预测
4 . 室温下,向20.00mL0.1000mol•L-1盐酸中滴加0.1000mol•L-1NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg5≈0.7。下列说法不正确的是
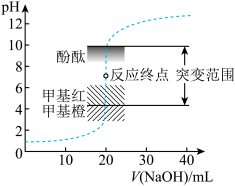
| A.NaOH与盐酸恰好完全反应时,pH=7 |
| B.选择变色范围在pH突变范围内的指示剂,可减小实验误差 |
| C.选择甲基红指示反应终点,误差比甲基橙的大 |
| D.V(NaOH)=30.00mL时,pH≈12.3 |
您最近一年使用:0次
2023-10-21更新
|
877次组卷
|
51卷引用:上海市华东政法大学附属中学2022-2023学年高二下学期期中考试(等级考)化学试题
上海市华东政法大学附属中学2022-2023学年高二下学期期中考试(等级考)化学试题(已下线)浙江省2020年1月选考(学考)化学试题2020年浙江省高考化学试卷(1月选考)浙江省丽水市松阳县第二中学2019-2020学年高二4月线上教学检测化学试题广东省化州市第一中学2019-2020学年高二4月线上统一测试化学试题江苏省启东中学2020-2021学年高二上学期第一次月考化学试题湖南省怀化市2020-2021学年高二上学期10月联考化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP409】【化学】(已下线)【浙江新东方】99(已下线)小题必刷31 酸碱中和滴定及拓展应用——2021年高考化学一轮复习小题必刷(通用版本)山东省济南市大学城实验高级中学2021届高三1月阶段性考试化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)广西贵港市覃塘区覃塘高级中学2020-2021学年高二下学期3月月考化学试题浙江省杭州市长征中学2020-2021学年高二下学期第二学期阶段性练习化学试题选择性必修1(SJ)专题3专题培优专练选择性必修1 专题3素养检测(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时41 酸碱中和滴定及拓展应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题3.2.2 酸碱中和滴定和pH的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)湖北省麻城市实验高级中学2021-2022学年高二上学期9月月考化学(B卷)试卷内蒙古鄂尔多斯市第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)3.2.2 酸碱中和滴定和pH的计算-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)专题14.水溶液中的离子平衡-十年(2012-2021)高考化学真题分项汇编(浙江专用)安徽师范大学附属中学2021-2022学年高二上学期期中考查化学试题浙江省浙北G2(湖州中学、嘉兴一中)2021-2022学年高二上学期期中联考化学试题(已下线)专题25 水的电离和溶液的酸碱性(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)内蒙古霍林郭勒市第一中学2021-2022学年高二上学期期中考试化学试题(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题18 酸碱混合图像为载体考查离子平衡-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)专题4 滴定终点专练(已下线)考点27 水的电离和溶液的pH-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第31练 水的电离和溶液的pH-2023年高考化学一轮复习小题多维练(全国通用)陕西省汉中中学2021-2022学年高二上学期第四次月考化学试题(已下线)第24讲 水的电离和溶液的pH(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第22讲 水的电离与溶液的pH(讲)-2023年高考化学一轮复习讲练测(新教材新高考)湖南省株洲市五雅中学2022-2023学年高二上学期11月期中考试化学试题 广西钦州市2022-2023学年高二上学期第2次教学质量监测化学试卷(已下线)题型133 酸碱中和滴定实验及误差分析(已下线)第八章 水溶液中的离子反应与平衡 第48练 酸碱中和反应及中和滴定(已下线)第12讲 酸碱中和滴定和氧化还原反应滴定-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)作业(十六) 酸碱中和滴定(已下线)考点27 水的电离与溶液的pH(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第3讲 酸碱中和滴定河北省衡水市第二中学2023-2024学年高三上学期学科素养评估(三调)化学试题【定心卷】3.2.3 酸碱中和滴定随堂练习-人教版2023-2024学年选择性必修1江苏省无锡市锡东高级中学2023-2024学年高二下学期期中考试化学试题天津市和平区2023-2024学年高三下学期第二次质量调查化学试卷
22-23高二下·上海浦东新·阶段练习
名校
5 . 有一份混有硫酸铵的摩尔盐(硫酸亚铁铵[ ,式量392])样品,某化学兴趣小组采用滴定法测定其纯度。主要步骤如下:
,式量392])样品,某化学兴趣小组采用滴定法测定其纯度。主要步骤如下:
①取5.000 g摩尔盐样品,配制成250 mL待测溶液;
②量取25.00 mL待测溶液于锥形瓶中;
③用酸化的 溶液滴定至终点,记录消耗
溶液滴定至终点,记录消耗 溶液体积。重复两次实验。
溶液体积。重复两次实验。
(1)配平离子方程式:_____ 。

(2)量取摩尔盐溶液可选择的量器是_______
(3)上述实验中的 溶液需要酸化,若用稀硝酸进行酸化,会使测定结果
溶液需要酸化,若用稀硝酸进行酸化,会使测定结果_______ (选填“偏大”、“偏小”、“不变”)。
(4)滴定终点的现象:_______ 。
进行了三次平行实验,将高锰酸钾标准溶液的体积读数记录如下

(5)第3次实验的终点时滴定管液面(局部)如图所示(背景为白底蓝线的滴定管)。则滴定管的读数为_______ mL,若将此溶液全部放出,放出液体的体积将_______ (选填“>”、“=”或“<”)读数对应的体积。
(6)根据以上数据计算该样品中摩尔盐的纯度为_______ (保留3位小数)。
(7)若样品中摩尔盐含量的真实值为0.800,则本次实验的相对误差为_______ (用百分数表示),造成误差的可能原因有_______
A.滴定管洗净后直接加入 溶液
溶液
B.滴定过程有少量样品溶液溅出
C.滴定前锥形瓶用蒸馏水洗涤后未干燥
D.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
E.某次实验时,初始仰视读数,末尾俯视读数
 ,式量392])样品,某化学兴趣小组采用滴定法测定其纯度。主要步骤如下:
,式量392])样品,某化学兴趣小组采用滴定法测定其纯度。主要步骤如下:①取5.000 g摩尔盐样品,配制成250 mL待测溶液;
②量取25.00 mL待测溶液于锥形瓶中;
③用酸化的
 溶液滴定至终点,记录消耗
溶液滴定至终点,记录消耗 溶液体积。重复两次实验。
溶液体积。重复两次实验。(1)配平离子方程式:

(2)量取摩尔盐溶液可选择的量器是_______
| A.滴定管 | B.量筒 | C.移液管 | D.锥形瓶 |
(3)上述实验中的
 溶液需要酸化,若用稀硝酸进行酸化,会使测定结果
溶液需要酸化,若用稀硝酸进行酸化,会使测定结果(4)滴定终点的现象:
进行了三次平行实验,将高锰酸钾标准溶液的体积读数记录如下
| 序号 | 初读数mL | 末读数mL |
| 1 | 0.40 | 19.84 |
| 2 | 1.20 | 20.70 |
| 3 | 0.00 |

(5)第3次实验的终点时滴定管液面(局部)如图所示(背景为白底蓝线的滴定管)。则滴定管的读数为
(6)根据以上数据计算该样品中摩尔盐的纯度为
(7)若样品中摩尔盐含量的真实值为0.800,则本次实验的相对误差为
A.滴定管洗净后直接加入
 溶液
溶液B.滴定过程有少量样品溶液溅出
C.滴定前锥形瓶用蒸馏水洗涤后未干燥
D.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
E.某次实验时,初始仰视读数,末尾俯视读数
您最近一年使用:0次
名校
解题方法
6 . 实验室欲测定某NaOH溶液的物质的量浓度,用0.1000mol·L-1HCl标准溶液进行中和滴定。
(1)该实验应选用___________ 作为指示剂。向25mL碱式滴定管中加入氢氧化钠溶液,开始时滴定管的读数为10.00mL,将滴定管中的液体全部放出,放出氢氧化钠溶液的体积为___________ (填“大于”“小于”或“等于”)15.00mL。该实验滴定至终点的现象为___________ 。
(2)甲同学记录滴定前滴定管内液面读数0.50mL,滴定后液面如图所示,则此时消耗标准溶液的体积为___________ 。

(3)由以下表格可知,3次滴定中,有一次滴定所用盐酸体积明显偏差,其可能的原因是___________。
(4)读取上述合理数据,计算出待测NaOH溶液的物质的量浓度为___________ 。(结果保留4位有效数字)
(1)该实验应选用
(2)甲同学记录滴定前滴定管内液面读数0.50mL,滴定后液面如图所示,则此时消耗标准溶液的体积为

(3)由以下表格可知,3次滴定中,有一次滴定所用盐酸体积明显偏差,其可能的原因是___________。
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 1.00 | 27.31 |
| A.锥形瓶用待测液润洗 | B.滴定过程中锥形瓶中溶液溅出瓶外 |
| C.滴定后滴定管尖嘴有气泡 | D.滴定结束时,平视读数 |
您最近一年使用:0次
22-23高二下·上海浦东新·期中
名校
解题方法
7 . 花儿实验小组欲用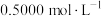 标准NaOH溶液测定未知浓度的
标准NaOH溶液测定未知浓度的 溶液,其操作分为如下几步:
溶液,其操作分为如下几步:
①用蒸馏水洗涤滴定管并验漏,再注入 标准NaOH溶液至“0”刻度线以上;
标准NaOH溶液至“0”刻度线以上;
②打开滴定管活塞放出少量液体,赶尽活塞下螺管内气泡使其充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④用洗净并润洗过的移液管量取20.00 mL待测液注入润洗过的锥形瓶中,并加入2滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数;
⑨重复以上滴定操作2~3次。
请回答下列问题:
(1)以上步骤有错误的是_______ (填序号)。
(2)滴定时,应采用如图所示操作中的_______ (填字母)来控制滴定管活塞。

(3)步骤⑤滴定时眼睛应注视_______ (填字母);
a.滴定管中液面高度变化 b.锥形瓶中溶液颜色变化
(4)到达滴定终点的现象是_______ 。
以下是实验数据记录表:
(5)根据表中数据计算该 溶液的物质的量浓度为
溶液的物质的量浓度为_______ mol/L(保留四位有效数字)。
(6)下列操作可能使所测 溶液的浓度偏高的是
溶液的浓度偏高的是_______ (填字母)。
A、锥形瓶装液前,留有少量蒸馏水
B、滴定管盛装标准液前未润洗
C、滴定前滴定管尖嘴有气泡,滴定结束无气泡
D、滴定过程中刚变色就立即停止滴定
E、接近滴定终点时滴定速度过快
F、滴定前平视读数,滴定后仰视读数
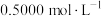 标准NaOH溶液测定未知浓度的
标准NaOH溶液测定未知浓度的 溶液,其操作分为如下几步:
溶液,其操作分为如下几步:①用蒸馏水洗涤滴定管并验漏,再注入
 标准NaOH溶液至“0”刻度线以上;
标准NaOH溶液至“0”刻度线以上;②打开滴定管活塞放出少量液体,赶尽活塞下螺管内气泡使其充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④用洗净并润洗过的移液管量取20.00 mL待测液注入润洗过的锥形瓶中,并加入2滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数;
⑨重复以上滴定操作2~3次。
请回答下列问题:
(1)以上步骤有错误的是
(2)滴定时,应采用如图所示操作中的

(3)步骤⑤滴定时眼睛应注视
a.滴定管中液面高度变化 b.锥形瓶中溶液颜色变化
(4)到达滴定终点的现象是
以下是实验数据记录表:
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 2.20 | 18.41 |
| 3 | 20.00 | 2.00 | 18.17 |
 溶液的物质的量浓度为
溶液的物质的量浓度为(6)下列操作可能使所测
 溶液的浓度偏高的是
溶液的浓度偏高的是A、锥形瓶装液前,留有少量蒸馏水
B、滴定管盛装标准液前未润洗
C、滴定前滴定管尖嘴有气泡,滴定结束无气泡
D、滴定过程中刚变色就立即停止滴定
E、接近滴定终点时滴定速度过快
F、滴定前平视读数,滴定后仰视读数
您最近一年使用:0次
名校
8 . 定量实验是根据样品的分析要求选择适当的分析方法,设计合理的方案并实施得到准确的实验结果。酸碱中和滴定就是一种非常精确的定量实验。某化学兴趣小组用0.1000mol•L-1NaOH标准溶液滴定食用白醋,测定白醋中醋酸的含量(g/100mL),并判断白醋的等级。已知:
(1)取100mL白醋样品溶于水,加水稀释配成1000mL溶液。准确量取25.00mL所酸白醋溶液放入锥形瓶中,可用于准确量取白醋溶液的仪器是______ 。
(2)滴加2~3滴______ 作指示剂(填“甲基橙”或“酚酞”)。若选择另外一种指示剂,则测定结果______ (填“偏高”、“偏低”或“不影响”)。
(3)判断滴定终点的现象为______ 。
(4)滴定结果如表所示:

表中缺少的读数为______ 。
(5)下列操作中可造成第2次所测测定结果明显偏差的是______ (填编号)。
①盛放白醋溶液的锥形瓶用蒸馏水洗净后没有干燥
②配制标准溶液的固体NaOH中混有KOH杂质
③盛装NaOH标准溶液的滴定管在滴定前尖嘴处有气泡,滴定后气泡消失
④读取NaOH标准溶液的体积时,开始时仰视读数,滴定结束时俯视读数
(6)通过计算可知该白醋中醋酸的含量为______ g/100mL(保留两位小数),该白醋的级别为______ 。
(7)甲胺(CH3NH2)的性质与氨相似,写出甲胺溶于水并发生电离的方程式______ 。25℃时,实验室里用0.1mol•L-1的盐酸溶液滴定20mL0.1mol•L-1甲胺溶液,滴定曲线如图所示。(已知:AG=lg[ ]),下列说法正确的是
]),下列说法正确的是______ (填编号)。

①c点溶液恰好中和
②水的电离程度:d>c>b>a
③Kb(CH3NH2·H2O)=1×10-5
④b点溶液中存在:[H+]-[OH-]=[CH3NH2·H2O]-[CH3NH ]
]
| 级别 | 优质醋 | 一级醋 | 二级醋 |
| 醋酸含量(g/100mL) | >6.0 | >4.5 | >3.5 |
(2)滴加2~3滴
(3)判断滴定终点的现象为
(4)滴定结果如表所示:
| 滴定次数 | 待测液体积(mL) | 标准溶液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 25.00 | 1.02 | 18.97 |
| 2 | 25.00 | 0.60 | 见图 |
| 3 | 25.00 | 0.20 | 18.25 |

表中缺少的读数为
(5)下列操作中可造成第2次所测测定结果明显偏差的是
①盛放白醋溶液的锥形瓶用蒸馏水洗净后没有干燥
②配制标准溶液的固体NaOH中混有KOH杂质
③盛装NaOH标准溶液的滴定管在滴定前尖嘴处有气泡,滴定后气泡消失
④读取NaOH标准溶液的体积时,开始时仰视读数,滴定结束时俯视读数
(6)通过计算可知该白醋中醋酸的含量为
(7)甲胺(CH3NH2)的性质与氨相似,写出甲胺溶于水并发生电离的方程式
 ]),下列说法正确的是
]),下列说法正确的是
①c点溶液恰好中和
②水的电离程度:d>c>b>a
③Kb(CH3NH2·H2O)=1×10-5
④b点溶液中存在:[H+]-[OH-]=[CH3NH2·H2O]-[CH3NH
 ]
]
您最近一年使用:0次
名校
解题方法
9 . I.同学们用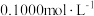 的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为
的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为 。
。
(1)到达滴定终点时溶液颜色变化为_______ 。
(2)用滴定管量取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性 标准溶液体积如下表所示:
标准溶液体积如下表所示:
则试样中过氧化氢的浓度为_______  。(保留四位小数)
。(保留四位小数)
(3)若盛装待测过氧化氢溶液的滴定管用蒸馏水洗后没有润洗,则测定结果_______ (填“偏高”或“偏低”或“不变”)。
Ⅱ.菱锰矿又称红纹石,其主要成分为 ,还含有
,还含有 、
、 、
、 等杂质。工业上用菱锰矿制取
等杂质。工业上用菱锰矿制取 的流程如图所示:
的流程如图所示:

已知:常温下,① 、
、 ;
;
②部分正离子开始沉淀和完全沉淀时的pH如表所示:
(4)酸浸时是否可用盐酸代替硫酸_______ (填“是”或“否”),原因是_______ (答出两点即可)。
(5)写出沉淀池1中加入 时发生反应的离子方程式:
时发生反应的离子方程式:_______ 。
(6)沉淀2的主要成分是_______ ,加入氨水的目的是_______ ,当沉淀2完全沉淀时
_______ 。
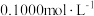 的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为
的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为 。
。(1)到达滴定终点时溶液颜色变化为
(2)用滴定管量取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性
 标准溶液体积如下表所示:
标准溶液体积如下表所示:| 第一次 | 第二次 | 第三次 | 第四次 | |
体积 | 17.10 | 18.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为
 。(保留四位小数)
。(保留四位小数)(3)若盛装待测过氧化氢溶液的滴定管用蒸馏水洗后没有润洗,则测定结果
Ⅱ.菱锰矿又称红纹石,其主要成分为
 ,还含有
,还含有 、
、 、
、 等杂质。工业上用菱锰矿制取
等杂质。工业上用菱锰矿制取 的流程如图所示:
的流程如图所示:
已知:常温下,①
 、
、 ;
;②部分正离子开始沉淀和完全沉淀时的pH如表所示:
| 金属离子 |  |  |  |  |  |
| 开始沉淀时的pH | 6.3 | 1.5 | 7.6 | 9.6 | 11.5 |
| 完全沉淀时的pH | 8.3 | 3.2 | 10.4 | 11.6 | 13.8 |
(5)写出沉淀池1中加入
 时发生反应的离子方程式:
时发生反应的离子方程式:(6)沉淀2的主要成分是

您最近一年使用:0次
解题方法
10 . 下列实验基本操作错误的是
| A.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2~3次 |
| B.硫酸铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅 |
| C.滴定时,左手控制活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| D.配制0.1 mol·L-1 H2SO4溶液时,将浓H2SO4沿杯壁倒入加有水的烧杯中稀释 |
您最近一年使用:0次



