解题方法
1 . 研究有机物的结构和性质对生产生活意义深远。回答下列问题:
(1)(CH3)2C(C2H5)CH(CH3)2的系统命名是___________ 。
(2)已知常温下CH3COOH和ClCH2COOH的电离平衡常数分别为Ka1、Ka2,Ka1___________ Ka2 (填“>”、“=”或“<”),理由是___________ 。
(3)Z是合成药物帕罗西汀的重要中间体。由X合成Z的路线如下:

Z的分子式为___________ ;Z中含氧官能团的名称为___________ ;下列说法错误的是___________ (填标号)。
A.X属于芳香烃
B.Y、Z均含有2个手性碳原子
C.X→Y过程中,X中碳碳双键的π键发生断裂
D.X分子中所有原子可能共平面
(1)(CH3)2C(C2H5)CH(CH3)2的系统命名是
(2)已知常温下CH3COOH和ClCH2COOH的电离平衡常数分别为Ka1、Ka2,Ka1
(3)Z是合成药物帕罗西汀的重要中间体。由X合成Z的路线如下:

Z的分子式为
A.X属于芳香烃
B.Y、Z均含有2个手性碳原子
C.X→Y过程中,X中碳碳双键的π键发生断裂
D.X分子中所有原子可能共平面
您最近一年使用:0次
2 . 阅读如下资料:
i.乙烯可在加热条件下催化氧化制得环氧乙烷( );具有强穿透力的环氧乙烷在常温下能杀灭微生物。
);具有强穿透力的环氧乙烷在常温下能杀灭微生物。
ii.环氧乙烷与水在加压、加热的条件下化合为乙二醇;乙二醇的熔点为-12.9℃,沸点197.3℃;能与水、丙酮等互溶。
iii.汽车铝制水箱(即散热器)中盛装的某防冻液(乙二醇与水是主要成分,体积比约1:1),沸点为108℃,冰点为-38℃;其中常加入适量NaH2PO4,用来消除水箱中严生的碱性水垢,从而提高散热效果。
iv.25℃ H3PO4Ka1=6.9×10-3,Ka2=6.2×10-8,Ka3=4.8×10-13。
结合题干信息,请按要求回答下列问题:
(1)环氧乙烷的分子式:____ ,其含有的官能团名称:____ 。
(2)乙二醇能与丙酮互溶的原因可能是乙二醇与丙酮都是极性分子,符合“相似相溶”的规律,还可能是____ 。
(3)结合ii、iii、iv中数据信息解释如下问题。
①NaH2PO4能除水垢的原因为____ ;故NaH2PO4水溶液显弱酸性,可消除碱性水垢。
②防冻液在使用一段时间后pH会降低的可能原因为____ 。
(4)结合已学知识及i、ii中信息,将如下两种合成乙二醇的路线补充完整(方框内填有机产物,箭头上填无机试剂及其反应条件)
①CH2=CH2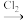
 →CH2OHCH2OH
→CH2OHCH2OH____
②CH2=CH2→ →CH2OHCH2OH
→CH2OHCH2OH____
生产乙二醇常采用路线②而不采用路线①,其可能原因(写出一种)是____ 。
i.乙烯可在加热条件下催化氧化制得环氧乙烷(
 );具有强穿透力的环氧乙烷在常温下能杀灭微生物。
);具有强穿透力的环氧乙烷在常温下能杀灭微生物。ii.环氧乙烷与水在加压、加热的条件下化合为乙二醇;乙二醇的熔点为-12.9℃,沸点197.3℃;能与水、丙酮等互溶。
iii.汽车铝制水箱(即散热器)中盛装的某防冻液(乙二醇与水是主要成分,体积比约1:1),沸点为108℃,冰点为-38℃;其中常加入适量NaH2PO4,用来消除水箱中严生的碱性水垢,从而提高散热效果。
iv.25℃ H3PO4Ka1=6.9×10-3,Ka2=6.2×10-8,Ka3=4.8×10-13。
结合题干信息,请按要求回答下列问题:
(1)环氧乙烷的分子式:
(2)乙二醇能与丙酮互溶的原因可能是乙二醇与丙酮都是极性分子,符合“相似相溶”的规律,还可能是
(3)结合ii、iii、iv中数据信息解释如下问题。
①NaH2PO4能除水垢的原因为
②防冻液在使用一段时间后pH会降低的可能原因为
(4)结合已学知识及i、ii中信息,将如下两种合成乙二醇的路线补充完整(方框内填有机产物,箭头上填无机试剂及其反应条件)
①CH2=CH2
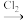
 →CH2OHCH2OH
→CH2OHCH2OH②CH2=CH2→
 →CH2OHCH2OH
→CH2OHCH2OH生产乙二醇常采用路线②而不采用路线①,其可能原因(写出一种)是
您最近一年使用:0次
2022-03-13更新
|
184次组卷
|
2卷引用:天津市河西区2021-2022学年高三上学期期末考试 化学试题
解题方法
3 . Ⅰ.碘化钾常用作合成有机化合物的原料。某实验小组设计实验探究KI的还原性。
(1)探究不同条件下空气中氧气氧化KI的速率。
①酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为_______ 。
②设计实验组别3的目的是_______ 。
(2)探究反应“2Fe3++2I-=2Fe2++I2”为可逆反应。
试剂:0.01 mol/LKI溶液,0.005 mol/LFe2(SO4)3溶液,淀粉溶液,0.01 mol/LAgNO3溶液,KSCN溶液。实验如图:

①甲同学通过试管ⅰ和试管ⅱ中现象结合可证明该反应为可逆反应,则试管ⅰ中现象为:_______ ;乙同学认为该现象无法证明该反应为可逆反应,原因为:_______ 。
②请选择上述试剂重新设计实验,证明该反应为可逆反应:_______ 。
Ⅱ.次磷酸(H3PO2)是一种精细化工产品,已知10 mL1 mol/LH3PO2与20 mL1 mol/L的NaOH溶液充分反应后生成组成为NaH2PO2的盐,则:
(3)NaH2PO2属于_______ (填“正盐”“酸式盐”或“无法确定”)。
(4)设计实验方案,证明次磷酸是弱酸:_______ 。
(1)探究不同条件下空气中氧气氧化KI的速率。
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 蒸馏水 | 淀粉溶液 | ||
| c(KI) | V | c(H2SO4) | V | ||||
| 1 | 298 K | 0.1 mol/L | 5 mL | 0.1 mol/L | 5 mL | 10 mL | 3滴 |
| 2 | 313 K | 0.1 mol/L | 5 mL | 0.1 mol/L | 5 mL | 10 mL | 3滴 |
| 3 | 298 K | 0.1 mol/L | 10 mL | 0.1 mol/L | 5 mL | 5 mL | 3滴 |
②设计实验组别3的目的是
(2)探究反应“2Fe3++2I-=2Fe2++I2”为可逆反应。
试剂:0.01 mol/LKI溶液,0.005 mol/LFe2(SO4)3溶液,淀粉溶液,0.01 mol/LAgNO3溶液,KSCN溶液。实验如图:

①甲同学通过试管ⅰ和试管ⅱ中现象结合可证明该反应为可逆反应,则试管ⅰ中现象为:
②请选择上述试剂重新设计实验,证明该反应为可逆反应:
Ⅱ.次磷酸(H3PO2)是一种精细化工产品,已知10 mL1 mol/LH3PO2与20 mL1 mol/L的NaOH溶液充分反应后生成组成为NaH2PO2的盐,则:
(3)NaH2PO2属于
(4)设计实验方案,证明次磷酸是弱酸:
您最近一年使用:0次
名校
4 . 如何实现环境保护与资源利用的和谐统一,已成为我们的重要研究课题。
(1)工业上利用 和
和 可以合成NH3,NH3又可以进一步制备火箭燃料肼(N2H4)。
可以合成NH3,NH3又可以进一步制备火箭燃料肼(N2H4)。
①
②
③
气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式为___________ 。
(2) 的水溶液呈弱碱性,室温下其电离常数
的水溶液呈弱碱性,室温下其电离常数 ,则
,则 的
的 水溶液
水溶液 约为
约为___________ (忽略 的二级电离和
的二级电离和 的电离,
的电离, )。
)。
(3)利用测压法在刚性密闭容器中研究 时
时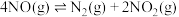 的分解反应,现将一定量的
的分解反应,现将一定量的 充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
① 时,
时,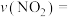
___________  。
。
② 时,该反应的平衡常数
时,该反应的平衡常数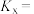
___________ (提示: 为以物质的量分数表示的平衡常数)。
为以物质的量分数表示的平衡常数)。
(4)将等物质的量的 和
和 分别充入盛有催化剂①和②的体积相同的刚性容器,进行反应
分别充入盛有催化剂①和②的体积相同的刚性容器,进行反应 ,经过相同时间测得
,经过相同时间测得 的转化率如图所示,图中
的转化率如图所示,图中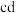 段转化率下降的可能原因是(答2条)
段转化率下降的可能原因是(答2条)___________ 。

(5)工业上常采用的耦合技术指的是在一套设备中同时进行多单元生成操作,从而使流程和设备简化,反应能耗降低,获得更大产品收率。我国科学家设计了 与氯碱耦合电解池装置如图(图中物质只表示电极上的反应)。
与氯碱耦合电解池装置如图(图中物质只表示电极上的反应)。

①该装置中的离子交换膜为___________ (填“阴”或“阳”)离子交换膜。
②该电解池发生的阴极反应的化学方程式为___________ 。
(1)工业上利用
 和
和 可以合成NH3,NH3又可以进一步制备火箭燃料肼(N2H4)。
可以合成NH3,NH3又可以进一步制备火箭燃料肼(N2H4)。①

②

③

气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式为
(2)
 的水溶液呈弱碱性,室温下其电离常数
的水溶液呈弱碱性,室温下其电离常数 ,则
,则 的
的 水溶液
水溶液 约为
约为 的二级电离和
的二级电离和 的电离,
的电离, )。
)。(3)利用测压法在刚性密闭容器中研究
 时
时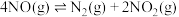 的分解反应,现将一定量的
的分解反应,现将一定量的 充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:| 反应时间/min | 0 | 10 | 20 | 30 | 40 |
| 压强/MPa | 15.00 | 14.00 | 13.20 | 12.50 | 12.50 |
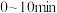 时,
时,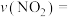
 。
。②
 时,该反应的平衡常数
时,该反应的平衡常数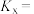
 为以物质的量分数表示的平衡常数)。
为以物质的量分数表示的平衡常数)。(4)将等物质的量的
 和
和 分别充入盛有催化剂①和②的体积相同的刚性容器,进行反应
分别充入盛有催化剂①和②的体积相同的刚性容器,进行反应 ,经过相同时间测得
,经过相同时间测得 的转化率如图所示,图中
的转化率如图所示,图中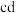 段转化率下降的可能原因是(答2条)
段转化率下降的可能原因是(答2条)
(5)工业上常采用的耦合技术指的是在一套设备中同时进行多单元生成操作,从而使流程和设备简化,反应能耗降低,获得更大产品收率。我国科学家设计了
 与氯碱耦合电解池装置如图(图中物质只表示电极上的反应)。
与氯碱耦合电解池装置如图(图中物质只表示电极上的反应)。
①该装置中的离子交换膜为
②该电解池发生的阴极反应的化学方程式为
您最近一年使用:0次
5 . 我国向国际社会承诺2030年前实现“碳达峰”,2060年前实现“碳中和”,对温室气体二氧化碳的处理是化学工作者实现“碳中和”重点研究的课题。
(1)合成尿素[ ]是利用
]是利用 的途径之一、尿素合成主要通过反应
的途径之一、尿素合成主要通过反应
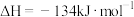 实现,该反应自发进行的条件是
实现,该反应自发进行的条件是_______ 。(填“低温”“高温”或“任意温度”)。
(2)工业上以 和
和 为原料可制备合成气(
为原料可制备合成气(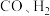 ),已知
),已知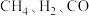 的燃烧热分别为
的燃烧热分别为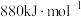 、
、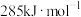 、
、 ,则反应
,则反应

_____ 。
若该反应的 ,
,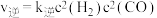 (
( 、
、 为速率常数,只与温度有关),平衡后降低温度,则
为速率常数,只与温度有关),平衡后降低温度,则
____ (填“增大”“不变”或“减小”)。
(3) 也可通过催化加氢合成乙醇,其反应为
也可通过催化加氢合成乙醇,其反应为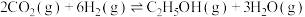
 。设
。设 为起始时的投料比,即
为起始时的投料比,即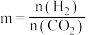 。通过实验得到如图所示图像:
。通过实验得到如图所示图像:
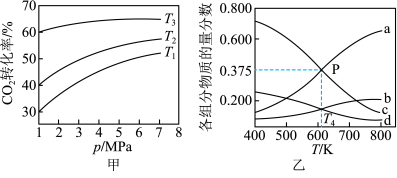
①恒温恒容条件下发生上述反应,下列现象能说明反应达到平衡的是_____ 。
A. B.断裂
B.断裂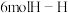 键的同时断裂
键的同时断裂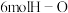 键
键
C.反应的温度保持不变 D.气体的总物质的量保持不变
②图甲中投料比相同,温度最低的是_____ ,原因是_____ 。
③图乙表示在 时,起始压强为
时,起始压强为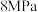 的恒容条件下,平衡状态时各物质的物质的量分数与温度的关系,
的恒容条件下,平衡状态时各物质的物质的量分数与温度的关系, 温度时,该反应的压强平衡常数
温度时,该反应的压强平衡常数
_____ 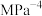 (用平衡分压代替平衡浓度计算,分压=总压
(用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
④生成的乙醇可用于燃料电池,请写出以 为电极,熔融的
为电极,熔融的 为电解液的乙醇燃料电池的负极电极反应:
为电解液的乙醇燃料电池的负极电极反应:_____ 。
(4)天然水体中的 与空气中的
与空气中的 保持平衡。已知
保持平衡。已知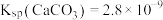 ,某溶洞水体中
,某溶洞水体中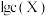 (X为
(X为 、
、 、
、 或
或 )与
)与 的关系如图所示。
的关系如图所示。
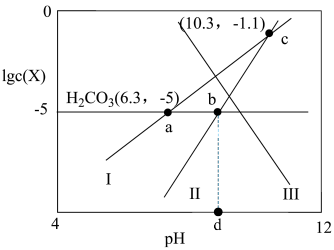
下列说法正确的是
①曲线Ⅲ代表______ (填“ ”“
”“ ”“
”“ ”或“
”或“ ”)。
”)。
② 时,
时,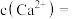
________ 。
③ 的值为
的值为_______ (填具体数字)。
(1)合成尿素[
 ]是利用
]是利用 的途径之一、尿素合成主要通过反应
的途径之一、尿素合成主要通过反应
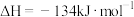 实现,该反应自发进行的条件是
实现,该反应自发进行的条件是(2)工业上以
 和
和 为原料可制备合成气(
为原料可制备合成气(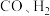 ),已知
),已知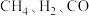 的燃烧热分别为
的燃烧热分别为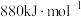 、
、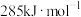 、
、 ,则反应
,则反应

若该反应的
 ,
,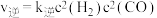 (
( 、
、 为速率常数,只与温度有关),平衡后降低温度,则
为速率常数,只与温度有关),平衡后降低温度,则
(3)
 也可通过催化加氢合成乙醇,其反应为
也可通过催化加氢合成乙醇,其反应为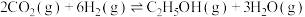
 。设
。设 为起始时的投料比,即
为起始时的投料比,即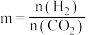 。通过实验得到如图所示图像:
。通过实验得到如图所示图像:
①恒温恒容条件下发生上述反应,下列现象能说明反应达到平衡的是
A.
 B.断裂
B.断裂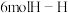 键的同时断裂
键的同时断裂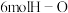 键
键C.反应的温度保持不变 D.气体的总物质的量保持不变
②图甲中投料比相同,温度最低的是
③图乙表示在
 时,起始压强为
时,起始压强为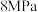 的恒容条件下,平衡状态时各物质的物质的量分数与温度的关系,
的恒容条件下,平衡状态时各物质的物质的量分数与温度的关系, 温度时,该反应的压强平衡常数
温度时,该反应的压强平衡常数
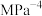 (用平衡分压代替平衡浓度计算,分压=总压
(用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。④生成的乙醇可用于燃料电池,请写出以
 为电极,熔融的
为电极,熔融的 为电解液的乙醇燃料电池的负极电极反应:
为电解液的乙醇燃料电池的负极电极反应:(4)天然水体中的
 与空气中的
与空气中的 保持平衡。已知
保持平衡。已知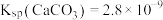 ,某溶洞水体中
,某溶洞水体中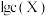 (X为
(X为 、
、 、
、 或
或 )与
)与 的关系如图所示。
的关系如图所示。
下列说法正确的是
①曲线Ⅲ代表
 ”“
”“ ”“
”“ ”或“
”或“ ”)。
”)。②
 时,
时,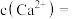
③
 的值为
的值为
您最近一年使用:0次
名校
6 . 非金属元素及位于金属、非金属分界线附近的元素在生活中发挥着十分重要的作用。回答下列问题:
(1)联氨是一种应用广泛的化工原料,分子式为 ,是各种大型电厂锅炉循环用水的化学除氧剂,并具有很高的热值,可用作火箭和燃料电池的燃料。联氨在水中的电离方式与氨相似。联氨第一步电离反应的平衡常数为
,是各种大型电厂锅炉循环用水的化学除氧剂,并具有很高的热值,可用作火箭和燃料电池的燃料。联氨在水中的电离方式与氨相似。联氨第一步电离反应的平衡常数为___________ [已知: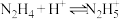 的
的 ;
; ]。联氨与硫酸形成的酸式盐的化学式为
]。联氨与硫酸形成的酸式盐的化学式为___________ 。
(2)氨是合成硝酸、铵盐和氮肥的基本原料。氨的水溶液呈弱碱性,其原因是___________ (用离子方程式表示),向 的氨水中加入少量的
的氨水中加入少量的 固体,溶液的
固体,溶液的
___________ (填“升高”或“降低”);若加入少量的明矾,溶液中 的浓度
的浓度___________ (填“增大”或“减小”)。
(3)已知下列酸的电离平衡常数数据( ):
):
① ,
, 的电离平衡常数为
的电离平衡常数为 ,则T
,则T___________ (填“>”“<”或“=”) 。保持温度不变,将该溶液加水稀释至
。保持温度不变,将该溶液加水稀释至 ,下列物理量增大的是
,下列物理量增大的是___________ (填字母)。
A. B.
B.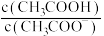 C.
C. D.电离度
D.电离度
② 是一元酸,其在水中的电离方程式为
是一元酸,其在水中的电离方程式为 。
。 的酸式电离与
的酸式电离与 类似,在水中电离生成
类似,在水中电离生成 ,写出
,写出 酸式电离的电离方程式:
酸式电离的电离方程式:___________ 。根据上表中的数据,写出 溶液与
溶液与 溶液反应的化学方程式:
溶液反应的化学方程式:___________ 。
(1)联氨是一种应用广泛的化工原料,分子式为
 ,是各种大型电厂锅炉循环用水的化学除氧剂,并具有很高的热值,可用作火箭和燃料电池的燃料。联氨在水中的电离方式与氨相似。联氨第一步电离反应的平衡常数为
,是各种大型电厂锅炉循环用水的化学除氧剂,并具有很高的热值,可用作火箭和燃料电池的燃料。联氨在水中的电离方式与氨相似。联氨第一步电离反应的平衡常数为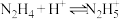 的
的 ;
; ]。联氨与硫酸形成的酸式盐的化学式为
]。联氨与硫酸形成的酸式盐的化学式为(2)氨是合成硝酸、铵盐和氮肥的基本原料。氨的水溶液呈弱碱性,其原因是
 的氨水中加入少量的
的氨水中加入少量的 固体,溶液的
固体,溶液的
 的浓度
的浓度(3)已知下列酸的电离平衡常数数据(
 ):
):| 酸 |  |  |  |  |  |
 |  |   |  | 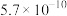 | 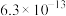 |
 ,
, 的电离平衡常数为
的电离平衡常数为 ,则T
,则T 。保持温度不变,将该溶液加水稀释至
。保持温度不变,将该溶液加水稀释至 ,下列物理量增大的是
,下列物理量增大的是A.
 B.
B.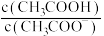 C.
C. D.电离度
D.电离度
②
 是一元酸,其在水中的电离方程式为
是一元酸,其在水中的电离方程式为 。
。 的酸式电离与
的酸式电离与 类似,在水中电离生成
类似,在水中电离生成 ,写出
,写出 酸式电离的电离方程式:
酸式电离的电离方程式: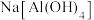 溶液与
溶液与 溶液反应的化学方程式:
溶液反应的化学方程式:
您最近一年使用:0次
名校
7 . 氮、磷元素的单质和它们的化合物用途广泛,与生产、生活有密切关系。请回答下列问题。
(1)下列属于氮的固定的是________ 。
a. 工业上N2和H2合成NH3 b. NH3催化氧化生成NO
c. N2和O2放电条件下生成NO d. NH3与灼热的氧化铜反应生成N2
(2)N2H4(联氨)可用作喷气式发动机推进剂、火箭燃料,可由次氯酸钠与氨反应制取,其化学反应方程式为_____________ 。
(3)三氟化氮( )是一种无色、无味的气体,是微电子工业技术的关键原料之一,
)是一种无色、无味的气体,是微电子工业技术的关键原料之一, 在潮湿的空气中与水蒸气能发生氧化还原反应,该反应的产物有:HF、NO和
在潮湿的空气中与水蒸气能发生氧化还原反应,该反应的产物有:HF、NO和 。
。
①写出该反应的化学方程式:___________ ,反应中生成0.2 mol  ,转移的电子数目为
,转移的电子数目为___________ ( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
② 无色、无臭,可一旦在空气中泄漏,却易于发现,判断该气体泄漏的现象是
无色、无臭,可一旦在空气中泄漏,却易于发现,判断该气体泄漏的现象是___________ 。
(4)Si3N4是一种性能优异的无机非金属材料,它的熔点高硬度大,电绝缘性好,化学性质稳定,但生产成本较高。根据以上描述推测Si3N4可能有哪些用途______ 。
a. 制作坩埚 b. 用作建筑陶瓷 c. 制作耐高温轴承 d. 制作切削刀具
(5)磷元素可以形成多种含氧酸。
①已知4.0g NaOH最多可中和100 mL 1mol·L−1 H3PO2溶液,则NaH2PO2是_________________ (填“正盐”或“酸式盐”)。
②已知常温下酸性:H3PO3 > CH3COOH > H2PO3-,则H3PO3与足量CH3COONa溶液混合的离子反应方程式为_____________ 。
(1)下列属于氮的固定的是
a. 工业上N2和H2合成NH3 b. NH3催化氧化生成NO
c. N2和O2放电条件下生成NO d. NH3与灼热的氧化铜反应生成N2
(2)N2H4(联氨)可用作喷气式发动机推进剂、火箭燃料,可由次氯酸钠与氨反应制取,其化学反应方程式为
(3)三氟化氮(
 )是一种无色、无味的气体,是微电子工业技术的关键原料之一,
)是一种无色、无味的气体,是微电子工业技术的关键原料之一, 在潮湿的空气中与水蒸气能发生氧化还原反应,该反应的产物有:HF、NO和
在潮湿的空气中与水蒸气能发生氧化还原反应,该反应的产物有:HF、NO和 。
。①写出该反应的化学方程式:
 ,转移的电子数目为
,转移的电子数目为 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。②
 无色、无臭,可一旦在空气中泄漏,却易于发现,判断该气体泄漏的现象是
无色、无臭,可一旦在空气中泄漏,却易于发现,判断该气体泄漏的现象是(4)Si3N4是一种性能优异的无机非金属材料,它的熔点高硬度大,电绝缘性好,化学性质稳定,但生产成本较高。根据以上描述推测Si3N4可能有哪些用途
a. 制作坩埚 b. 用作建筑陶瓷 c. 制作耐高温轴承 d. 制作切削刀具
(5)磷元素可以形成多种含氧酸。
①已知4.0g NaOH最多可中和100 mL 1mol·L−1 H3PO2溶液,则NaH2PO2是
②已知常温下酸性:H3PO3 > CH3COOH > H2PO3-,则H3PO3与足量CH3COONa溶液混合的离子反应方程式为
您最近一年使用:0次
8 . 甲醇是重要的化学工业基础原料和清洁液体燃料。现在工业上合成甲醇几乎全部采用 或CO2加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序。
或CO2加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序。
已知甲醇制备的有关化学反应以及不同温度下的化学平衡常数如下表所示:
(1)反应②是______ (填“吸热”或“放热”)
(2)某温度下反应①中H2的平衡转化率(α)与体系总压强(p)的关系如图所示,则平衡状态由A变到B时,平衡常数K(A)______ K(B)(填“>”、“<”或“=”)。根据反应①和②可推导K1、K2与K3之间的关系,则K3=______ (用K1、K2表示)

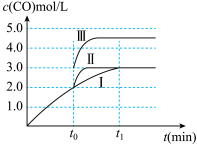
(3)在3L容积可变的密闭容器中仅发生反应②,已知c(CO)与反应时间t的变化曲线I如图所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ。当曲线I变为曲线Ⅱ时,改变的条件是______ 。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是______ 。
(4)一定条件下将 (g)和
(g)和 (g)以体积比3∶1置于恒温恒容的密闭容器发生反应③,下列能说明该反应达到平衡状态的有______
(g)以体积比3∶1置于恒温恒容的密闭容器发生反应③,下列能说明该反应达到平衡状态的有______
(5)一定条件下,甲醇与一氧化碳反应可以合成醋酸。通常状况下,将amol·L-1的醋酸与bmol·L-1Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为______ 。
 或CO2加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序。
或CO2加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序。已知甲醇制备的有关化学反应以及不同温度下的化学平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度/℃ | |
| 500 | 800 | ||
①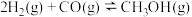 |  | 2.5 | 0.15 |
②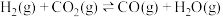 |  | 1.0 | 2.50 |
③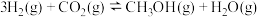 |  | ||
(1)反应②是
(2)某温度下反应①中H2的平衡转化率(α)与体系总压强(p)的关系如图所示,则平衡状态由A变到B时,平衡常数K(A)

(3)在3L容积可变的密闭容器中仅发生反应②,已知c(CO)与反应时间t的变化曲线I如图所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ。当曲线I变为曲线Ⅱ时,改变的条件是

(4)一定条件下将
 (g)和
(g)和 (g)以体积比3∶1置于恒温恒容的密闭容器发生反应③,下列能说明该反应达到平衡状态的有______
(g)以体积比3∶1置于恒温恒容的密闭容器发生反应③,下列能说明该反应达到平衡状态的有______| A.体系密度保持不变 |
B. 和 和 的体积比保持不变 的体积比保持不变 |
| C.混合气体的平均相对分子量不变时,反应一定达到平衡状态 |
D.当破坏 中2个碳氧双键,同时破坏 中2个碳氧双键,同时破坏 中的2个氧氢键,反应一定达到平衡状态 中的2个氧氢键,反应一定达到平衡状态 |
(5)一定条件下,甲醇与一氧化碳反应可以合成醋酸。通常状况下,将amol·L-1的醋酸与bmol·L-1Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为
您最近一年使用:0次
名校
9 . 硼及其化合物在生产中有广泛用途,硼和铝位于同主族,具有相似的化学性质。
(1)硼和氯气反应生成BCl3,在该分子中,硼原子最外层有___________ 个电子。
(2)NaBH4是有机合成中重要的还原剂。工业上合成方法之一是: ,在该反应中,氧化剂是
,在该反应中,氧化剂是___________ ,制备 时转移
时转移___________ mol电子。
(3)B(OH)3(硼酸)是一元弱酸,它在水中类似氨的电离: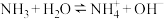 ,硼酸在水中电离的方程式为
,硼酸在水中电离的方程式为___________ 。
(4)过硼酸钠(NaBO3)是一种用途广泛的无机过氧化物,可用作织物的漂白、染色,医药上可作为消毒剂和杀菌剂。过硼酸钠的水溶液不稳定,极易生成偏硼酸钠(NaBO2)并放出氧气,写出该反应的化学方程式___________ 。
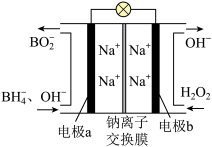
(5)以NaBH4和H2O2作原料的燃料电池,可用作空军通信卫星。电池负极材料采用Pt/C,正极材料采用MnO2,其工作原理如下图所示。下列说法错误的是___________。
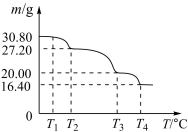
(6)过硼酸钠晶体( )可用作洗衣业的无氯漂白剂、清洗材料和牙齿增白剂,在70℃以上加热会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T3℃时所得固体的化学式为
)可用作洗衣业的无氯漂白剂、清洗材料和牙齿增白剂,在70℃以上加热会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T3℃时所得固体的化学式为___________ 。
(1)硼和氯气反应生成BCl3,在该分子中,硼原子最外层有
(2)NaBH4是有机合成中重要的还原剂。工业上合成方法之一是:
 ,在该反应中,氧化剂是
,在该反应中,氧化剂是 时转移
时转移(3)B(OH)3(硼酸)是一元弱酸,它在水中类似氨的电离:
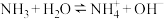 ,硼酸在水中电离的方程式为
,硼酸在水中电离的方程式为(4)过硼酸钠(NaBO3)是一种用途广泛的无机过氧化物,可用作织物的漂白、染色,医药上可作为消毒剂和杀菌剂。过硼酸钠的水溶液不稳定,极易生成偏硼酸钠(NaBO2)并放出氧气,写出该反应的化学方程式
(5)以NaBH4和H2O2作原料的燃料电池,可用作空军通信卫星。电池负极材料采用Pt/C,正极材料采用MnO2,其工作原理如下图所示。下列说法错误的是___________。

A.电池放电时 从a极区移向b极区 从a极区移向b极区 |
B.该电池a极的反应为 |
| C.电极b采用Pt/C,该极溶液的pH增大 |
D.电池总反应: |
(6)过硼酸钠晶体(
 )可用作洗衣业的无氯漂白剂、清洗材料和牙齿增白剂,在70℃以上加热会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T3℃时所得固体的化学式为
)可用作洗衣业的无氯漂白剂、清洗材料和牙齿增白剂,在70℃以上加热会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T3℃时所得固体的化学式为
您最近一年使用:0次
解题方法
10 . 工业上可由氢气、氮气合成氨气,溶于水形成氨水。盐酸和氨水是实验室常见的电解质溶液。一定温度下,向2L密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g) 2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。
2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。

(1)0~2min内的平均反应速率v(H2)=____ 。
(2)下列能说明合成氨反应已达到平衡状态的是____ (填字母)。(反应是在固定体积的密闭容器中进行的)
a.3v(N2)=v(H2) b.容器内压强保持不变
c.混合气体的密度保持不变 d.各组分浓度相等
常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如表。
请回答:
(3)①中所得混合溶液,pH____ 7(填“>”“<”或“=”)。
②中c___ 0.2(填“>”“<”或“=”),所得混合溶液中各离子浓度大小关系为____ 。
(4)请你再设计一个能证明一水合氨是弱电解质的方案____ 。
 2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。
2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。
(1)0~2min内的平均反应速率v(H2)=
(2)下列能说明合成氨反应已达到平衡状态的是
a.3v(N2)=v(H2) b.容器内压强保持不变
c.混合气体的密度保持不变 d.各组分浓度相等
常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如表。
| 实验编号 | 氨水浓度/mol•L-1 | 盐酸浓度/mol•L-1 | 混合溶液pH |
| ① | 0.2 | 0.2 | pH=x |
| ② | c | 0.2 | pH=7 |
请回答:
(3)①中所得混合溶液,pH
②中c
(4)请你再设计一个能证明一水合氨是弱电解质的方案
您最近一年使用:0次



