1 . 磷酸(H3PO4)、亚磷酸(H3PO3)和次磷酸(H3PO2)都是重要的化工产品。已知:1mol磷酸、亚磷酸、次磷酸最多消耗NaOH的物质的量依次为3mol、2mol、1mol。亚磷酸易溶于水和醇,加热到180℃时分解成磷酸和磷化氢 。经实验检测发现
。经实验检测发现 溶液显碱性。已知:25℃时
溶液显碱性。已知:25℃时 。常温下,用
。常温下,用 溶液滴定
溶液滴定 溶液的滴定曲线如图所示,下列说法正确的是
溶液的滴定曲线如图所示,下列说法正确的是
 。经实验检测发现
。经实验检测发现 溶液显碱性。已知:25℃时
溶液显碱性。已知:25℃时 。常温下,用
。常温下,用 溶液滴定
溶液滴定 溶液的滴定曲线如图所示,下列说法正确的是
溶液的滴定曲线如图所示,下列说法正确的是
A. 点加入氢氧化钠的体积 点加入氢氧化钠的体积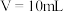 |
B.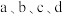 中, 中, 点水的电离程度最小 点水的电离程度最小 |
C. 点存在: 点存在: |
D. 点存在: 点存在: |
您最近一年使用:0次
2 . 7下表是醋酸电离常数与温度的关系。下列说法不正确 的是
| 温度/℃ | 0 | 30 | 50 |
 | 1.65 | 1.75 | 1.63 |
A.醋酸在水中的电离方程式: |
| B.0.1mol/L醋酸中加水稀释,醋酸和水的电离程度均增加 |
| C.醋酸溶液升温中可能涉及共价键和氢键断裂、离子水合的过程 |
| D.0~30℃电离总过程是放热的,30~50℃电离总过程是吸热的 |
您最近一年使用:0次
名校
解题方法
3 . 已知相关数据如下表:
下列离子方程式书写正确的是
| 化学式 | HF |  |  |
电离平衡常数( ) ) | 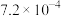 | 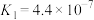  | 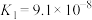 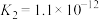 |
A. 与少量 与少量 反应: 反应: |
B.足量 通入饱和 通入饱和 溶液中: 溶液中: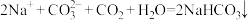 |
C.氢氧化钙溶液与氢氟酸混合的离子方程式: |
D.向 溶液通入过量 溶液通入过量 : : |
您最近一年使用:0次
2024-06-04更新
|
140次组卷
|
2卷引用:贵州省贵阳市第一中学2024届高三下学期5月高考适应性月考卷(八)化学试卷
4 . 磷酸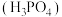 、亚磷酸
、亚磷酸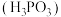 、次磷酸
、次磷酸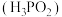 是化学工业生产中常用的无机酸,
是化学工业生产中常用的无机酸, 磷酸、亚磷酸、次磷酸最多消耗
磷酸、亚磷酸、次磷酸最多消耗 的物质的量依次为
的物质的量依次为 、
、 、
、 。亚磷酸易溶于水和醇,加热到180℃时分解成磷酸和磷化氢
。亚磷酸易溶于水和醇,加热到180℃时分解成磷酸和磷化氢 ,经实验检测发现
,经实验检测发现 溶液显碱性。已知:25℃时
溶液显碱性。已知:25℃时 、
、 ,
, 。下列说法正确的是
。下列说法正确的是
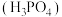 、亚磷酸
、亚磷酸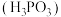 、次磷酸
、次磷酸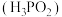 是化学工业生产中常用的无机酸,
是化学工业生产中常用的无机酸, 磷酸、亚磷酸、次磷酸最多消耗
磷酸、亚磷酸、次磷酸最多消耗 的物质的量依次为
的物质的量依次为 、
、 、
、 。亚磷酸易溶于水和醇,加热到180℃时分解成磷酸和磷化氢
。亚磷酸易溶于水和醇,加热到180℃时分解成磷酸和磷化氢 ,经实验检测发现
,经实验检测发现 溶液显碱性。已知:25℃时
溶液显碱性。已知:25℃时 、
、 ,
, 。下列说法正确的是
。下列说法正确的是A. 、 、 、 、 都是酸式盐 都是酸式盐 |
B. 溶液显碱性,说明 溶液显碱性,说明 的水解大于电离 的水解大于电离 |
C.常温下, 的次磷酸溶液在加水稀释过程中, 的次磷酸溶液在加水稀释过程中, 的值减小 的值减小 |
D.亚磷酸受热分解生成磷化氢的过程中,被氧化的亚磷酸和被还原的亚磷酸分子个数比为 |
您最近一年使用:0次
5 . 已知: 、
、 分别为一元弱碱和一元弱酸,二者在水中电离方程式分别为:
分别为一元弱碱和一元弱酸,二者在水中电离方程式分别为: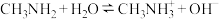 ;
;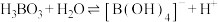 。25℃时,将10mL浓度均为
。25℃时,将10mL浓度均为 的
的 、
、 两种溶液分别加水稀释。曲线如图所示,
两种溶液分别加水稀释。曲线如图所示, 是溶液体积(mL),
是溶液体积(mL), 。下列说法正确的是
。下列说法正确的是
 、
、 分别为一元弱碱和一元弱酸,二者在水中电离方程式分别为:
分别为一元弱碱和一元弱酸,二者在水中电离方程式分别为: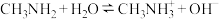 ;
;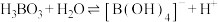 。25℃时,将10mL浓度均为
。25℃时,将10mL浓度均为 的
的 、
、 两种溶液分别加水稀释。曲线如图所示,
两种溶液分别加水稀释。曲线如图所示, 是溶液体积(mL),
是溶液体积(mL), 。下列说法正确的是
。下列说法正确的是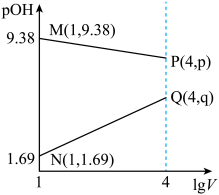
A.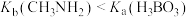 |
B.水的电离程度: |
C.溶液中的阴、阳离子总浓度: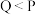 |
D.常温下,向上述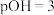 的 的 溶液加入等体积 溶液加入等体积 的盐酸后呈中性 的盐酸后呈中性 |
您最近一年使用:0次
6 . 常温下,分别向MnCl2、ZnCl2、CH3COOH溶液中滴加NaOH溶液,溶液pX[pX=-lgc(X),X代表Mn2+、Zn2+、OH-,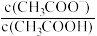 ]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是
]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是
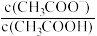 ]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是
]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是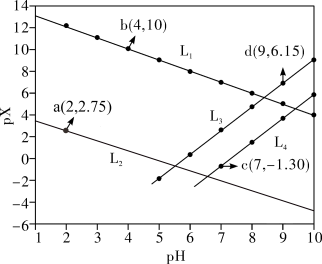
A.图中L2代表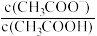 ,L3代表Mn2+ ,L3代表Mn2+ |
| B.室温下,Ksp[Zn(OH)2]的数量级为10-13 |
C.同时产生两种沉淀时,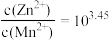 |
D.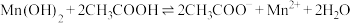 的平衡常数K=105.8 的平衡常数K=105.8 |
您最近一年使用:0次
2024-06-02更新
|
104次组卷
|
4卷引用:河南省九师联盟2023-2024学年高三下学期5月月考理综试题-高中化学
7 . 常温下,向浓度相等的甲酸( )和醋酸(
)和醋酸( )的混合溶液中滴加氨水,溶液中
)的混合溶液中滴加氨水,溶液中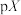 [
[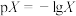 ,
, 、
、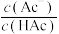 、
、 ]与
]与 的关系如图所示。下列叙述错误的是
的关系如图所示。下列叙述错误的是
 )和醋酸(
)和醋酸( )的混合溶液中滴加氨水,溶液中
)的混合溶液中滴加氨水,溶液中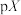 [
[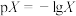 ,
, 、
、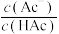 、
、 ]与
]与 的关系如图所示。下列叙述错误的是
的关系如图所示。下列叙述错误的是
A. 代表 代表 与 与 的变化关系 的变化关系 |
B.常温下, |
C.向 溶液中滴加氨水至Q点: 溶液中滴加氨水至Q点: |
D.上述反应中,最先生成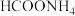 和 和 |
您最近一年使用:0次
2024-06-01更新
|
152次组卷
|
3卷引用:青海省海南州贵德高级中学2023-2024学年高三下学期第九次模拟预测理综试题-高中化学
8 . 常温下,在特制容器中加入20mL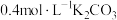 溶液,用
溶液,用 HCl溶液滴定,利用pH计和气体压力传感器检测,得到如图曲线。下列说法错误的是
HCl溶液滴定,利用pH计和气体压力传感器检测,得到如图曲线。下列说法错误的是
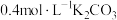 溶液,用
溶液,用 HCl溶液滴定,利用pH计和气体压力传感器检测,得到如图曲线。下列说法错误的是
HCl溶液滴定,利用pH计和气体压力传感器检测,得到如图曲线。下列说法错误的是
A.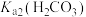 的数量级为 的数量级为 |
| B.滴定过程中,水的电离程度始终在减小 |
C.cd段反应的离子方程式为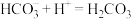 |
D.f点对应的溶液中存在: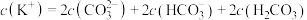 |
您最近一年使用:0次
9 . 研究弱电解质的电离及盐的水解,有重要的实际意义。
(1)醋酸的电离方程式为_______ 。
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
(3)某些弱酸在25℃时的电离常数(Ka)如表:
①同浓度的 CH3COOH、H2CO3、HClO 溶液的 pH 最大的是_______ 。
②常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______ (填字母序号,下同)。
A.c(H⁺) B.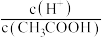 C.
C.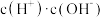 D.
D. E.
E. 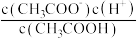
③若该溶液升高温度,上述5种表达式的数据减小的是_______ 。
④下列反应可以发生的是_______ (填标号)。
A. CH3COOH+ Na2CO3=NaHCO3 +CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
(4)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似,写出第一步电离的离子方程式_______ 。
(5)已知 。
。 属于
属于_______ (填“一”“二”或“三”)元酸, 属于
属于_______ (填“正盐”或“酸式盐”)。
(6)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至1000mL, 稀释过程pH变化如图:则HX的电离平衡常数_______ (填“大于”、“等于”或“小于”)醋酸的平衡常数。 稀释后,HX 溶液中有水电离出来的c(H⁺)_______ (填“大于”、“等于”或“小于”)醋酸的溶液中有水电离出来的c(H⁺),理由是_______ 。
(1)醋酸的电离方程式为
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
| A.相同温度下,浓度均为1mol/L的盐酸和醋酸的导电性对比:盐酸明显大于醋酸 |
| B.1mol/LCH3COONa溶液能使紫色石蕊试液变蓝 |
| C.25℃时,1 mol/LCH3COOH溶液的pH约为2 |
| D.10 mL1mol/L的CH3COOH溶液恰好与10 mL 1 mol/LNaOH溶液完全反应 |
(3)某些弱酸在25℃时的电离常数(Ka)如表:
| 化学式 | CH3COOH | HCN | HClO | H2CO3 |
| 电离常数(Ka) | 1.8×10-5 | 4.9×10 -10 | 3.0×10-8 | Ka1=4.4×10-7,Ka2=4.7×10-11 |
②常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.c(H⁺) B.
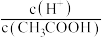 C.
C.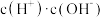 D.
D. E.
E. 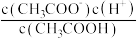
③若该溶液升高温度,上述5种表达式的数据减小的是
④下列反应可以发生的是
A. CH3COOH+ Na2CO3=NaHCO3 +CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
(4)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似,写出第一步电离的离子方程式
(5)已知
 。
。 属于
属于 属于
属于(6)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至1000mL, 稀释过程pH变化如图:则HX的电离平衡常数
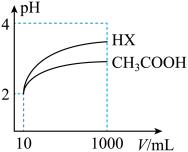
您最近一年使用:0次
名校
10 . 已知常温下水溶液中 、
、 、
、 、
、 、
、 的分布分数
的分布分数 如[如
如[如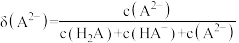 ]随
]随 变化曲线如图1所示,溶液中
变化曲线如图1所示,溶液中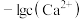 和
和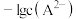 关系如图2所示,用
关系如图2所示,用 的
的 溶液滴定
溶液滴定
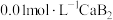 溶液,下列说法错误的是
溶液,下列说法错误的是
 、
、 、
、 、
、 、
、 的分布分数
的分布分数 如[如
如[如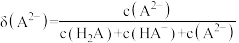 ]随
]随 变化曲线如图1所示,溶液中
变化曲线如图1所示,溶液中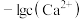 和
和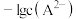 关系如图2所示,用
关系如图2所示,用 的
的 溶液滴定
溶液滴定
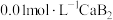 溶液,下列说法错误的是
溶液,下列说法错误的是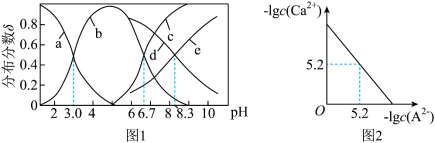
A.曲线b表示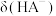 |
B. 溶液中存在: 溶液中存在: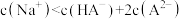 |
C.反应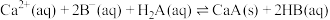 的平衡常数 的平衡常数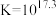 |
D.滴定过程中始终存在: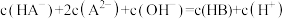 |
您最近一年使用:0次
2024-05-24更新
|
89次组卷
|
2卷引用:广西桂林市第十八中学2023-2024学年高三下学期5月月考化学试卷



