真题
1 . 在浓度为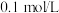 的
的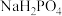 溶液中,如下说法正确的是
溶液中,如下说法正确的是
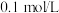 的
的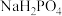 溶液中,如下说法正确的是
溶液中,如下说法正确的是A.溶液中浓度最大的离子是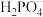 |
B.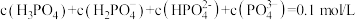 |
C.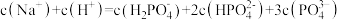 |
D.磷酸第二步电离平衡的平衡常数表达式为 |
您最近一年使用:0次
2023-07-05更新
|
3514次组卷
|
4卷引用:2023年天津市高考化学试卷
2023年天津市高考化学试卷天津市和平区2023-2024学年高二上学期期末考试化学试卷(已下线)题型18 化学反应原理综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)选择题7-12
2 . 一定条件下,水气变换反应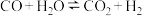 的中间产物是
的中间产物是 。为探究该反应过程,研究
。为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
水溶液在密封石英管中的分解反应:
Ⅰ.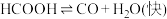
Ⅱ.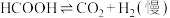
研究发现,在反应Ⅰ、Ⅱ中, 仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
(1)一定条件下,反应Ⅰ、Ⅱ的焓变分别为 、
、 ,则该条件下水气变换反应的焓变
,则该条件下水气变换反应的焓变
_____ (用含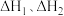 的代数式表示)。
的代数式表示)。
(2)反应Ⅰ正反应速率方程为: ,k为反应速率常数。
,k为反应速率常数。 温度下,
温度下, 电离平衡常数为
电离平衡常数为 ,当
,当 平衡浓度为
平衡浓度为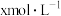 时,
时, 浓度为
浓度为_____  ,此时反应Ⅰ的反应速率
,此时反应Ⅰ的反应速率
_____  (用含
(用含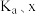 和k的代数式表示)。
和k的代数式表示)。
(3) 温度下,在密封石英管内完全充满
温度下,在密封石英管内完全充满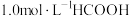 水溶液,使
水溶液,使 分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。 时刻测得
时刻测得 的浓度分别为
的浓度分别为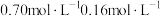 ,反应Ⅱ达平衡时,测得
,反应Ⅱ达平衡时,测得 的浓度为
的浓度为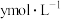 。体系达平衡后
。体系达平衡后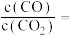
_____ (用含y的代数式表示,下同),反应Ⅱ的平衡常数为_____ 。
相同条件下,若反应起始时溶液中同时还含有 盐酸,则图示点
盐酸,则图示点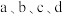 中,
中, 的浓度峰值点可能是
的浓度峰值点可能是_____ (填标号)。与不含盐酸相比, 达浓度峰值时,
达浓度峰值时, 浓度
浓度_____ (填“增大”“减小”或“不变”), 的值
的值_____ (填“增大”“减小”或“不变”)。
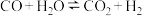 的中间产物是
的中间产物是 。为探究该反应过程,研究
。为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
水溶液在密封石英管中的分解反应:Ⅰ.
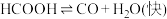
Ⅱ.
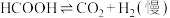
研究发现,在反应Ⅰ、Ⅱ中,
 仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:(1)一定条件下,反应Ⅰ、Ⅱ的焓变分别为
 、
、 ,则该条件下水气变换反应的焓变
,则该条件下水气变换反应的焓变
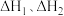 的代数式表示)。
的代数式表示)。(2)反应Ⅰ正反应速率方程为:
 ,k为反应速率常数。
,k为反应速率常数。 温度下,
温度下, 电离平衡常数为
电离平衡常数为 ,当
,当 平衡浓度为
平衡浓度为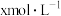 时,
时, 浓度为
浓度为 ,此时反应Ⅰ的反应速率
,此时反应Ⅰ的反应速率
 (用含
(用含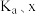 和k的代数式表示)。
和k的代数式表示)。(3)
 温度下,在密封石英管内完全充满
温度下,在密封石英管内完全充满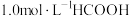 水溶液,使
水溶液,使 分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。 时刻测得
时刻测得 的浓度分别为
的浓度分别为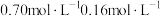 ,反应Ⅱ达平衡时,测得
,反应Ⅱ达平衡时,测得 的浓度为
的浓度为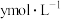 。体系达平衡后
。体系达平衡后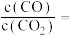

相同条件下,若反应起始时溶液中同时还含有
 盐酸,则图示点
盐酸,则图示点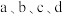 中,
中, 的浓度峰值点可能是
的浓度峰值点可能是 达浓度峰值时,
达浓度峰值时, 浓度
浓度 的值
的值
您最近一年使用:0次
2023-06-19更新
|
10587次组卷
|
10卷引用:2023年高考山东卷化学真题
2023年高考山东卷化学真题四川省宜宾市第四中学校2022-2023学年高二下学期6月期末化学试题(已下线)2023年高考山东卷化学真题变式题(原理综合题)(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)第20练 化学反应原理综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用)湖北省武汉市第二中学2023-2024学年高二上学期10月月考化学试题湖北省武汉市第二中学2023-2024学年高三上学期10月月考化学试题(已下线)专题04 电离平衡 水的电离和溶液的pH-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)
3 .  时,苯酚
时,苯酚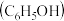 的
的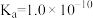 ,下列说法正确的是
,下列说法正确的是
 时,苯酚
时,苯酚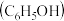 的
的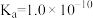 ,下列说法正确的是
,下列说法正确的是A.相同温度下,等 的 的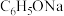 和 和 溶液中, 溶液中, |
B.将浓度均为 的 的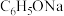 和 和 溶液加热,两种溶液的 溶液加热,两种溶液的 均变大 均变大 |
C. 时, 时, 溶液与 溶液与 溶液混合,测得 溶液混合,测得 ,则此时溶液中 ,则此时溶液中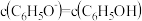 |
D. 时, 时, 的 的 溶液中加少量 溶液中加少量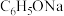 固体,水的电离程度变小 固体,水的电离程度变小 |
您最近一年使用:0次
2022-06-14更新
|
6653次组卷
|
24卷引用:2022年6月浙江省普通高校招生选考化学试题
2022年6月浙江省普通高校招生选考化学试题(已下线)2022年浙江省6月高考真题变式题11-20(已下线)第13练 以pH的计算突破弱电解质的电离、溶液酸碱性-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)考点26 弱电解质的电离-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)2022年海南省高考真题变式题1-14(已下线)第30练 电离平衡-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第23讲 弱电解质的电离平衡(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第22讲 水的电离与溶液的pH(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点23 弱电解质的电离平衡-备战2023年高考化学考试易错题(已下线)专题06 水溶液中的离子平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题20 溶液中粒子浓度大小的比较-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)江西省宜春市铜鼓中学2022-2023学年高二下学期第一次段考化学试题(已下线)专题卷12 强弱电解质分析比较-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)广东省湛江市普通高中2023届高三下学期4月模拟考试化学试题天津市滨海新区2023届普通高考第三次模拟检测化学试题江苏省南京师范大学附属中学2023届高三下学期5月模拟考试化学试题(已下线)专题09 水溶液中的离子平衡-2023年高考化学真题题源解密(新高考专用)章末检测卷(三) 水溶液中的离子反应与平衡(已下线)考点28 盐类的水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)辽宁省铁岭市昌图县第一高级中学2023-2024学年高二上学期9月考试化学试题第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 第1课时 盐溶液的酸碱性(已下线)考点2 水的电离与溶液的pH (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)福建省厦门第一中学2023-2024学年高二上学期12月月考化学试卷
4 . 已知25℃时二元酸H2A的Ka1=1.3×10-7,Ka2=7.1×10-15。下列说法正确的是
| A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者 |
| B.向0.1mol·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013% |
| C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-) |
| D.取pH=a的H2A溶液10mL,加蒸馏水稀释至100mL,则该溶液pH=a+1 |
您最近一年使用:0次
2022-01-12更新
|
8988次组卷
|
28卷引用:2022 年1月浙江省普通高校招生选考科目考试化学试题
2022 年1月浙江省普通高校招生选考科目考试化学试题(已下线)卷09 水溶液中的离子平衡-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)2022年浙江1月高考真题变式题(11-20)(已下线)第13练 以pH的计算突破弱电解质的电离、溶液酸碱性-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)考点27 水的电离和溶液的pH-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第30练 电离平衡-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第23讲 弱电解质的电离平衡(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第24讲 水的电离和溶液的pH(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第22讲 水的电离与溶液的pH(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点23 弱电解质的电离平衡-备战2023年高考化学考试易错题陕西省西安市长安区第一中学2022-2023学年高三上学期第二次质量检测化学试题四川省成都市树德中学2022-2023学年高二上学期期中考试化学试题(已下线)专题06 水溶液中的离子平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)广西钦州市第四中学2022-2023学年高二上学期11月考试化学试题(已下线)题型132 溶液酸碱性的判断与溶液pH的计算江西省宜春市丰城第九中学重点班2022-2023学年高二下学期开学质量检测化学试题(已下线)专题卷12 强弱电解质分析比较-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)第14练 水溶液中粒子浓度的关系判断 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题09 水溶液中的离子平衡-2023年高考化学真题题源解密(新高考专用)(已下线)考点26 弱电解质的电离(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江西省宜春市宜丰中学2022-2023学年高三上学期1月期末考试化学试题(已下线)第30讲水的电离和溶液的酸碱性(已下线)考点1 电离平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)广东省深圳市盐田高级中学2023-2024高二上学期期中考试化学试题安徽省安庆市第二中学2023-2024学年高二上学期期中考试化学试卷安徽省安庆市怀宁县高河中学2023-2024学年高二上学期第三次月考化学试题
5 . HA是一元弱酸,难溶盐MA的饱和溶液中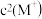 随c(H+)而变化,
随c(H+)而变化,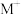 不发生水解。实验发现,
不发生水解。实验发现,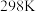 时
时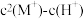 为线性关系,如下图中实线所示。
为线性关系,如下图中实线所示。
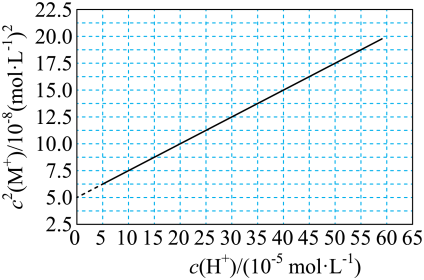
下列叙述错误的是
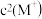 随c(H+)而变化,
随c(H+)而变化,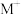 不发生水解。实验发现,
不发生水解。实验发现,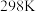 时
时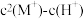 为线性关系,如下图中实线所示。
为线性关系,如下图中实线所示。
下列叙述错误的是
A.溶液 时, 时,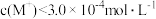 |
B.MA的溶度积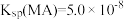 |
C.溶液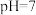 时, 时, |
D.HA的电离常数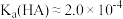 |
您最近一年使用:0次
2021-06-09更新
|
25513次组卷
|
50卷引用:2021年高考全国乙卷化学真题
2021年高考全国乙卷化学真题(已下线)第八章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测(已下线)考点26 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)课时45 难溶电解质的溶解平衡-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第21讲 电离平衡(讲)-2022年高考化学一轮复习讲练测(新教材新高考)辽宁省东北育才学校2021-2022学年高二上学期期中考试化学试题(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)2021年高考全国乙卷化学试题变式题(已下线)第八单元 水溶液中的离子平衡(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-讲义江苏省泰州中学2021-2022学年高二上学期第二次质量检测化学试题(已下线)卷11 溶液中的离子平衡-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)回归教材重难点04 水溶液中的离子平衡-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题6 Ksp专练(已下线)专题10水溶液中的离子平衡-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题10水溶液中的离子平衡-五年(2018~2022)高考真题汇编(全国卷)四川省绵阳市2023届高三零诊模拟检测试题理科综合化学试题(已下线)考点29 沉淀溶解平衡-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第14练 用“五点”法突破盐类水解及酸碱混合相关图像-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)第33练 沉淀溶解平衡-2023年高考化学一轮复习小题多维练(全国通用)第三章 综合拔高练(已下线)第21讲 电离平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)微专题39 水溶液中平衡图像的拓展与探析-备战2023年高考化学一轮复习考点微专题(已下线)第24讲 沉淀溶解平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)微专题42 四大平衡常数的计算与应用-备战2023年高考化学一轮复习考点微专题(已下线)易错点23 弱电解质的电离平衡-备战2023年高考化学考试易错题(已下线)第一部分 二轮专题突破 题型专攻4 电解质溶液各类图像的分析疑难压轴1 电解质溶液中“四大常数”的相关计算(已下线)第八章 水溶液中的离子反应与平衡 第53讲 沉淀溶解平衡图像的分析(已下线)题型28 沉淀溶解平衡常数及其应用图像甘肃省张掖市高台县第一中学2022-2023学年高二下学期2月月考化学试题湖南省长沙市长郡中学2022-2023学年高三下学期第七次月考化学试题重庆市南开中学校2023届高三模拟考试化学试题(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)专题09 水溶液中的离子平衡-2023年高考化学真题题源解密(新高考专用)微专题(13) 四大常数(K、Ka或Kb、Kw、Ksp)的应用微专题(九)——沉淀溶解平衡曲线(已下线)考点29 沉淀溶解平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)(已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第6讲 沉淀溶解平衡图像分析辽宁省鞍山市普通高中2023-2024学年高三上学期期末联考化学试题四川省合江县马街中学校2023-2024学年高二上学期1月期末化学试题湖南省长沙市雅礼中学2023-2024学年高二下学期第一次月考化学试卷
6 . 实验测得10 mL 0.50 mol·L-1NH4Cl溶液、10 mL 0.50mol·L-1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25 ℃时CH3COOH和NH3·H2O的电离常数均为1.8×10-5.下列说法不正确 的是
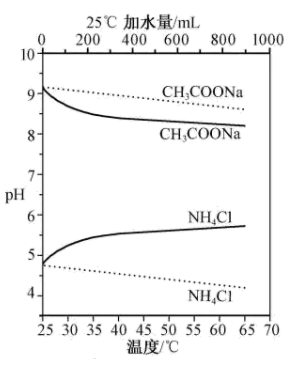

| A.图中 |
B.将NH4Cl溶液加水稀释至浓度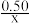 mol·L-1,溶液pH变化值小于lgx mol·L-1,溶液pH变化值小于lgx |
| C.随温度升高,Kw增大,CH3COONa溶液中c(OH- )减小,c(H+)增大,pH减小 |
D.25 ℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+ )-c(CH3COO- )=c(Cl-)-c(NH ) ) |
您最近一年使用:0次
2021-01-09更新
|
9126次组卷
|
31卷引用:2021年1月新高考浙江化学高考真题
2021年1月新高考浙江化学高考真题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)难点7 溶液稀释与酸碱中和滴定曲线分析-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时39 弱电解质的电离平衡-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题15.离子反应图象-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)第21讲 电离平衡(讲)-2022年高考化学一轮复习讲练测(新教材新高考)湖南师范大学附属中学2021-2022学年高三上学期月考(三)化学试题(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)2021年1月浙江高考化学试题变式题21-252021年湖北高考化学试题变式题11-19(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第31练 水的电离和溶液的pH-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第23讲 盐类水解 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第21讲 电离平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)浙江省金华市曙光学校2021-2022学年高三下学期5月模拟考试化学试题陕西省西安工业大学附属中学2021-2022学年高三下学期第七次适应性训练理综化学试题(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)广东省深圳外国语学校2022-2023学年高二上学期期末考试化学试题(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡北京市第一○一中学2023届高三下学期三模化学试题(已下线)T12-电解质溶液(已下线)考点26 弱电解质的电离(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点28 盐类的水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第4讲 盐类的水解山西大学附属中学校2022-2023学年高三上学期11月期中考试化学试题
7 . 某弱酸HA溶液中主要成分的分布分数随pH的变化如图所示。下列说法错误 的是


| A.该酸-lgKa ≈4.7 |
B.NaA的水解平衡常数Kh=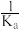 |
| C.当该溶液的pH= 7.0时,c(HA)<c(A- ) |
| D.某c(HA):c(A- )=4: 1的缓冲溶液,pH≈4 |
您最近一年使用:0次
2020-10-12更新
|
6088次组卷
|
23卷引用:2020年海南省高考化学试卷(新高考)
2020年海南省高考化学试卷(新高考)黑龙江省哈尔滨师范大学附属中学2020-2021学年高二上学期期中考试化学试题海南省儋州市第一中学2020-2021学年高二上学期期中考试化学试题(已下线)小题必刷29 弱电解质的电离平衡——2021年高考化学一轮复习小题必刷(通用版本)(已下线)难点8 水溶液中的四大平衡常数-2021年高考化学【热点·重点·难点】专练(新高考)吉林省长春外国语学校2020-2021学年高二下学期第二次月考化学试题四川省遂宁市射洪中学2020—2021学年高二下学期第三次月考化学试题(已下线)第3周 周测卷-备战2022年高考化学周测与晚练(新高考专用)(已下线)第21讲 电离平衡(讲)-2022年高考化学一轮复习讲练测(新教材新高考)(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-讲义甘肃省天水市第一中学2021-2022学年高二下学期开学检测化学试题宁夏石嘴山市第三中学2022届高三下学期第四次模拟理科综合化学试题(已下线)2020年海南卷化学高考真题变式题9-14(已下线)2020年海南卷化学高考真题变式题9-14云南省临沧市双江县2021-2022学年高一上学期9月月考化学试题(已下线)第21讲 电离平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第八章 水溶液中的离子反应与平衡 第46讲 弱电解质的电离平衡(已下线)题型27 电离平衡常数、水解平衡常数及其应用图像(已下线)专题16 水溶液中的离子平衡(已下线)微专题 水溶液中函数图像的分析第1讲 弱电解质的电离平衡陕西省西安市蓝田县部分学校联考2023-2024学年高二上学期11月期中化学试题海南省文昌中学、华迈实验中学2023-2024学年高二上学期期中段考化学试题
8 . 利用太阳能光解水,制备的H2用于还原CO2合成有机物,可实现资源的再利用。回答下列问题:
Ⅰ.半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物
(1)下图为该催化剂在水中发生光催化反应的原理示意图。光解水能量转化形式为___________ 。
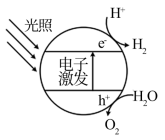
(2)若将该催化剂置于Na2SO3溶液中,产物之一为 ,另一产物为
,另一产物为__________ 。若将该催化剂置于AgNO3溶液中,产物之一为O2,写出生成另一产物的离子反应式__________ 。
Ⅱ.用H2还原CO2可以在一定条下合成CH3OH(不考虑副反应):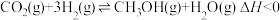
(3)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol‧L-1和3 a mol‧L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为___________ 。
(4)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。
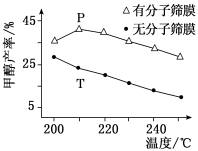
①甲醇平衡产率随温度升高而降低的原因为____________ 。
②P点甲醇产率高于T点的原因为___________ 。
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为___________ °C。
Ⅲ.调节溶液pH可实现工业废气CO2的捕获和释放
(5) 的空间构型为
的空间构型为__________ 。已知25℃碳酸电离常数为Ka1、Ka2,当溶液pH=12时, =1:
=1:_______ :__________ 。
Ⅰ.半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物
(1)下图为该催化剂在水中发生光催化反应的原理示意图。光解水能量转化形式为

(2)若将该催化剂置于Na2SO3溶液中,产物之一为
 ,另一产物为
,另一产物为Ⅱ.用H2还原CO2可以在一定条下合成CH3OH(不考虑副反应):
(3)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol‧L-1和3 a mol‧L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为
(4)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。

①甲醇平衡产率随温度升高而降低的原因为
②P点甲醇产率高于T点的原因为
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为
Ⅲ.调节溶液pH可实现工业废气CO2的捕获和释放
(5)
 的空间构型为
的空间构型为 =1:
=1:
您最近一年使用:0次
2020-07-11更新
|
5245次组卷
|
7卷引用:2020年天津卷化学高考试题
2020年天津卷化学高考试题(已下线)专题14 化学反应原理综合-2020年高考真题和模拟题化学分项汇编山东省济南市山东省实验中学西校2021届高三上学期10月份月考化学试题(已下线)难点6 化学反应原理的综合应用-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)2020年天津卷化学高考真题变式题13-16(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)专题17 原理综合题
9 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许______ 离子通过,氯气的逸出口是_______ (填标号)。

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)= ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为______ 。
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为______ 。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为_____ mol;产生“气泡”的化学方程式为____________ 。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是______ (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为____ kg(保留整数)。
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=
 ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次
2020-07-08更新
|
12800次组卷
|
13卷引用:2020年全国统一考试化学试题(新课标Ⅱ)
2020年全国统一考试化学试题(新课标Ⅱ)(已下线)专题13 元素及其化合物知识的综合应用-2020年高考真题和模拟题化学分项汇编四川省成都市双流棠湖中学2021届高三上学期开学考试理综化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记青海省湟川中学2020-2021学年高二下学期第一次月考化学试题(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)山东省枣庄市第三中学2022届高三第一次月考化学试题2020年全国卷Ⅱ化学真题变式题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)题型43 次氯酸、氯的含氧酸盐的性质和应用(已下线)专题17 原理综合题
10 . 以酚酞为指示剂,用0.1000 mol·L−1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数 随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2−的分布系数:
随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2−的分布系数: ]
]
 随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2−的分布系数:
随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2−的分布系数: ]
]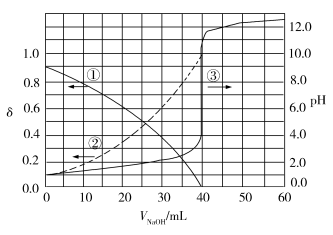
A.曲线①代表 ,曲线②代表 ,曲线②代表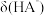 |
| B.H2A溶液的浓度为0.2000 mol·L−1 |
| C.HA−的电离常数Ka=1.0×10−2 |
D.滴定终点时,溶液中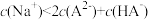 |
您最近一年使用:0次
2020-07-08更新
|
24065次组卷
|
85卷引用:2020年全国统一考试化学试题(新课标Ⅰ)
2020年全国统一考试化学试题(新课标Ⅰ)(已下线)专题10 水溶液中的离子平衡-2020年高考真题和模拟题化学分项汇编四川省南充市阆中中学2020-2021学年高二上学期期中考试化学试题(仁智班)(已下线)易错18 电解质溶液图像-备战2021年高考化学一轮复习易错题山东省商河县第一中学2020-2021学年高二上学期期中考试化学试题第26讲 水的电离和溶液的pH (精讲)-2021年高考化学一轮复习讲练测(已下线)小题必刷31 酸碱中和滴定及拓展应用——2021年高考化学一轮复习小题必刷(通用版本)(已下线)小题必刷33 粒子浓度大小比较——2021年高考化学一轮复习小题必刷(通用版本)天津市耀华中学2020-2021学年高二上学期第二次段考化学试题湖南省长沙市周南中学2020-2021学年高二上学期第三次月考化学试题河南省项城市第三高级中学2021届高三上学期第四次段考化学试题山西省晋城市(高平一中、阳城一中、高平实验中学)2020-2021学年高二上学期期末考试化学试题江西省抚州市金溪县第一中学2020-2021学年高二上学期第二次月考化学试题河南省信阳高级中学2020-2021学年高二下学期回顾测试化学试题安徽省滁州市明光中学2020-2021学年高二下学期开学考试化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)专题07 电解质溶液——备战2021年高考化学纠错笔记(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)山东省济南市西城实验学校2021届高三下学期3月月考化学试题安徽省阜阳市2020-2021学年高二下学期段考化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)难点7 溶液稀释与酸碱中和滴定曲线分析-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)难点5 溶液稀释与酸碱中和滴定曲线分析-2021年高考化学专练【热点·重点·难点】天津市红桥区2021届高三第二次质量调查(二模)化学试题陕西省咸阳市实验中学2020-2021学年高二下学期第三次月考化学试题选择性必修1(SJ)专题3专题培优专练选择性必修1 专题3素养检测(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(浙江专用)浙江省 山水联盟 2022届高三上学期开学联考化学试题(已下线)课时44 滴定曲线、分布系数曲线的分析-2022年高考化学一轮复习小题多维练(全国通用)甘肃省嘉峪关市第一中学2021届高三下学期六模考试理综化学试题河北省石家庄市第一中学2021-2022学年高二上学期开学考试化学试题(已下线)第22讲 水的电离与溶液的pH(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)专题24 弱电解质的电离(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)第三单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)浙江省山河联盟2021-2022学年高二上学期12月考试化学试题天津市和平区2021-2022学年高二上学期线上期末质量检测化学试题2020年全国卷Ⅰ理综化学高考真题变式题(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-练习黑龙江省大庆市实验中学2021-2022学年高二下学期开学考试化学试题山东省滕州市第一中学2021-2022学年高三上学期12月份阶段检测化学试题(已下线)卷09 水溶液中的离子平衡-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)回归教材重难点04 水溶液中的离子平衡-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题10水溶液中的离子平衡-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题10水溶液中的离子平衡-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点27 水的电离和溶液的pH-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第14练 用“五点”法突破盐类水解及酸碱混合相关图像-2022年【暑假分层作业】高二化学(2023届一轮复习通用)第三章 综合拔高练江西省抚州市金溪县第一中学2021-2022学年高二下学期第二次月考化学试题(已下线)第24讲 水的电离和溶液的pH(练)-2023年高考化学一轮复习讲练测(全国通用)河南省中原名校2021-2022学年高二下学期第一次联考化学试题(已下线)第22讲 水的电离与溶液的pH(讲)-2023年高考化学一轮复习讲练测(新教材新高考)湖南省长沙市长郡中学2022--2023学年高二上学期第二次线上月考化学试题湖南省长沙市长郡中学2022--2023学年高二上学期第二次线上月考化学试题(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题十三水溶液中的离子平衡河南省商丘市回民中学2022-2023学年高三上学期期末考试(线上)化学试题重庆市西南大学附属中学校2022-2023学年高二上学期开学定时训练化学试题(广延班)(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 题型专攻4 电解质溶液各类图像的分析湖南省攸县第一中学2022-2023学年高二上学期期末考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第51讲 反应过程溶液粒子浓度变化的图像分析(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)湖北省华中师范大学第一附属中学2022~2023学年高二下学期期中检测化学试题(已下线)专题四 电解质溶液图象(练)(已下线)题型26 电离平衡常数、水解平衡常数及其应用图像四川省成都市成华区列五中学2022-2023学年高二下学期6月月考化学试题微专题(12) 电解质溶液中的两类特殊图像湖北省荆州市沙市中学2022-2023学年高二上学期11月期中考试化学试题广东省中山大学附属中学2023-2024学年高三上学期8月阶段性检测化学试题河南省开封市祥符高级中学2023-2024学年高二上学期第一次月考化学试题湖北省武汉市武钢三中2023-2024学年高三上学期8月月考化学试题(已下线)第3讲 酸碱中和滴定河南省南阳市第一中学校2023-2024学年高三上学期第二次月考化学试题安徽省安庆市第二中学2023-2024学年高二上学期期中考试化学试卷山东省泰安市泰安第二中学2023-2024学年高二上学期1月期末化学试题福建省福州第三中学2023-2024学年高二上学期1月期末考试化学试题辽宁省沈阳市东北育才学校科学高中部2024届高三下学期最后一模化学试题



