1 . 常温下,分别向MnCl2、ZnCl2、CH3COOH溶液中滴加NaOH溶液,溶液pX[pX=-lgc(X),X代表Mn2+、Zn2+、OH-,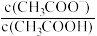 ]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是
]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是
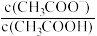 ]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是
]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是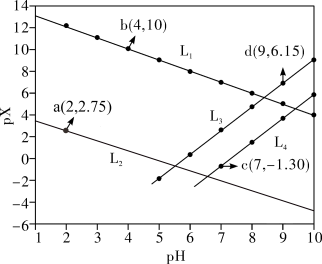
A.图中L2代表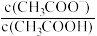 ,L3代表Mn2+ ,L3代表Mn2+ |
| B.室温下,Ksp[Zn(OH)2]的数量级为10-13 |
C.同时产生两种沉淀时,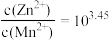 |
D.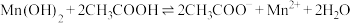 的平衡常数K=105.8 的平衡常数K=105.8 |
您最近一年使用:0次
2024-06-02更新
|
108次组卷
|
4卷引用:T13-溶液中的离子平衡
2 . 实验发现,25℃下强酸弱碱盐MA的悬浊液中 与
与 呈现线性关系,如下图中所示:
呈现线性关系,如下图中所示:

MOH易溶于水,下列叙述错误的是
 与
与 呈现线性关系,如下图中所示:
呈现线性关系,如下图中所示:
MOH易溶于水,下列叙述错误的是
| A.MA在pH=9的溶液中的溶解度小于在pH=10的溶液中的溶解度 |
B.MA的溶度积 |
C.MOH的电离常数 |
D.溶液pH=7时, |
您最近一年使用:0次
名校
解题方法
3 . 常温下,将 溶液滴入三元酸
溶液滴入三元酸 溶液中,混合溶液中
溶液中,混合溶液中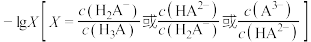 随
随 的变化关系如图所示。下列说法正确的是
的变化关系如图所示。下列说法正确的是
 溶液滴入三元酸
溶液滴入三元酸 溶液中,混合溶液中
溶液中,混合溶液中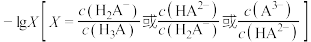 随
随 的变化关系如图所示。下列说法正确的是
的变化关系如图所示。下列说法正确的是
A.曲线 表示 表示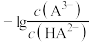 随 随 的变化关系 的变化关系 |
B.当 时,混合溶液中 时,混合溶液中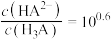 |
C.常温下,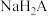 溶液中: 溶液中: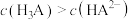 |
D.当 时, 时, |
您最近一年使用:0次
2024-04-21更新
|
342次组卷
|
5卷引用:不定选择题11-15
2024高三下·全国·专题练习
4 . 电镀在工业生产中具有重要作用,某电镀厂生产的废水经预处理后含有 和少量的Cu2+、Ni2+,能够采用如图流程进行逐一分离, 实现资源再利用。
和少量的Cu2+、Ni2+,能够采用如图流程进行逐一分离, 实现资源再利用。
若废水中还含有Cd2+,pH=4时Cd2+的浓度为_______ mol·L-1,用该结果说明Cd2+影响上述流程进行分离的原因是_______ (设H2S平衡浓度为1.0× 10-6mol·L-1。已知:H2S的K1=1.0×10-7,K2=7.0×10-15,Ksp(CdS)=7.0×10-27)
 和少量的Cu2+、Ni2+,能够采用如图流程进行逐一分离, 实现资源再利用。
和少量的Cu2+、Ni2+,能够采用如图流程进行逐一分离, 实现资源再利用。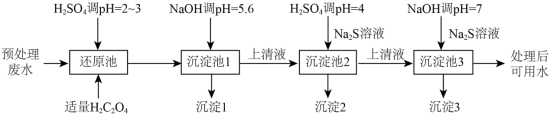
若废水中还含有Cd2+,pH=4时Cd2+的浓度为
您最近一年使用:0次
2024高三下·全国·专题练习
5 . 硫及其化合物在日常生活、工业生产中都非常普遍。
(1)在水中,硫酸是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为:H2SO4=H++ ,
,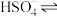 H++
H++ 。
。
①25℃时,Na2SO4溶液的pH___________ (填“>”“<”或“=”)7。
②0.100 mol∙L−1的稀硫酸中,c(H+)=0.109 mol∙L−1,求硫酸第二步电离的电离常数___________ (写出计算过程,结果保留三位有效数字)。
(2)液态水中,水存在自偶电离:H2O+H2O H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。
H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。
①液态的醋酸(用HAc表示)中,同样存在HAc的自偶电离,其方程式可表示为___________ 。
②用醋酸作溶剂时,硫酸是一种二元弱酸。将少量H2SO4溶于冰醋酸中,第一步电离的完整写法是___________ 。若保持温度不变,关于该所得溶液,下列说法正确的是___________ 。
A.加入少量冰醋酸,c( )与c(
)与c( )均减小
)均减小
B.加入少量H2SO4,H2SO4的电离程度增大
C.加入少量NaAc固体。c( )与c(
)与c( )的比值减小
)的比值减小
D.加入少量Na2SO4固体,c(Ac-)减小
(1)在水中,硫酸是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为:H2SO4=H++
 ,
,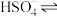 H++
H++ 。
。①25℃时,Na2SO4溶液的pH
②0.100 mol∙L−1的稀硫酸中,c(H+)=0.109 mol∙L−1,求硫酸第二步电离的电离常数
(2)液态水中,水存在自偶电离:H2O+H2O
 H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。
H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。①液态的醋酸(用HAc表示)中,同样存在HAc的自偶电离,其方程式可表示为
②用醋酸作溶剂时,硫酸是一种二元弱酸。将少量H2SO4溶于冰醋酸中,第一步电离的完整写法是
A.加入少量冰醋酸,c(
 )与c(
)与c( )均减小
)均减小B.加入少量H2SO4,H2SO4的电离程度增大
C.加入少量NaAc固体。c(
 )与c(
)与c( )的比值减小
)的比值减小D.加入少量Na2SO4固体,c(Ac-)减小
您最近一年使用:0次
2024高三下·全国·专题练习
6 . 已知Ka(Kb)、Kw、Kh、Ksp分别表示弱酸的电离平衡常数(弱碱的电离平衡常数)、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。通过查阅资料获得温度为25℃时以下数据:Kw=1.0×10-14,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,Ka(HF)=4.0×10-4,Ksp[Mg(OH)2]=1.8×10-11。
(1)为探究Mg(OH)2在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+2CH3COOH(aq) Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=
Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=___________ ,并据此推断Mg(OH)2___________ (填“能”或“不能”)溶解于醋酸(已知1.83≈5.8)。
(1)为探究Mg(OH)2在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+2CH3COOH(aq)
 Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=
Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=
您最近一年使用:0次
7 . 常温下,向 的某二元酸(
的某二元酸( )溶液中滴加等浓度的NaOH溶液,滴加过程中,混合溶液的pH与
)溶液中滴加等浓度的NaOH溶液,滴加过程中,混合溶液的pH与 或
或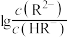 的变化关系如图所示。下列叙述错误的是
的变化关系如图所示。下列叙述错误的是
 的某二元酸(
的某二元酸( )溶液中滴加等浓度的NaOH溶液,滴加过程中,混合溶液的pH与
)溶液中滴加等浓度的NaOH溶液,滴加过程中,混合溶液的pH与 或
或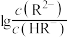 的变化关系如图所示。下列叙述错误的是
的变化关系如图所示。下列叙述错误的是
A.a表示 与pH的关系 与pH的关系 |
B.pH=7时,存在 |
C.常温下,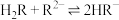 的平衡常数 的平衡常数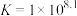 |
| D.加入等体积的NaOH溶液时,溶液显酸性 |
您最近一年使用:0次
8 . 室温下,对于 溶液,下列判断正确的是
溶液,下列判断正确的是
 溶液,下列判断正确的是
溶液,下列判断正确的是A.加入少量水,溶液中 减小 减小 |
B.与 溶液混合后 溶液混合后 |
C. |
D.溶液中水电离出 的物质的量浓度为 的物质的量浓度为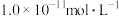 |
您最近一年使用:0次
名校
9 . 已知:亚磷酸(H3PO3)是二元弱酸,常温下H3PO3的水溶液中有:H3PO3
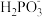 +H+ Ka1、
+H+ Ka1、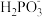

 +H+ Ka2.常温下,向1L0.5mol/L H3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中H3PO3、
+H+ Ka2.常温下,向1L0.5mol/L H3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中H3PO3、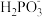 、
、 的分布分数[如:δ(
的分布分数[如:δ(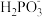 )=
)=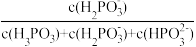 ]与溶液pH的关系如图所示,下列说法错误的是
]与溶液pH的关系如图所示,下列说法错误的是

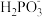 +H+ Ka1、
+H+ Ka1、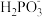

 +H+ Ka2.常温下,向1L0.5mol/L H3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中H3PO3、
+H+ Ka2.常温下,向1L0.5mol/L H3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中H3PO3、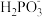 、
、 的分布分数[如:δ(
的分布分数[如:δ(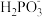 )=
)=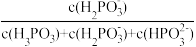 ]与溶液pH的关系如图所示,下列说法错误的是
]与溶液pH的关系如图所示,下列说法错误的是
A.曲线δ3代表 |
| B.Ka1=10-1.43、Ka2=10-6.54 |
C.b点溶液中c(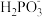 )=c( )=c( )=c(H+) )=c(H+) |
D.当V(NaOH)=1L时,溶液中c(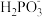 )>c( )>c( )>c(H3PO3) )>c(H3PO3) |
您最近一年使用:0次
名校
10 .  时,向
时,向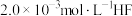 溶液中逐渐加入
溶液中逐渐加入 固体(溶液体积变化忽略不计),测得
固体(溶液体积变化忽略不计),测得 时平衡体系中
时平衡体系中 与溶液
与溶液 的关系如图所示.下列有关说法错误的是
的关系如图所示.下列有关说法错误的是
 时,向
时,向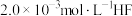 溶液中逐渐加入
溶液中逐渐加入 固体(溶液体积变化忽略不计),测得
固体(溶液体积变化忽略不计),测得 时平衡体系中
时平衡体系中 与溶液
与溶液 的关系如图所示.下列有关说法错误的是
的关系如图所示.下列有关说法错误的是
A.曲线ACE描述 浓度的变化 浓度的变化 |
B. 时, 时, 的电离平衡常数 的电离平衡常数 |
C.C点时,溶液中存在 |
D. 时,水的电离程度:E点>纯水>D点 时,水的电离程度:E点>纯水>D点 |
您最近一年使用:0次
2024-03-04更新
|
371次组卷
|
4卷引用:T13-水溶液中的离子平衡
(已下线)T13-水溶液中的离子平衡(已下线)压轴题07?水溶液中微粒变化图像题2024届湘豫名校联考高三下学期2月第一次模拟考试理综试题-高中化学重庆市铜梁一中等重点中学2023-2024学年高二下学期3月月考化学试题



