解题方法
1 . 工业上从金矿中提炼黄金可以采用氰化法,即:用NaCN稀溶液浸取粉碎的金矿石,生成溶于水的配位化合物Na[Au(CN)2],再用Zn置换出Au,产生的含氰废水经处理后排放。已知:HCN剧毒,易挥发,25℃时Ka(HCN)=4.0×10−10。
(1)配离子[Au(CN)2]−中的中心离子是___________ ,配体是___________ 。
(2)Zn位于元素周期表的第4周期第___________族。
(3)配制NaCN溶液时,将NaCN固体溶于___________溶液中,再用蒸馏水稀释。
(4)25℃时,等浓度等体积NaCN与HCN混合后溶液的pH>7,原因是___________ 。
(5)25℃时,H2CO3的Ka1=4.2×10−7,Ka2=4.8×10−11,将CO2通入NaCN溶液中,写出发生反应的离子方程式___________ 。
(6)可用Cl2处理含CN−废水:
___________CN−+___________Cl2+___________=___________HCO +___________N2↑+___________Cl−+___________。
+___________N2↑+___________Cl−+___________。
①CN−中各原子均达到8电子稳定结构,写出CN−的电子式___________ 。
②将上述离子方程式补充完整并配平。___________
③若标准状况下5.6m3Cl2发生反应,转移电子的数目为___________ 。(NA表示阿伏加德罗常数)
(7)酸性、碱性条件下,H2O2都能氧化废水中的CN−,但实际生产中却不选择酸性条件的可能原因是___________ 。
(1)配离子[Au(CN)2]−中的中心离子是
(2)Zn位于元素周期表的第4周期第___________族。
| A.IIA | B.IIB | C.0 | D.12 |
| A.HCl | B.KOH | C.NaCl | D.NaOH |
(5)25℃时,H2CO3的Ka1=4.2×10−7,Ka2=4.8×10−11,将CO2通入NaCN溶液中,写出发生反应的离子方程式
(6)可用Cl2处理含CN−废水:
___________CN−+___________Cl2+___________=___________HCO
 +___________N2↑+___________Cl−+___________。
+___________N2↑+___________Cl−+___________。①CN−中各原子均达到8电子稳定结构,写出CN−的电子式
②将上述离子方程式补充完整并配平。
③若标准状况下5.6m3Cl2发生反应,转移电子的数目为
(7)酸性、碱性条件下,H2O2都能氧化废水中的CN−,但实际生产中却不选择酸性条件的可能原因是
您最近一年使用:0次
2 . 为防止Cu2+水解,常用醋酸和醋酸钠的混合液控制溶液pH。现有一组c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的醋酸和醋酸钠的混合液。室温下,该组溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,下列认识正确的是

| A.利用图中信息,可以计算室温下CH3COOH的电离常数Ka |
| B.W点,c(Na+)>c(CH3COOH) |
C.随着pH的增大,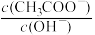 增大 增大 |
| D.pH<6.75时,CH3COOH电离的量与CH3COO-水解的量不可能相等 |
您最近一年使用:0次
名校
3 . 食醋是厨房常用的调味品,25℃时, 的
的 ,醋酸溶液加水稀释后,下列说法正确的是
,醋酸溶液加水稀释后,下列说法正确的是
 的
的 ,醋酸溶液加水稀释后,下列说法正确的是
,醋酸溶液加水稀释后,下列说法正确的是A. 数目增多 数目增多 |
B. 增大 增大 |
C. 的电离程度减小 的电离程度减小 |
D. 减小 减小 |
您最近一年使用:0次
名校
4 . 常温下,用0.1 mol⋅L 的NaOH溶液滴定10.00 mL 0.1 mol⋅L
的NaOH溶液滴定10.00 mL 0.1 mol⋅L 二元酸
二元酸 ,滴定过程中混合溶液的pH随滴加NaOH溶液的体积的变化曲线如图所示,下列说法正确的是
,滴定过程中混合溶液的pH随滴加NaOH溶液的体积的变化曲线如图所示,下列说法正确的是 的电离常数
的电离常数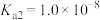 ;忽略混合时溶液体积变化。
;忽略混合时溶液体积变化。
 的NaOH溶液滴定10.00 mL 0.1 mol⋅L
的NaOH溶液滴定10.00 mL 0.1 mol⋅L 二元酸
二元酸 ,滴定过程中混合溶液的pH随滴加NaOH溶液的体积的变化曲线如图所示,下列说法正确的是
,滴定过程中混合溶液的pH随滴加NaOH溶液的体积的变化曲线如图所示,下列说法正确的是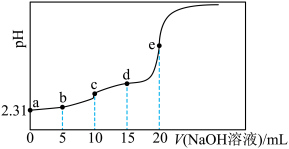
 的电离常数
的电离常数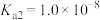 ;忽略混合时溶液体积变化。
;忽略混合时溶液体积变化。A. 的电离常数 的电离常数 约为 约为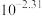 |
| B.e点溶液能使pH试纸变红 |
| C.c点水的电离程度比b点水的电离程度大 |
D.d点溶液中存在: mol⋅L mol⋅L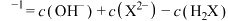 |
您最近一年使用:0次
2024-05-07更新
|
83次组卷
|
2卷引用:海南省省直辖县级行政单位琼中黎族苗族自治县2024届高三学业水平诊断(四)4月期中化学试题
5 . 已知25℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为物质
(1)碳酸一级电离的平衡常数表达式为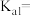
_______ 。
(2)下列四种离子结合 能力最强的是_______。
能力最强的是_______。
(3)酸性强弱:醋酸_______ 次氯酸(填“>”或“<”,下同);经测定,常温下0.1 的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,
的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,_______ (填“能”或“不能”)说明两者的酸性强弱关系。
(4)若保持温度不变,在醋酸溶液中通入少量HCl,则下列物理量变小的是_______。
(5) 和
和 的混合溶液中,
的混合溶液中,
_______ (用微粒符号表示)。
(6)25℃时,pH=1的硫酸与0.02
 溶液中,两者水电离出的氢离子浓度之比为
溶液中,两者水电离出的氢离子浓度之比为_______ 。
| 物质 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 |  |  | 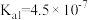 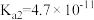 | 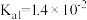 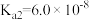 |
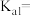
(2)下列四种离子结合
 能力最强的是_______。
能力最强的是_______。A. | B. | C. | D. |
 的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,
的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,(4)若保持温度不变,在醋酸溶液中通入少量HCl,则下列物理量变小的是_______。
A. | B. | C.醋酸的电离平衡常数 | D.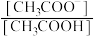 |
 和
和 的混合溶液中,
的混合溶液中,
(6)25℃时,pH=1的硫酸与0.02

 溶液中,两者水电离出的氢离子浓度之比为
溶液中,两者水电离出的氢离子浓度之比为
您最近一年使用:0次
名校
6 . 常温下,将等体积的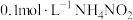 与
与 混合。
混合。
已知: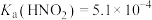 ,
, ,
,
下列说法错误的是
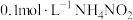 与
与 混合。
混合。已知:
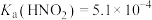 ,
, ,
,
下列说法错误的是
A.混合前 溶液中,离子浓度的顺序从大到小排列: 溶液中,离子浓度的顺序从大到小排列: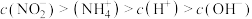 |
B.水的电离程度: >混合溶液> >混合溶液>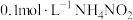 |
C.混合后的溶液中有: |
D.设 ,则混合溶液中的a大于 ,则混合溶液中的a大于 溶液中的a 溶液中的a |
您最近一年使用:0次
7 . 室温下,向Mg(NO3)2溶液、HF溶液、CH3CH2COOH溶液中分别滴加NaOH溶液,测得溶液中pH与pX[pX=-lgX,X代表 、
、 、
、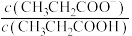 ]的关系如图所示。
]的关系如图所示。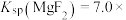
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是
已知:
 、
、 、
、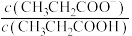 ]的关系如图所示。
]的关系如图所示。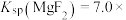
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是已知:

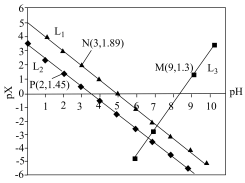
A. 代表的是pH与 代表的是pH与 的关系 的关系 |
B. 的 的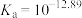 |
C.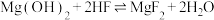 的 的 |
| D.含相同浓度NaF、HF的混合溶液的pH>7 |
您最近一年使用:0次
2024-04-01更新
|
564次组卷
|
6卷引用:湖南省邵阳市第二中学2023-2024学年高二下学期4月期中考试化学试题
8 . 醋酸溶液中存在电离平衡CH3COOH CH3COO—+ H+,下列叙述不正确的是
CH3COO—+ H+,下列叙述不正确的是
 CH3COO—+ H+,下列叙述不正确的是
CH3COO—+ H+,下列叙述不正确的是A.升高温度,平衡正向移动,醋酸的电离常数 增大 增大 |
B. 溶液加少量的 溶液加少量的 固体,平衡逆向移动 固体,平衡逆向移动 |
C. 的 的 溶液加水稀释,溶液中 溶液加水稀释,溶液中 减小 减小 |
D.室温下,欲使 醋酸溶液的电离度增大,可加入少量冰醋酸 醋酸溶液的电离度增大,可加入少量冰醋酸 |
您最近一年使用:0次
9 . 溶液中的化学反应大多是离子反应。根据要求回答问题。
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,农业上用石膏降低其碱性的反应原理___________ 。(用化学方程式表示)。
(2)氯化铝水溶液呈酸性的原因是(用离子方程式表示)___________ ,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是___________ 。
(3)教材课后习题中介绍了用SOCl2脱水制备无水氯化物的知识。请写出,将SOCl2与AlCl3·6H2O混合加热的化学反应方程式:___________ 。
(4)25℃时,在2.0×10-3mol·L-1的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH的关系如图。
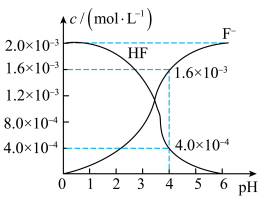
则25℃时,Ka(HF)=___________ 。
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,农业上用石膏降低其碱性的反应原理
(2)氯化铝水溶液呈酸性的原因是(用离子方程式表示)
(3)教材课后习题中介绍了用SOCl2脱水制备无水氯化物的知识。请写出,将SOCl2与AlCl3·6H2O混合加热的化学反应方程式:
(4)25℃时,在2.0×10-3mol·L-1的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH的关系如图。

则25℃时,Ka(HF)=
您最近一年使用:0次
解题方法
10 . 常温下,已知:
下列判断正确的是
| 物质 | CH3COOH | H2CO3 | CaCO3 |
| 平衡常数 | K=l.8×10-5 | Ka1=4.3×10-7,Ka2=5.6×10-11 | Ksp=2.8×10-9 |
A.向Na2CO3溶液中滴入酚酞,溶液变红,原因是 +H2O⇌H2CO3+2OH- +H2O⇌H2CO3+2OH- |
B.常温时,CH3COOH与CH3COONa混合溶液的pH=6,则 =18 =18 |
C.NaHCO3溶液中,c(OH-)-c(H+)=c(H2CO3)-c( ) ) |
D.2×10-3mol/L的Na2CO3溶液与2×10-4mol/LCaCl2溶液等体积混合,则混合后Ca2+的浓度是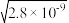 mol/L(假设混合溶液体积为两溶液体积之和) mol/L(假设混合溶液体积为两溶液体积之和) |
您最近一年使用:0次



