1 . 室温下,向10mL 0.1mol/L的H2SO3溶液中滴加0.1mol/L的NaOH溶液,各含硫微粒分布系数(平衡时某微粒的物质的量占各微粒物质的量之和的分数)与溶液pH的关系如图所示。下列说法不正确 的是

A.曲线Ⅱ表示HSO 的分布系数随pH的变化 的分布系数随pH的变化 |
| B.Ka2(H2SO3)的数量级为10−8 |
C.pH=7时,c(Na+)<3c(SO ) ) |
D.当加入的NaOH的体积为20mL时,c(H+)+ c(HSO )+ c(H2SO3)<c(OH-) )+ c(H2SO3)<c(OH-) |
您最近一年使用:0次
2 . 硫酸铈铵[(NH4)4Ce(SO4)4]是分析化学常用的滴定剂。以氯化铈(CeCl3)为主要原料合成硫酸铈铵的微型流程如下:
(1)(NH4)2SO4中阴离子的中心原子杂化类型是___________ 。
(2)已知常温下,NH3·H2O的电离常数为Kb=1.8×10-5,H2CO3的电离常数:Ka1=4.5×10-7、Ka2=4.7×10-12。NH4HCO3溶液显___________ (填“酸性” “碱性”或“中性”)。
(3)写出“沉铈”的离子方程式为___________ 。
(4)“灼烧”发生反应为2Ce2(CO3)(s)+O2(g) 4CeO2(s)+6CO2(g)。某温度下,在体积可变的密闭反应器中充入足量的O2和Ce2(CO3)3(s),发生上述反应。测得平衡时CeO2的质量变化如图所示。
4CeO2(s)+6CO2(g)。某温度下,在体积可变的密闭反应器中充入足量的O2和Ce2(CO3)3(s),发生上述反应。测得平衡时CeO2的质量变化如图所示。___________ 。
(5)CeO2的立方晶胞如图所示。NA为阿伏加德罗常数的值,两个铈离子最近距离为a nm。___________ (填标号),这种空隙填充率为___________ %。
a.正四边形 b.正八面体 c.正四面体 d.三角锥形
②晶体密度为___________ g·cm-3(列出计算式即可)。

(1)(NH4)2SO4中阴离子的中心原子杂化类型是
(2)已知常温下,NH3·H2O的电离常数为Kb=1.8×10-5,H2CO3的电离常数:Ka1=4.5×10-7、Ka2=4.7×10-12。NH4HCO3溶液显
(3)写出“沉铈”的离子方程式为
(4)“灼烧”发生反应为2Ce2(CO3)(s)+O2(g)
 4CeO2(s)+6CO2(g)。某温度下,在体积可变的密闭反应器中充入足量的O2和Ce2(CO3)3(s),发生上述反应。测得平衡时CeO2的质量变化如图所示。
4CeO2(s)+6CO2(g)。某温度下,在体积可变的密闭反应器中充入足量的O2和Ce2(CO3)3(s),发生上述反应。测得平衡时CeO2的质量变化如图所示。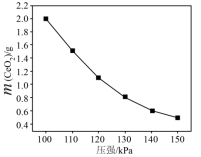
(5)CeO2的立方晶胞如图所示。NA为阿伏加德罗常数的值,两个铈离子最近距离为a nm。
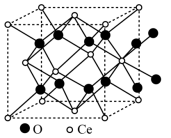
a.正四边形 b.正八面体 c.正四面体 d.三角锥形
②晶体密度为
您最近一年使用:0次
名校
解题方法
3 . I.根据表中数据(常温下),完成下列填空。
(1)常温下,NaCN溶液呈___________ (填“酸”、“碱”或“中”)性,其原因是___________ (用离子方程式表示)。
(2)常温下,向NaClO溶液中通入少量CO2,发生反应的离子方程式为___________ 。
(3)常温下,Na2SO3溶液中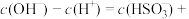
___________ 。
II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005 。处理含镉废水可采用化学沉淀法。
。处理含镉废水可采用化学沉淀法。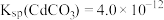 ,
,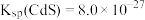 ;回答下列问题:
;回答下列问题:
(4)向某含镉废水中加入Na2S,当 浓度达到
浓度达到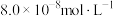 时,废水中Cd2+的浓度为
时,废水中Cd2+的浓度为___________  ,此时是否符合生活饮用水卫生标准?
,此时是否符合生活饮用水卫生标准?____________ (填“是”或“否”)
(5)室温下,反应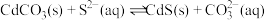 达到平衡,该反应的平衡常数K=
达到平衡,该反应的平衡常数K=___________ (结果保留两位有效数字)
| 物质 | CH3COOH | NH3•H2O | HCN | HClO | H2CO3 | H2SO3 |
| 电离常数(Ka) |  |  |  |  | 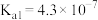 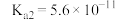 | 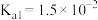  |
(2)常温下,向NaClO溶液中通入少量CO2,发生反应的离子方程式为
(3)常温下,Na2SO3溶液中
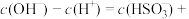
II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005
 。处理含镉废水可采用化学沉淀法。
。处理含镉废水可采用化学沉淀法。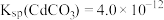 ,
,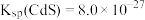 ;回答下列问题:
;回答下列问题:(4)向某含镉废水中加入Na2S,当
 浓度达到
浓度达到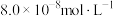 时,废水中Cd2+的浓度为
时,废水中Cd2+的浓度为 ,此时是否符合生活饮用水卫生标准?
,此时是否符合生活饮用水卫生标准?(5)室温下,反应
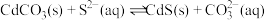 达到平衡,该反应的平衡常数K=
达到平衡,该反应的平衡常数K=
您最近一年使用:0次
4 . 室温下,向Mg(NO3)2溶液、HF溶液、CH3CH2COOH溶液中分别滴加NaOH溶液,测得溶液中pH与pX[pX=-lgX,X代表 、
、 、
、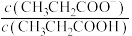 ]的关系如图所示。
]的关系如图所示。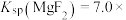
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是
已知:
 、
、 、
、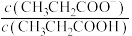 ]的关系如图所示。
]的关系如图所示。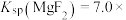
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是已知:

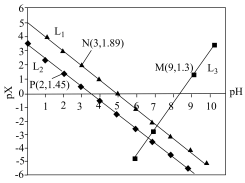
A. 代表的是pH与 代表的是pH与 的关系 的关系 |
B. 的 的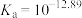 |
C.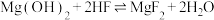 的 的 |
| D.含相同浓度NaF、HF的混合溶液的pH>7 |
您最近一年使用:0次
2024-04-01更新
|
563次组卷
|
6卷引用:内蒙古自治区赤峰第四中学2023-2024学年高三下学期开学考试理综试题-高中化学
名校
5 . 已知相关数据如下:
下列说法正确的是
| 物质 | HF | H2CO3 | CaF2 | CaCO3 |
| 相关数据 | Ka=6.8×10−4 | Ka1=4.5×10−7 Ka2=4.7×10−11 | Ksp=3.5×10−11 | Ksp=3.4×10−9 |
| A.氟化钠溶液中存在五种微粒 |
| B.氢氟酸滴入碳酸钠溶液中,可能不产生气体 |
| C.氢氧化钙溶液与氢氟酸混合的离子方程式:2OH−+Ca2++2H++2F−=CaF2↓+2H2O |
| D.向氟化钙悬浊液中通入CO2能够发生反应:CaF2+CO2+H2O=CaCO3+2HF |
您最近一年使用:0次
2024-03-25更新
|
266次组卷
|
3卷引用:北京师范大学附属实验中学2023-2024学年高三下学期开学考化学试题
名校
6 . 已知常见的酸的电离平衡常数如下(均为常温下的数据):
回答下列问题。
(1)下列事实能证明草酸是弱电解质的是______(填标号)。
(2)同浓度的 、
、 、
、 、
、 中结合
中结合 的能力最强的是
的能力最强的是______ 。
(3)常温下 的
的 溶液在加水稀释过程中,下列表达式的数据一定变小的是______(填标号)。
溶液在加水稀释过程中,下列表达式的数据一定变小的是______(填标号)。
(4)向 溶液中加入少量
溶液中加入少量 溶液,反应
溶液,反应 离子方程式为
离子方程式为____________ 。
(5)常温下,向 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至 ,溶液中
,溶液中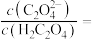
______ 。
(6) 的
的 溶液和
溶液和 的
的 溶液等体积混合,写出混合后溶液中离子浓度由大到小的排序:
溶液等体积混合,写出混合后溶液中离子浓度由大到小的排序:____________ 。
| 化学式 |  | HClO |  |  |
| 电离平衡常数 |  |  | 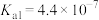  | 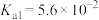 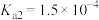 |
(1)下列事实能证明草酸是弱电解质的是______(填标号)。
A.草酸能使酸性 溶液褪色 溶液褪色 |
B.常温下, 的 的 溶液的 溶液的 |
C.相同条件下,浓度均为 的 的 溶液的导电能力比硫酸的导电能力弱 溶液的导电能力比硫酸的导电能力弱 |
D. 溶液中存在 溶液中存在 分子,呈酸性 分子,呈酸性 |
 、
、 、
、 、
、 中结合
中结合 的能力最强的是
的能力最强的是(3)常温下
 的
的 溶液在加水稀释过程中,下列表达式的数据一定变小的是______(填标号)。
溶液在加水稀释过程中,下列表达式的数据一定变小的是______(填标号)。A. | B. | C. | D. |
 溶液中加入少量
溶液中加入少量 溶液,反应
溶液,反应 离子方程式为
离子方程式为(5)常温下,向
 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至 ,溶液中
,溶液中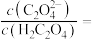
(6)
 的
的 溶液和
溶液和 的
的 溶液等体积混合,写出混合后溶液中离子浓度由大到小的排序:
溶液等体积混合,写出混合后溶液中离子浓度由大到小的排序:
您最近一年使用:0次
名校
7 . 以酚酞为指示剂,用 的
的 溶液滴定
溶液滴定 未知浓度的二元酸
未知浓度的二元酸 溶液。溶液中,
溶液。溶液中, 、分布系数
、分布系数 随滴加
随滴加 溶液体积
溶液体积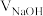 的变化关系如图所示。[比如
的变化关系如图所示。[比如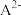 的分布系数:
的分布系数: ]下列叙述正确的是
]下列叙述正确的是

 的
的 溶液滴定
溶液滴定 未知浓度的二元酸
未知浓度的二元酸 溶液。溶液中,
溶液。溶液中, 、分布系数
、分布系数 随滴加
随滴加 溶液体积
溶液体积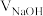 的变化关系如图所示。[比如
的变化关系如图所示。[比如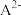 的分布系数:
的分布系数: ]下列叙述正确的是
]下列叙述正确的是
A.当 时, 时, |
B.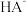 的电离常数约为 的电离常数约为 |
C. 溶液的浓度为 溶液的浓度为 |
D.滴定终点时,溶液中 |
您最近一年使用:0次
8 . 雪碧、可乐是深受全球青睐的碳酸型饮料。
Ⅰ.雪碧是一款柠檬味汽水饮料,其中所含酸性物质包括:碳酸、柠檬酸、苯甲酸。25℃时,苯甲酸和柠檬酸的电离常数如表所示:
(1)酸性强弱比较:苯甲酸______ 柠檬酸(填“>”“<”或“=”)。
(2)欲使纯水中平衡 向右移动,且溶液显碱性,下列方法可行的是______(填标号)。
向右移动,且溶液显碱性,下列方法可行的是______(填标号)。
Ⅱ.某兴趣小组在实验室测定某可乐中磷酸的含量的实验步骤如下(不考虑白砂糖、咖啡因的影响)。
ⅰ.将50.00mL可乐注入圆底烧瓶,搅拌2~3min,加入6g活性炭,吸附色素。
ⅱ.将可乐回流加热10min,冷却至室温,过滤。
ⅲ.取滤液,用百里香酚酞作指示剂,用 NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液4.60mL。(已知磷酸为三元中强酸。)
NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液4.60mL。(已知磷酸为三元中强酸。)
(3)加热的目的是______ 。
(4)该可乐样品中磷酸的含量为______  (计算结果保留两位小数)。
(计算结果保留两位小数)。
Ⅲ.已知某溶洞水体中lgc(X)(X为H2CO3、、或Ca2+)与pH的关系如图所示。______ (填“ ”“
”“ ”或“Ca2+”)。
”或“Ca2+”)。
②利用上图数据计算,
______ 。
③d=______ (填具体数值)。
Ⅰ.雪碧是一款柠檬味汽水饮料,其中所含酸性物质包括:碳酸、柠檬酸、苯甲酸。25℃时,苯甲酸和柠檬酸的电离常数如表所示:
| 化学式 | 苯甲酸(C6H5COOH) | 柠檬酸 |
| 电离常数 | 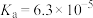 |  |
(1)酸性强弱比较:苯甲酸
(2)欲使纯水中平衡
 向右移动,且溶液显碱性,下列方法可行的是______(填标号)。
向右移动,且溶液显碱性,下列方法可行的是______(填标号)。| A.通入氨气 | B.加入Na |
| C.加入苯甲酸钠固体 | D.加热至90℃ |
Ⅱ.某兴趣小组在实验室测定某可乐中磷酸的含量的实验步骤如下(不考虑白砂糖、咖啡因的影响)。
ⅰ.将50.00mL可乐注入圆底烧瓶,搅拌2~3min,加入6g活性炭,吸附色素。
ⅱ.将可乐回流加热10min,冷却至室温,过滤。
ⅲ.取滤液,用百里香酚酞作指示剂,用
 NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液4.60mL。(已知磷酸为三元中强酸。)
NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液4.60mL。(已知磷酸为三元中强酸。)(3)加热的目的是
(4)该可乐样品中磷酸的含量为
 (计算结果保留两位小数)。
(计算结果保留两位小数)。Ⅲ.已知某溶洞水体中lgc(X)(X为H2CO3、、或Ca2+)与pH的关系如图所示。

 ”“
”“ ”或“Ca2+”)。
”或“Ca2+”)。②利用上图数据计算,

③d=
您最近一年使用:0次
名校
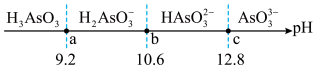
9 . 常温下亚砷酸 在溶液中存在多种微粒形态,向溶液中逐滴加入
在溶液中存在多种微粒形态,向溶液中逐滴加入 调节
调节 ,得到微粒形态分布优势
,得到微粒形态分布优势 区域如图所示(虚线处表示两种形态的浓度相等),
区域如图所示(虚线处表示两种形态的浓度相等), 、
、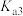 分别表示
分别表示 的第二步、第三步电离平衡常数。下列有关说法错误的是
的第二步、第三步电离平衡常数。下列有关说法错误的是
 在溶液中存在多种微粒形态,向溶液中逐滴加入
在溶液中存在多种微粒形态,向溶液中逐滴加入 调节
调节 ,得到微粒形态分布优势
,得到微粒形态分布优势 区域如图所示(虚线处表示两种形态的浓度相等),
区域如图所示(虚线处表示两种形态的浓度相等), 、
、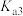 分别表示
分别表示 的第二步、第三步电离平衡常数。下列有关说法错误的是
的第二步、第三步电离平衡常数。下列有关说法错误的是
A. 点对应的溶液中, 点对应的溶液中, |
B.常温下, 的第一步水解平衡常数的数量级为 的第一步水解平衡常数的数量级为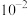 |
C.溶液中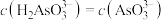 时, 时,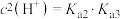 |
D.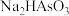 为酸式盐 为酸式盐 |
您最近一年使用:0次
10 . 已知:连二次硝酸( )是二元酸,可用于制取
)是二元酸,可用于制取 气体。在常温下,用
气体。在常温下,用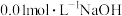 溶液滴定
溶液滴定 溶液,测得溶液的
溶液,测得溶液的 与
与 溶液体积的关系如图所示。
溶液体积的关系如图所示。

回答下列问题。
(1)滴定过程中盛装标准 溶液应选用
溶液应选用________ (填字母)仪器。

(2)常温下, 的
的
________ 。
(3)已知常温下 ,
, 与
与 溶液
溶液________ (填“能”或“不能”)反应。
(4)滴定过程中,由水电离出的 大小关系:
大小关系:
________ (填“>”“<”或“=”) 。
。
(5) 点溶液中
点溶液中
________ (填“>”“<”或“=”) 。
。
(6) 点溶液中含氮粒子浓度由大到小的顺序是
点溶液中含氮粒子浓度由大到小的顺序是________ 。
(7) 点溶液和
点溶液和 溶液混合,可得黄色的
溶液混合,可得黄色的 沉淀,再向该体系中滴加
沉淀,再向该体系中滴加 溶液,此时白色和黄色沉淀共存,该体系中
溶液,此时白色和黄色沉淀共存,该体系中
________ 。[已知 ,
, ]
]
 )是二元酸,可用于制取
)是二元酸,可用于制取 气体。在常温下,用
气体。在常温下,用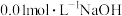 溶液滴定
溶液滴定 溶液,测得溶液的
溶液,测得溶液的 与
与 溶液体积的关系如图所示。
溶液体积的关系如图所示。
回答下列问题。
(1)滴定过程中盛装标准
 溶液应选用
溶液应选用
(2)常温下,
 的
的
(3)已知常温下
 ,
, 与
与 溶液
溶液(4)滴定过程中,由水电离出的
 大小关系:
大小关系:
 。
。(5)
 点溶液中
点溶液中
 。
。(6)
 点溶液中含氮粒子浓度由大到小的顺序是
点溶液中含氮粒子浓度由大到小的顺序是(7)
 点溶液和
点溶液和 溶液混合,可得黄色的
溶液混合,可得黄色的 沉淀,再向该体系中滴加
沉淀,再向该体系中滴加 溶液,此时白色和黄色沉淀共存,该体系中
溶液,此时白色和黄色沉淀共存,该体系中
 ,
, ]
]
您最近一年使用:0次



