1 . 弱电解质的研究是重要课题。
(1)①水溶液中碳元素的存在形态随pH变化如图所示。

下列说法正确的是___________ (填序号)。
a.A点,溶液中H2CO3和 浓度相同
浓度相同
b.pH=8时,溶液中含碳元素的微粒主要是
c.当c( )=c(
)=c( )时,c(H+)>c(OHˉ)
)时,c(H+)>c(OHˉ)
②向上述pH=8.6的水溶液中加入NaOH溶液时,发生反应的离子方程式是___________ 。
(2)碳酸及部分弱酸的电离平衡常数如下表。
①H2S、H2CO3、HClO的酸性由强到弱的顺序为___________ 。
②将少量CO2气体通入NaClO溶液中,写出该反应的离子方程式:___________ 。
(3)25℃,0.01mol·L-1NaClO溶液的pH=___________ ,若从盐类水解原理角度设计一个合理而比较容易进行的方案(药品可任取),证明碳酸是弱电解质,你的设计方案是___________ 。
(1)①水溶液中碳元素的存在形态随pH变化如图所示。

下列说法正确的是
a.A点,溶液中H2CO3和
 浓度相同
浓度相同b.pH=8时,溶液中含碳元素的微粒主要是

c.当c(
 )=c(
)=c( )时,c(H+)>c(OHˉ)
)时,c(H+)>c(OHˉ)②向上述pH=8.6的水溶液中加入NaOH溶液时,发生反应的离子方程式是
(2)碳酸及部分弱酸的电离平衡常数如下表。
| 弱酸 | H2S | H2CO3 | HClO |
| 电离平衡常数(25℃) | K1=1.3×10ˉ7 K2=7.1×10ˉ15 | K1=4.4×10ˉ7 K2=4.7×10ˉ11 | K=1.0×10ˉ8 |
①H2S、H2CO3、HClO的酸性由强到弱的顺序为
②将少量CO2气体通入NaClO溶液中,写出该反应的离子方程式:
(3)25℃,0.01mol·L-1NaClO溶液的pH=
您最近一年使用:0次
名校
2 . 25 ℃时,有 的一组NH3·H2O、NH4Cl混合溶液,溶液中c(NH3·H2O)和
的一组NH3·H2O、NH4Cl混合溶液,溶液中c(NH3·H2O)和 与溶液pH的关系如图所示。下列说法错误的是
与溶液pH的关系如图所示。下列说法错误的是
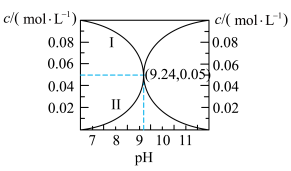
 的一组NH3·H2O、NH4Cl混合溶液,溶液中c(NH3·H2O)和
的一组NH3·H2O、NH4Cl混合溶液,溶液中c(NH3·H2O)和 与溶液pH的关系如图所示。下列说法错误的是
与溶液pH的关系如图所示。下列说法错误的是
A.曲线Ⅰ表示 |
| B.Kb(NH3·H2O)的数量级为10-10 |
C.pH=7时,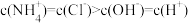 |
| D.pH=9.24时,c(NH3·H2O)=c(Cl-)+c(OH-)-c(H+) |
您最近一年使用:0次
2021-09-11更新
|
1549次组卷
|
9卷引用:第3章 水溶液中的离子平衡(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)
(已下线)第3章 水溶液中的离子平衡(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)河北省张家口市2020-2021学年高二上学期期末教学质量监测化学试题河南省洛阳市2021-2022学年高二上期期中考试化学试题(已下线)3.3.4 溶液中粒子浓度的关系(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)内蒙古自治区包头市第九中学2022-2023学年高二上学期期末考试化学试题重庆市松树桥中学校2023-2024学年高二上学期半期考试(期中)化学试题湖北省武汉市武钢三中2023-2024学年高二上学期12月月考化学试题湖北省武汉市武钢三中2023-2024学年高二上学期12月月考化学试题山西省朔州市怀仁县阳高一中2023-2024学年高二上学期11月化学试卷
名校
解题方法
3 . 结合下表回答下列问题(均为常温下的数据):请回答下列问题:
(1)同浓度的 、
、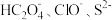 中结合
中结合 的能力最强的
的能力最强的___________ 。
(2)常温下0.1mol/L的 溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。
溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。
(3)取等体积物质的量浓度相等的 、HClO两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:
、HClO两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为: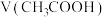
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)在新制氯水中加入少量的NaCl固体,水的电离平衡___________ 移动(填“向右”、“向左”、或“不”)。
(5)某温度下,纯水中的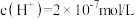 。若温度不变,滴入稀硫酸使
。若温度不变,滴入稀硫酸使 ,则由水电离出的
,则由水电离出的 为
为___________ mol/L。
| 酸 | 电离常数(Ka) |
 | 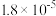 |
| HClO |  |
 |  |
 | 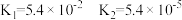 |
 | 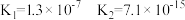 |
(1)同浓度的
 、
、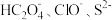 中结合
中结合 的能力最强的
的能力最强的(2)常温下0.1mol/L的
 溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。
溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。A. | B. |
C. | D. |
 、HClO两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:
、HClO两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为: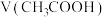
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(4)在新制氯水中加入少量的NaCl固体,水的电离平衡
(5)某温度下,纯水中的
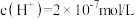 。若温度不变,滴入稀硫酸使
。若温度不变,滴入稀硫酸使 ,则由水电离出的
,则由水电离出的 为
为
您最近一年使用:0次
2021-12-26更新
|
1036次组卷
|
8卷引用:第三章 水溶液中的离子反应与平衡(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)
(已下线)第三章 水溶液中的离子反应与平衡(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)吉林省延边第二中学2020-2021学年高二上学期第二次考试月考化学试题(已下线)专题3.2.1 水的电离和溶液的酸碱性(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)3.2.1 水的电离和溶液的酸碱性-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)浙江省温州市瑞安市上海新纪元高级中学2021-2022学年高二9月份月考(7-13班)化学试题(已下线)3.1.3 水的电离平衡-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)3.2.1 水的电离 溶液的酸碱性(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)吉林省汪清县第六中学2021-2022学年高二12月月考化学试题
4 . 醋酸的电离方程式为
 。25 ℃时,
。25 ℃时, 醋酸溶液中存在下述关系:
醋酸溶液中存在下述关系: ,其数值是该温度下醋酸的电离平衡常数(Ka)。下列说法不正确的是
,其数值是该温度下醋酸的电离平衡常数(Ka)。下列说法不正确的是

 。25 ℃时,
。25 ℃时, 醋酸溶液中存在下述关系:
醋酸溶液中存在下述关系: ,其数值是该温度下醋酸的电离平衡常数(Ka)。下列说法不正确的是
,其数值是该温度下醋酸的电离平衡常数(Ka)。下列说法不正确的是A. 的 的 溶液中的 溶液中的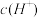 约为 约为 |
B.等物质的量浓度的 溶液与 溶液与 溶液(25 ℃时, 溶液(25 ℃时,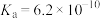 ),则 ),则 |
C.该温度下 醋酸溶液 醋酸溶液 |
D.升高温度, 增大, 增大, 变大 变大 |
您最近一年使用:0次
2021-08-07更新
|
1337次组卷
|
6卷引用:第三章 水溶液中的离子反应与平衡(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)
(已下线)第三章 水溶液中的离子反应与平衡(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)选择性必修1 专题3 第一单元 弱电解质的电离平衡(已下线)专题3.1 电离平衡(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)3.1.2 电离平衡常数(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)3.2.2 电离平衡常数(教师版)-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)3.1.1强电解质和弱电解质 弱电解质的电离平衡 课中
解题方法
5 . 室温下,向某Na2CO3和NaHCO3的混合溶液中逐滴加入BaCl2溶液,溶液中lgc(Ba2+)与 的变化关系如图所示。下列说法错误的是
的变化关系如图所示。下列说法错误的是
(已知:H2CO3的Ka1、Ka2分别为4.2×10-7、5.6×10-11)
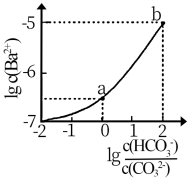
 的变化关系如图所示。下列说法错误的是
的变化关系如图所示。下列说法错误的是(已知:H2CO3的Ka1、Ka2分别为4.2×10-7、5.6×10-11)

| A.a对应溶液的pH大于b |
| B.b对应溶液的c(H+)=5.6×10-13 mol·L-1 |
C.a对应的溶液中一定存在:2c(Ba2+)+c(Na+)+c(H+)=3c(HCO )+c(Cl-)+c(OH-) )+c(Cl-)+c(OH-) |
D.a→b对应的溶液中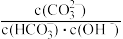 不变 不变 |
您最近一年使用:0次
2021-08-05更新
|
998次组卷
|
3卷引用:第3章 水溶液中的离子反应与平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)
(已下线)第3章 水溶液中的离子反应与平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)安徽省芜湖市第三中学2020-2021学年高二下学期期末调研测试化学试题2021年湖北高考化学试题变式题11-19
名校
6 . 下表是几种常见弱酸的电离平衡常数(25℃),回答下列各题:
(1)当温度升高时, 值
值___________ (填“增大”、“减小”或“不变”);
(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,酸性最弱、最强的酸分别是___________ 、___________ (用化学式表示),
②下列能使醋酸溶液中 的电离程度增大,而电离平衡常数不变的操作是
的电离程度增大,而电离平衡常数不变的操作是___________ (填序号),
A.升高温度 B.加水稀释 C.加少量的 固体 D.加少量冰醋酸 E.加氢氧化钠固体
固体 D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式___________ 。
(3)已知草酸是一种二元弱酸,其电离常数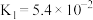 ,
,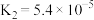 ,写出草酸的电离方程式
,写出草酸的电离方程式___________ 、___________ ,试从电离平衡移动的角度解释 的原因
的原因___________ 。
(4)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实___________ (填“能”或“不能”)比较醋酸与碳酸的酸性强弱,请设计一个简单的实验验证醋酸与碳酸的酸性强弱。方案:___________ 。
| 酸 |  |  | HCN | HClO |
电离平衡常数( ) ) |  |  | 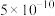 |  |
 值
值(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,酸性最弱、最强的酸分别是
②下列能使醋酸溶液中
 的电离程度增大,而电离平衡常数不变的操作是
的电离程度增大,而电离平衡常数不变的操作是A.升高温度 B.加水稀释 C.加少量的
 固体 D.加少量冰醋酸 E.加氢氧化钠固体
固体 D.加少量冰醋酸 E.加氢氧化钠固体③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式
(3)已知草酸是一种二元弱酸,其电离常数
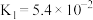 ,
,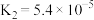 ,写出草酸的电离方程式
,写出草酸的电离方程式 的原因
的原因(4)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实
您最近一年使用:0次
2021-07-22更新
|
2070次组卷
|
7卷引用:第三章 水溶液中的离子反应与平衡(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)
(已下线)第三章 水溶液中的离子反应与平衡(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)内蒙古赤峰市2020-2021学年高二下学期期末考试化学(B)试题。(已下线)专题3.1 电离平衡(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)3.1.2 电离平衡常数-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)3.1.2 电离平衡常数(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)考点26 弱电解质的电离-备战2023年高考化学一轮复习考点帮(全国通用)甘肃省张掖市高台县第一中学2022--2023学年高二上学期10月模拟考试化学试题
名校
7 . 常温下,用10mL0.1mol·L-1Na2A溶液吸收H2A气体,吸收液的pH与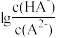 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
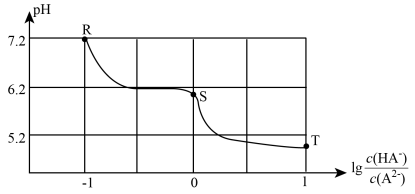
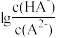 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
| A.在R、S、T点对应溶液中,水的电离程度最小的是R点 |
| B.常温下,H2A第二步电离的平衡常数为Ka2=1.0×10–6.2 |
| C.T、S之间某点对应的溶液中存在:c(Na+)=c(HA-)+2c(A2-) |
| D.T点对应的溶液中:c(Na+)>c(A2-)>c(HA-)>c(H+)>c(OH-) |
您最近一年使用:0次
名校
解题方法
8 . (1)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
a.当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是_______ (用字母表示,下同)。
b.同体积、同物质的量浓度的三种酸,中和NaOH 的能力由大到小的顺序是_______ 。
c.若三者c(H+)相同时,物质的量浓度由大到小的顺序是_______ 。
d.将c(H+)相同且体积也相同的三种酸,分别与等浓度的NaOH稀溶液反应至pH=7,则消耗NaOH溶液液的体积大小关系为_______ 。
e.将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是_______ 。
(2)当H2S浓度较低时常用纯碱溶液进行吸收。表为H2S、H2CO3 的电离平衡常数。
纯碱溶液吸收少量H2S的离子方程式为_______ 。
(3)磷酸是三元弱酸,常温下三级电离常数分别是Ka1=7.1×10-3,Ka2=6.2×10-8,Ka3=4.5×10-13,解答下列问题:
a.常温下同浓度①Na3PO4、②Na2HPO4、③NaH2PO4的pH由小到大的顺序是_______ (填序号)。
b.常温下,NaH2PO4的水溶液pH_______ (填“>”“<”或“=”)7。
c.常温下,Na2HPO4的水溶液呈_______ (填“酸”“碱”或“中”)性
a.当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是
b.同体积、同物质的量浓度的三种酸,中和NaOH 的能力由大到小的顺序是
c.若三者c(H+)相同时,物质的量浓度由大到小的顺序是
d.将c(H+)相同且体积也相同的三种酸,分别与等浓度的NaOH稀溶液反应至pH=7,则消耗NaOH溶液液的体积大小关系为
e.将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是
(2)当H2S浓度较低时常用纯碱溶液进行吸收。表为H2S、H2CO3 的电离平衡常数。
| 电离平衡常数 | Kal | Ka2 |
| H2S | 9.1×10-8 | 1.1×10-12 |
| H2CO3 | 4.3×10-7 | 5.61×10-11 |
纯碱溶液吸收少量H2S的离子方程式为
(3)磷酸是三元弱酸,常温下三级电离常数分别是Ka1=7.1×10-3,Ka2=6.2×10-8,Ka3=4.5×10-13,解答下列问题:
a.常温下同浓度①Na3PO4、②Na2HPO4、③NaH2PO4的pH由小到大的顺序是
b.常温下,NaH2PO4的水溶液pH
c.常温下,Na2HPO4的水溶液呈
您最近一年使用:0次
9 . (1)某温度(t℃)时,水的Kw=1×10-12,则该温度___________ (填“>”“<”或“=”)25℃,其理由是___________ 。
(2)该温度下,c(H+)=1×10-7mol·L-1的溶液呈___________ (填“酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=___________ mol·L-1。
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡___________ (填“向左”“向右”或“不”,下同)移动。在新制氯水中加入少量NaCl固体,水的电离平衡___________ 移动。
(4)25℃时,0.1mol·L-1下列物质的溶液,水电离出的c(H+)由大到小的关系是___________ (填序号)。
①HCl②H2SO4③CH3COOH(Ka=1.7×10-5)④NH3·H2O(Kb=1.7×10-5)⑤NaOH⑥Ba(OH)2
(5)25℃时,pH=4的盐酸中水的电离程度___________ pH=10的Ba(OH)2溶液中水的电离程度。
(2)该温度下,c(H+)=1×10-7mol·L-1的溶液呈
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
(4)25℃时,0.1mol·L-1下列物质的溶液,水电离出的c(H+)由大到小的关系是
①HCl②H2SO4③CH3COOH(Ka=1.7×10-5)④NH3·H2O(Kb=1.7×10-5)⑤NaOH⑥Ba(OH)2
(5)25℃时,pH=4的盐酸中水的电离程度
您最近一年使用:0次
2021-04-16更新
|
1598次组卷
|
5卷引用:第3章 水溶液中的离子平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)
(已下线)第3章 水溶液中的离子平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)第三章 水溶液中的离子反应与平衡(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)广西贵港市立德高级中学2020-2021学年高二下学期3月月考化学试题(已下线)3.2.2 溶液的pH(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)山东省滨州市沾化区实验高级中学2022-2023学年高二10月月考化学试题
10 . 回答下列问题:
(1)为了证明醋酸是弱电解质,某同学分别取pH=3醋酸和盐酸各1mL,分别用蒸馏水稀释到100mL,然后用pH试纸分别测定两溶液的pH,则可认定醋酸是弱电解质,判断的依据是_______ 。
(2)已知室温时,0.1 mol∙L−1某一元酸HA在水中有0.1%发生电离,回答下列问题:
①该溶液中c(H+)=_______ mol∙L−1。
②HA的电离平衡常数K=_______ 。
③由HA电离出的c(H+)约为水电离出的c(H+)的_______ 倍。
(3)部分弱酸的电离平衡常数如下表:
①在相同浓度的HCOOH和HClO的溶液中,用“>”“<”或“=”填空。
溶液导电能力:HCOOH_______ HClO。
② 的电离平衡常数表达式为
的电离平衡常数表达式为_______
③将少量CO2气体通入NaClO溶液中,写出该反应离子方程式_______ 。
(4)某浓度的氨水中存在平衡:NH3·H2O
 +OH-,如想增大
+OH-,如想增大 的浓度而不增大OH-的浓度,应采取的措施是
的浓度而不增大OH-的浓度,应采取的措施是_______ (填字母)。
a.适当升高温度 b.加入NH4Cl固体 c.通入NH3 d.加入少量浓盐酸
(1)为了证明醋酸是弱电解质,某同学分别取pH=3醋酸和盐酸各1mL,分别用蒸馏水稀释到100mL,然后用pH试纸分别测定两溶液的pH,则可认定醋酸是弱电解质,判断的依据是
(2)已知室温时,0.1 mol∙L−1某一元酸HA在水中有0.1%发生电离,回答下列问题:
①该溶液中c(H+)=
②HA的电离平衡常数K=
③由HA电离出的c(H+)约为水电离出的c(H+)的
(3)部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | H2CO3 | HClO |
电离平衡常数/25 ℃ | K=1.77×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
溶液导电能力:HCOOH
②
 的电离平衡常数表达式为
的电离平衡常数表达式为③将少量CO2气体通入NaClO溶液中,写出该反应离子方程式
(4)某浓度的氨水中存在平衡:NH3·H2O

 +OH-,如想增大
+OH-,如想增大 的浓度而不增大OH-的浓度,应采取的措施是
的浓度而不增大OH-的浓度,应采取的措施是a.适当升高温度 b.加入NH4Cl固体 c.通入NH3 d.加入少量浓盐酸
您最近一年使用:0次



