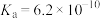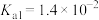1 . 25℃时,草酸的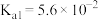 ,
, 。下列说法正确的是
。下列说法正确的是
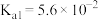 ,
, 。下列说法正确的是
。下列说法正确的是A.  溶液中: 溶液中: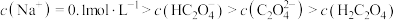 |
B.向 的 的 溶液中通入 溶液中通入 气体(忽略溶液体积的变化)至 气体(忽略溶液体积的变化)至 ,溶液 ,溶液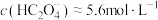 |
C.向 溶液中加入 溶液中加入 溶液至 溶液至 ,则 ,则 |
D.取 的 的 溶液10mL,加蒸馏水稀释至100mL,则该溶液 溶液10mL,加蒸馏水稀释至100mL,则该溶液 |
您最近一年使用:0次
2 . 已知25℃时,部分物质的电离常数如下表所示。
(1)根据表中数据,将 的下列三种酸溶液分别稀释100倍,pH变化最小的是
的下列三种酸溶液分别稀释100倍,pH变化最小的是________ 。
a. b.HCN C.
b.HCN C.
(2)常温下,0.1mol/L的 溶液和0.1mol/LHCOONa溶液相比.
溶液和0.1mol/LHCOONa溶液相比.

________ 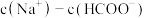 (填“<”“<”=或“>”)。
(填“<”“<”=或“>”)。
(3)下列说法正确的是________。
(4)已知常温下0.1mol/L的 和
和 的pH分别为8.9和8.3,而水解常数
的pH分别为8.9和8.3,而水解常数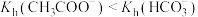 ,则
,则 溶液pH更小的原因是
溶液pH更小的原因是________ 。
HCOOH |
| HCN |
|
|
|
|
|
|
|
 的下列三种酸溶液分别稀释100倍,pH变化最小的是
的下列三种酸溶液分别稀释100倍,pH变化最小的是a.
 b.HCN C.
b.HCN C.
(2)常温下,0.1mol/L的
 溶液和0.1mol/LHCOONa溶液相比.
溶液和0.1mol/LHCOONa溶液相比.
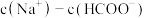 (填“<”“<”=或“>”)。
(填“<”“<”=或“>”)。(3)下列说法正确的是________。
A. 溶液中加入少量水,则溶液中 溶液中加入少量水,则溶液中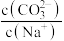 将减小 将减小 |
B.等物质的量浓度的 与 与 混合液中, 混合液中, |
C.向KCN溶液中通入少量 气体发生反应的离子方程式为: 气体发生反应的离子方程式为: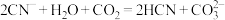 |
D.常温下,将 通入NaOH溶液中,当 通入NaOH溶液中,当 降至 降至 时,溶液中的 时,溶液中的 |
 和
和 的pH分别为8.9和8.3,而水解常数
的pH分别为8.9和8.3,而水解常数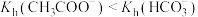 ,则
,则 溶液pH更小的原因是
溶液pH更小的原因是
您最近一年使用:0次
3 . 常温下,用0.1000mol/L的NaOH溶液滴定20mL0.1000mol/L的二元弱酸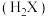 溶液,所得溶液中各种含X的微粒的物质的量分数
溶液,所得溶液中各种含X的微粒的物质的量分数 与pH的变化曲线如图所示。下列叙述不正确的是
与pH的变化曲线如图所示。下列叙述不正确的是
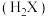 溶液,所得溶液中各种含X的微粒的物质的量分数
溶液,所得溶液中各种含X的微粒的物质的量分数 与pH的变化曲线如图所示。下列叙述不正确的是
与pH的变化曲线如图所示。下列叙述不正确的是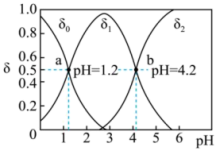
A.加入20mLNaOH溶液时,溶液中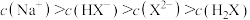 |
B.由图可知 的水解常数 的水解常数 为 为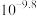 |
C.b点对应的溶液中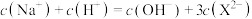 |
D.将等物质的量的NaHX、 溶于水中,所得溶液pH恰好为4.2 溶于水中,所得溶液pH恰好为4.2 |
您最近一年使用:0次
解题方法
4 . 根据下列图示所得出的结论不正确的是
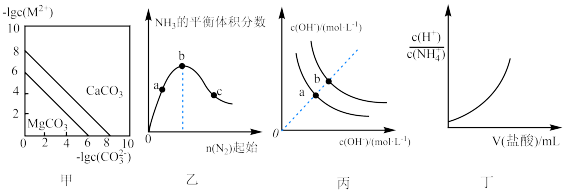
A.图甲表示一定温度下,MCO3(M:Mg2+、Ca2+)的沉淀溶解平衡曲线,则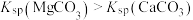 |
B.图乙是H2的起始量一定时恒温密闭容器中发生:N2(g)+3H2(g) 2NH3(g)反应,达到平衡时NH3的体积分数随N2的起始物质的量的变化曲线,则H2的转化率:b>c>a 2NH3(g)反应,达到平衡时NH3的体积分数随N2的起始物质的量的变化曲线,则H2的转化率:b>c>a |
| C.图丙表示不同温度下溶液中H+和OH-的浓度变化曲线,图中a点对应温度低于b点 |
D.图丁投示向0.lmol/L的NH4Cl溶液中滴加0.1mol/L的盐酸,溶液中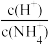 随盐酸的体积变化关系 随盐酸的体积变化关系 |
您最近一年使用:0次
5 . 下表是几种常见弱酸的电离平衡常数(25℃)。
回答下列各题:
(1)当温度升高时, 值
值_____ (填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的 值不同,那么
值不同,那么 值的大小与酸性的相对强弱有何关系?
值的大小与酸性的相对强弱有何关系?_____ 。
(3)若把 都看作是酸,其中酸性最强的是
都看作是酸,其中酸性最强的是_____ ,最弱的是_____ 。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数。对于同一种多元弱酸的 、
、 、
、 之间存在着数量上的规律,此规律是
之间存在着数量上的规律,此规律是_____ ,产生此规律的原因是_____ 。
(5)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实_____ (填“能”或“不能”)比较醋酸与碳酸的酸性强弱,请设计一个简单的实验验证醋酸与碳酸的酸性强弱。方案:_____ 。
| 酸 | 电离方程式 | 电离平衡常数K |
 |  |  |
 |   | 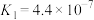  |
 | 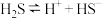  | 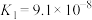 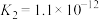 |
 | 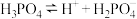   | 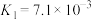 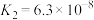 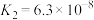 |
(1)当温度升高时,
 值
值(2)在温度相同时,各弱酸的
 值不同,那么
值不同,那么 值的大小与酸性的相对强弱有何关系?
值的大小与酸性的相对强弱有何关系?(3)若把
 都看作是酸,其中酸性最强的是
都看作是酸,其中酸性最强的是(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数。对于同一种多元弱酸的
 、
、 、
、 之间存在着数量上的规律,此规律是
之间存在着数量上的规律,此规律是(5)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实
您最近一年使用:0次
6 . 下列有关电解质溶液的说法不正确的是
A.向0.1 的氨水中加入少量水,溶液中 的氨水中加入少量水,溶液中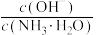 增大 增大 |
B.将 溶液从20℃升温至30℃,溶液中 溶液从20℃升温至30℃,溶液中 增大 增大 |
C.向氢氧化钠溶液中加入醋酸溶液至中性,溶液中 |
D.向 的饱和溶液中加入 的饱和溶液中加入 固体,溶液中的 固体,溶液中的 |
您最近一年使用:0次
解题方法
7 . 研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)25℃时对氨水进行如下操作,请填写下列空白。
①若向氨水中加入少量硫酸铵固体,则溶液中 将
将__________ (填“增大”“减小”或“不变”)。
②若向氨水中加入稀盐酸,使氨水恰好被中 和,则此时溶液显___________ (填“酸性”“碱性”或“中性”),用离子方程式表示其原因_________________ ,此溶液中离子的浓度大小顺序为___________
③在浓度为 的氨水中加入等体积
的氨水中加入等体积 的
的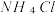 溶液,已知
溶液,已知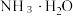 的电离常数为
的电离常数为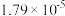 ,此时混合溶液显
,此时混合溶液显___________ (填“酸性”“碱性”或“中性”),此溶液中离子的浓度大小顺序为 ______
(2)常温下,几种弱酸的电离平衡常数如下表所示,回答下列问题:
①上述四种酸酸性由强到弱的顺序为___________ ;
②将少量的CO2通入NaClO溶液中,反应的离子方程式:___________ 。
(1)25℃时对氨水进行如下操作,请填写下列空白。
①若向氨水中加入少量硫酸铵固体,则溶液中
 将
将②若向氨水中加入稀盐酸,使氨水恰好被
③在浓度为
 的氨水中加入等体积
的氨水中加入等体积 的
的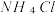 溶液,已知
溶液,已知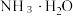 的电离常数为
的电离常数为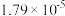 ,此时混合溶液显
,此时混合溶液显(2)常温下,几种弱酸的电离平衡常数如下表所示,回答下列问题:
| 化学式 | HCOOH | H2CO₃ | HCN | HClO |
| 电离平衡常数 | K=1.8×10⁻⁴ | K₁=4.3×10⁻⁷;K2=5.6×10⁻¹¹ | K=4.9×10⁻¹⁰ | K=4.7×10⁻⁸ |
②将少量的CO2通入NaClO溶液中,反应的离子方程式:
您最近一年使用:0次
8 . 室温下,向某Na2CO3和NaHCO3的混合溶液中逐滴加入BaCl2溶液。溶液中lgc(Ba2+)与lg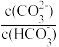 的变化关系如图所示[已知室温下:H2CO3的Ka1、Ka2分别为4.2×10-7、5.6×10-11,Ksp(BaCO3)=2.6×10-9]。下列说法错误的是
的变化关系如图所示[已知室温下:H2CO3的Ka1、Ka2分别为4.2×10-7、5.6×10-11,Ksp(BaCO3)=2.6×10-9]。下列说法错误的是
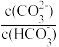 的变化关系如图所示[已知室温下:H2CO3的Ka1、Ka2分别为4.2×10-7、5.6×10-11,Ksp(BaCO3)=2.6×10-9]。下列说法错误的是
的变化关系如图所示[已知室温下:H2CO3的Ka1、Ka2分别为4.2×10-7、5.6×10-11,Ksp(BaCO3)=2.6×10-9]。下列说法错误的是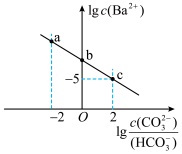
| A.a、b、c三点中,pH最大的是a |
B.b点溶液中存在:2c(Ba2+)+c(Na+)+c(H+)=3c( )+c(Cl-)+c(OH-) )+c(Cl-)+c(OH-) |
C.a→b对应的溶液中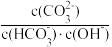 的值始终不变 的值始终不变 |
D.c点对应溶液中,c( )的数量级为10-6 )的数量级为10-6 |
您最近一年使用:0次
2024-04-14更新
|
72次组卷
|
2卷引用:安徽省合肥八中教育集团铭传高级中学2023-2024学年高二上学期期末检测化学试题
名校
解题方法
9 .  是最简单的有机羧酸,常作抗菌剂和化工原料。回答下列问题:
是最简单的有机羧酸,常作抗菌剂和化工原料。回答下列问题:
(1)已知:①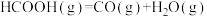
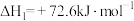
②
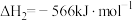
③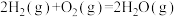
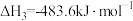
则 的
的
_______  。
。
(2)恒温恒容条件下,向密闭容器中充入1
 和2
和2
 合成
合成 ,下列叙述正确的是_______(填字母)。
,下列叙述正确的是_______(填字母)。
(3)一定温度下,保持总压强为2.0 ,向密闭容器中充入1
,向密闭容器中充入1
 和1.6
和1.6
 ,发生反应:
,发生反应: 、
、 。反应达到平衡时
。反应达到平衡时 的转化率为50%,
的转化率为50%, 的选择性为80%(已知:甲酸的选择性
的选择性为80%(已知:甲酸的选择性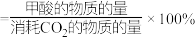 。该温度下,
。该温度下, 的平衡常数
的平衡常数
_______  。
。
(4)常温下,向 溶液中滴加
溶液中滴加 溶液。溶液的
溶液。溶液的 与
与 的关系如图所示。
的关系如图所示。
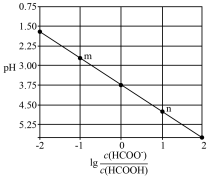
则
_______ ,n点溶液中离子浓度由大到小的排序为_______ 。
(5)常温下,已知 一元酸HCOOH(甲酸)溶液中
一元酸HCOOH(甲酸)溶液中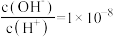 。
。
①
 的
的
_______ 。
②取10mL0.1mol/L的HCOOH溶液稀释100倍,有关说法正确的是_______ (填序号)
A.所有离子的浓度在稀释过程中都会减少
B.稀释后溶液的
C.稀释后甲酸的电离度会增大
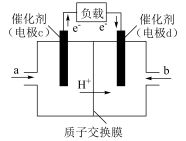
(6)C2H5OH可作为燃料使用,用C2H5OH和O2组合形成的质子交换膜燃料电池如图。则d电极是_______ (填“正极”或“负极”),c电极的电极反应式为_______ 。
 是最简单的有机羧酸,常作抗菌剂和化工原料。回答下列问题:
是最简单的有机羧酸,常作抗菌剂和化工原料。回答下列问题:(1)已知:①
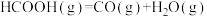
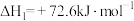
②

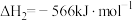
③
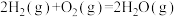
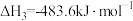
则
 的
的
 。
。(2)恒温恒容条件下,向密闭容器中充入1

 和2
和2
 合成
合成 ,下列叙述正确的是_______(填字母)。
,下列叙述正确的是_______(填字母)。| A.气体压强不随时间变化时达到平衡状态 |
B.平衡时 的最大体积分数为50% 的最大体积分数为50% |
C.平衡后及时移走 ,平衡常数增大 ,平衡常数增大 |
D.平衡后再充入 , , 的平衡转化率增大 的平衡转化率增大 |
(3)一定温度下,保持总压强为2.0
 ,向密闭容器中充入1
,向密闭容器中充入1
 和1.6
和1.6
 ,发生反应:
,发生反应: 、
、 。反应达到平衡时
。反应达到平衡时 的转化率为50%,
的转化率为50%, 的选择性为80%(已知:甲酸的选择性
的选择性为80%(已知:甲酸的选择性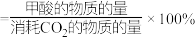 。该温度下,
。该温度下, 的平衡常数
的平衡常数
 。
。(4)常温下,向
 溶液中滴加
溶液中滴加 溶液。溶液的
溶液。溶液的 与
与 的关系如图所示。
的关系如图所示。
则

(5)常温下,已知
 一元酸HCOOH(甲酸)溶液中
一元酸HCOOH(甲酸)溶液中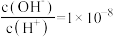 。
。①

 的
的
②取10mL0.1mol/L的HCOOH溶液稀释100倍,有关说法正确的是
A.所有离子的浓度在稀释过程中都会减少
B.稀释后溶液的

C.稀释后甲酸的电离度会增大
(6)C2H5OH可作为燃料使用,用C2H5OH和O2组合形成的质子交换膜燃料电池如图。则d电极是

您最近一年使用:0次
名校
10 . 以酚酞为指示剂,用 溶液滴定
溶液滴定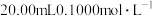 一元酸的
一元酸的 溶液。
溶液。 、
、 的物质的量分数
的物质的量分数 、溶液的
、溶液的 随
随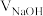 的变化关系如图所示[已知
的变化关系如图所示[已知 ]。下列叙述正确的是
]。下列叙述正确的是

 溶液滴定
溶液滴定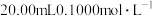 一元酸的
一元酸的 溶液。
溶液。 、
、 的物质的量分数
的物质的量分数 、溶液的
、溶液的 随
随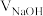 的变化关系如图所示[已知
的变化关系如图所示[已知 ]。下列叙述正确的是
]。下列叙述正确的是
A.曲线①代表 ,曲线②代表 ,曲线②代表 |
B.HA的电离平衡常数 |
C.加入 时, 时, |
D.滴定终点时, |
您最近一年使用:0次