解题方法
1 . 从铜电解液中分离得到的粗硫酸镍晶体中含有大量的杂质元素(Cu、Fe、As、Ca、Zn等),我国科学家对粗硫酸镍进行精制提纯,其工艺流程如下。

已知:i.含镍溶液中的主要离子有:Ni2+、SO 、Cu2+、Fe2+、AsO
、Cu2+、Fe2+、AsO 、Ca2+和Zn2+
、Ca2+和Zn2+
ii.饱和H2S溶液中,c(H2S)≈0.1mol/L
ⅲ.部分物质的电离常数和溶度积常数如下表
(1)H2S是弱电解质,Ka1×Ka2=_______ [用c(H2S)、c(H+)和c(S2−)表示]=1.43×10−20。
(2)滤渣1中含有As2S3和S,写出生成As2S3和S的离子方程式_______ 。
(3)解释“氧化除杂”中析出Fe(OH)3的原因_______ 。
(4)“氟化除杂”中试剂a为_______ 。
(5)“P204萃取”水溶液的pH约为3.3,结合下图解释原因_______ 。

(6)理论上“硫化除杂”之后,溶液中c(Cu2+)=_______ mol/L[计算时c(H2S)取0.1mol/L,结果保留两位有效数字]。

已知:i.含镍溶液中的主要离子有:Ni2+、SO
 、Cu2+、Fe2+、AsO
、Cu2+、Fe2+、AsO 、Ca2+和Zn2+
、Ca2+和Zn2+ii.饱和H2S溶液中,c(H2S)≈0.1mol/L
ⅲ.部分物质的电离常数和溶度积常数如下表
| 物质 | 电离常数 | 物质 | 溶度积常数 | 物质 | 溶度积常数 |
| H2S | Ka1=1.1×10−7 Ka2=1.3×10−13 | CuS | 6.3×10−36 | FeS | 6.3×10−18 |
| NiS | 3.2×10−19 | Ni(OH)2 | 5.5×10−16 | ||
| CaF2 | 4×10−11 | Fe(OH)3 | 2.8×10−39 |
(2)滤渣1中含有As2S3和S,写出生成As2S3和S的离子方程式
(3)解释“氧化除杂”中析出Fe(OH)3的原因
(4)“氟化除杂”中试剂a为
(5)“P204萃取”水溶液的pH约为3.3,结合下图解释原因

(6)理论上“硫化除杂”之后,溶液中c(Cu2+)=
您最近一年使用:0次
2022-04-02更新
|
388次组卷
|
2卷引用:北京市石景山区2022届高三一模化学试题
名校
2 .  是一种优良的水处理剂。25℃,其水溶液中加酸加碱改变溶液的pH时,含R粒子的物质的量分数
是一种优良的水处理剂。25℃,其水溶液中加酸加碱改变溶液的pH时,含R粒子的物质的量分数 [
[ ]随pH的变化如图所示。下列说法不正确的是
]随pH的变化如图所示。下列说法不正确的是

 是一种优良的水处理剂。25℃,其水溶液中加酸加碱改变溶液的pH时,含R粒子的物质的量分数
是一种优良的水处理剂。25℃,其水溶液中加酸加碱改变溶液的pH时,含R粒子的物质的量分数 [
[ ]随pH的变化如图所示。下列说法不正确的是
]随pH的变化如图所示。下列说法不正确的是
A.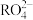 中R为 中R为 价,pH>6时溶液中存在 价,pH>6时溶液中存在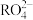 |
| B.水的电离程度:M<N |
C.溶液中存在: |
D.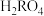 的第一步电离平衡常数 的第一步电离平衡常数 |
您最近一年使用:0次
2022-03-01更新
|
1125次组卷
|
9卷引用:北京市通州区2022届高三查缺补漏化学试题
北京市通州区2022届高三查缺补漏化学试题北京市顺义牛栏山第一中学2022届高三下学期保温练习化学试题广东省汕头市2022届高三下学期第一次模拟考试化学试题(已下线)【直击双一流】07-备战2022年高考化学名校进阶模拟卷(通用版)广东省揭阳市、丰顺2022届高三下学期3月联考化学试题(已下线)专项13 水溶液中的离子平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)(已下线)押广东卷化学第8题 电解质溶液-备战2022年高考化学临考题号押题(广东卷)浙江省杭州第四中学2022-2023学年高二上学期期中考试 化学试题
名校
3 . 下列说法正确 的是
| A.测得0.1mol·L-1的一元碱ROH溶液pH=12,则ROH一定为弱电解质 |
| B.25℃时,可溶性正盐BA溶液pH=a,升温至某一温度后pH仍为a,则BA可能为强碱弱酸盐 |
| C.25℃时,测得0.1mol·L-1的一元酸HA溶液pH=b,将该溶液加水稀释100倍,所得溶液的pH=b+2,则HA为弱酸 |
| D.25℃时,pH=1的HA溶液与pH=13的NaOH溶液等体积混合,所得溶液pH一定等于7.0 |
您最近一年使用:0次
2022-01-03更新
|
718次组卷
|
6卷引用:一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)
(已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)浙江省杭州学军中学2021-2022学年高三上学期12月适应性考试化学试题(已下线)解密10 水溶液中的离子平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)微专题37 强弱电解质的判断与比较-备战2023年高考化学一轮复习考点微专题浙江省宁波市北仑中学2023-2024学年高二上学期期中考试化学试题
名校
4 . 室温下,将两种浓度均为0.10 mol·L-1的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是
A.NaHCO3—Na2CO3混合溶液(pH=10.30):c(Na+)=c(H2CO3) +c( )+c( )+c( ) ) |
B.氨水—NH4Cl混合溶液(pH=9.25):c( )+c(H+)=c(NH3·H2O)+c(OH- ) )+c(H+)=c(NH3·H2O)+c(OH- ) |
| C.CH3COOH—CH3COONa混合溶液(pH=4.76) :c(Na+)> c(CH3COOH)>c(CH3COO- )>c(H+) |
D.H2C2O4—NaHC2O4混合溶液(pH=1.68, H2C2O4为二元弱酸): c( ) + 2c( ) + 2c( )> 0.05 mol·L-1 )> 0.05 mol·L-1 |
您最近一年使用:0次
5 . 醋酸的电离方程式为CH3COOH(aq)⇌CH3COO-(aq)+H+(aq) ΔH>0,25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=1.75×10-5,是该温度下醋酸的电离平衡常数(Ka)。下列说法不正确的是
| A.向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)增大 |
| B.向该溶液中加少量CH3COONa固体,平衡逆向移动 |
| C.该温度下0.01mol/L醋酸溶液Ka<1.75×10-5 |
| D.升高温度,c(H+)增大,Ka变大 |
您最近一年使用:0次
2021-10-18更新
|
1156次组卷
|
7卷引用:2020年北京高考化学真题变式题1-10
2020年北京高考化学真题变式题1-10吉林省长春北师大附属学校2021-2022学年高二上学期第一次月考化学试题(已下线)必考点05 电离平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)四川省绵阳南山中学2021-2022学年高二上学期12月月考化学试题河北省衡水市第十四中学(西校区)2021-2022学年高二上学期二调考试化学试题广东深圳市第二外国语学校2021-2022学年高二上学期期中测试化学试题广东省潮州湘桥区南春中学2021-2022学年高二上学期期中考试化学试题
名校
6 .  时,
时, 草酸
草酸 溶液中各微粒的物质的量浓度如下:
溶液中各微粒的物质的量浓度如下:
下列关系不能 说明草酸的第二步电离比第一步电离更难的是
 时,
时, 草酸
草酸 溶液中各微粒的物质的量浓度如下:
溶液中各微粒的物质的量浓度如下:| 微粒 | 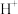 |  |  |  |
 |  | 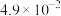 |  | 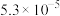 |
A. 大于 大于 |
B.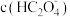 大于 大于 |
C. 远远大于 远远大于 |
D. 约等于 约等于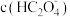 |
您最近一年使用:0次
2021-05-18更新
|
319次组卷
|
4卷引用:北京市东城区2021届高三综合练习(二)化学试题
北京市东城区2021届高三综合练习(二)化学试题(已下线)2021年高考化学押题预测卷(北京卷)(02)北京市房山区2022-2023学年高三上学期期末考试化学试题北京市广渠门中学2023-2024学年高二上学期期中考试化学试题
名校
7 . 常温下,CH3COOH、HCOOH(甲酸)的电离常数数值分别为1.7×10-5、1.8×10-4,以下关于0.1mol/LCH3COOH溶液、0.1mol/LHCOOH溶液的说法正确的是
| A.c(H+):CH3COOH>HCOOH |
| B.等体积的两溶液中,分别加入过量的镁,产生氢气的体积:HCOOH>CH3COOH |
| C.HCOOH可能与NaOH发生反应:H++OH-=H2O |
D.将CH3COOH溶液稀释100倍过程中, 保持不变 保持不变 |
您最近一年使用:0次
2021-05-10更新
|
673次组卷
|
7卷引用:北京市昌平区2021届高三下学期二模考试化学试题
北京市昌平区2021届高三下学期二模考试化学试题(已下线)2021年高考化学押题预测卷(北京卷)(03)(已下线)第23讲 弱电解质的电离平衡(精讲)-2022年一轮复习讲练测(已下线)第23讲 弱电解质的电离平衡(讲)-2023年高考化学一轮复习讲练测(全国通用)新疆乌鲁木齐市第一中学2022-2023学年高二上学期期中考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第46练 弱电解质的电离平衡黑龙江省双鸭山市第三十一中学2023-2024学年高三上学期12月期中化学试题
解题方法
8 . 室温下,下列说法不正确 的是
| A.中和等体积、等pH的CH3COOH溶液和盐酸,CH3COOH消耗的NaOH多 |
| B.pH=9的CH3COONa溶液与pH=5的CH3COOH溶液,水的电离程度相同 |
| C.将0.2mol·L-1的CH3COOH溶液稀释一倍,CH3COOH的电离程度增大 |
| D.等体积、等浓度的CH3COOH溶液和NaOH溶液混合后,溶液中微粒浓度存在如下关系:c(OH-)=c(CH3COOH)+c(H+) |
您最近一年使用:0次
9 . 对下列溶液的有关判断不正确 的
A.同温同浓度的 溶液和 溶液和 溶液的 溶液的 值,前者大于后者,则酸性: 值,前者大于后者,则酸性: |
B.常温时,向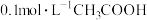 溶液中加水稀释,溶液中 溶液中加水稀释,溶液中 减小 减小 |
C.向盐酸中滴加氨水至中性时,溶液中 |
D.随温度升高, 溶液的 溶液的 略有降低,不能说明溶液中 略有降低,不能说明溶液中 减小 减小 |
您最近一年使用:0次
2021-03-26更新
|
310次组卷
|
2卷引用:北京市平谷区2021届高三下学期质量监控(零模)化学试题
10 . 实验测得10 mL 0.50 mol·L-1NH4Cl溶液、10 mL 0.50mol·L-1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25 ℃时CH3COOH和NH3·H2O的电离常数均为1.8×10-5.下列说法不正确 的是
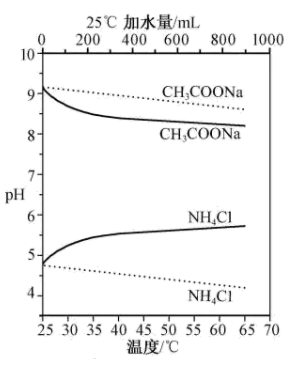

| A.图中 |
B.将NH4Cl溶液加水稀释至浓度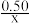 mol·L-1,溶液pH变化值小于lgx mol·L-1,溶液pH变化值小于lgx |
| C.随温度升高,Kw增大,CH3COONa溶液中c(OH- )减小,c(H+)增大,pH减小 |
D.25 ℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+ )-c(CH3COO- )=c(Cl-)-c(NH ) ) |
您最近一年使用:0次
2021-01-09更新
|
9128次组卷
|
31卷引用:北京市第一○一中学2023届高三下学期三模化学试题
北京市第一○一中学2023届高三下学期三模化学试题(已下线)2021年1月浙江高考化学试题变式题21-252021年湖北高考化学试题变式题11-19浙江省金华市曙光学校2021-2022学年高三下学期5月模拟考试化学试题陕西省西安工业大学附属中学2021-2022学年高三下学期第七次适应性训练理综化学试题(已下线)T12-电解质溶液2021年1月新高考浙江化学高考真题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)难点7 溶液稀释与酸碱中和滴定曲线分析-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时39 弱电解质的电离平衡-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题15.离子反应图象-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)第21讲 电离平衡(讲)-2022年高考化学一轮复习讲练测(新教材新高考)湖南师范大学附属中学2021-2022学年高三上学期月考(三)化学试题(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第31练 水的电离和溶液的pH-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第23讲 盐类水解 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第21讲 电离平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)广东省深圳外国语学校2022-2023学年高二上学期期末考试化学试题(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)考点26 弱电解质的电离(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点28 盐类的水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第4讲 盐类的水解山西大学附属中学校2022-2023学年高三上学期11月期中考试化学试题



