名校
解题方法
1 . 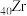 与
与 同族,
同族, 有3种常见晶胞结构,最为常见的是立方
有3种常见晶胞结构,最为常见的是立方 (晶胞为立方体)、四方
(晶胞为立方体)、四方 (晶胞为长方体,其底面为正方形),立方
(晶胞为长方体,其底面为正方形),立方 性质与钻石接近,可加工为璀璨夺目的饰品。
性质与钻石接近,可加工为璀璨夺目的饰品。___________ 。
(2)将氧氯化锆 配制成物质的量浓度为
配制成物质的量浓度为 的溶液,持续煮沸50小时后过滤,即可得到粉末状的
的溶液,持续煮沸50小时后过滤,即可得到粉末状的 ,制备
,制备 的化学方程式
的化学方程式___________ 。
(3)上图所示立方 的晶胞中,位于顶点的原子是
的晶胞中,位于顶点的原子是___________ 。
(4)上图所示四方 的晶胞中,每个O原子周围,距离“最近”的Zr原子与其距离为
的晶胞中,每个O原子周围,距离“最近”的Zr原子与其距离为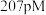 或
或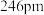 ,其余Zr原子距离明显远于
,其余Zr原子距离明显远于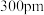 ,距离每个O原子“最近”的Zr原子共
,距离每个O原子“最近”的Zr原子共___________ 个。
(5)四方 升温至2370℃时转化为立方
升温至2370℃时转化为立方 ,两种晶体中Zr原子间最近距离均为
,两种晶体中Zr原子间最近距离均为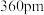 ,则四方
,则四方 转化为立方
转化为立方 时,密度
时,密度___________ (填“增大”“不变”或“减小”)。两种晶体中,密度较大的晶体的密度计算式为___________ 。(列出计算式即可。以 表示阿伏加德罗常数的值。)
表示阿伏加德罗常数的值。)
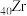 与
与 同族,
同族, 有3种常见晶胞结构,最为常见的是立方
有3种常见晶胞结构,最为常见的是立方 (晶胞为立方体)、四方
(晶胞为立方体)、四方 (晶胞为长方体,其底面为正方形),立方
(晶胞为长方体,其底面为正方形),立方 性质与钻石接近,可加工为璀璨夺目的饰品。
性质与钻石接近,可加工为璀璨夺目的饰品。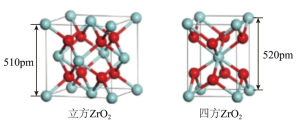
(2)将氧氯化锆
 配制成物质的量浓度为
配制成物质的量浓度为 的溶液,持续煮沸50小时后过滤,即可得到粉末状的
的溶液,持续煮沸50小时后过滤,即可得到粉末状的 ,制备
,制备 的化学方程式
的化学方程式(3)上图所示立方
 的晶胞中,位于顶点的原子是
的晶胞中,位于顶点的原子是(4)上图所示四方
 的晶胞中,每个O原子周围,距离“最近”的Zr原子与其距离为
的晶胞中,每个O原子周围,距离“最近”的Zr原子与其距离为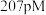 或
或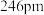 ,其余Zr原子距离明显远于
,其余Zr原子距离明显远于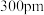 ,距离每个O原子“最近”的Zr原子共
,距离每个O原子“最近”的Zr原子共(5)四方
 升温至2370℃时转化为立方
升温至2370℃时转化为立方 ,两种晶体中Zr原子间最近距离均为
,两种晶体中Zr原子间最近距离均为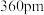 ,则四方
,则四方 转化为立方
转化为立方 时,密度
时,密度 表示阿伏加德罗常数的值。)
表示阿伏加德罗常数的值。)
您最近一年使用:0次
2023-05-27更新
|
345次组卷
|
2卷引用:辽宁省七校协作体2023-2024学年高二下学期5月期中联考化学试题
名校
2 . 欲降低废水中重金属元素铬的毒性,可将 转化为
转化为 沉淀除去,三种金属离子生成沉淀的pH如表。
沉淀除去,三种金属离子生成沉淀的pH如表。

(1)某含铬废水处理的主要流程如图所示:
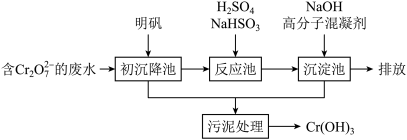
①初沉降池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)_______ 。
②请补充并配平以下反应池中发生主要反应的离子方程式:_______ 。
 。
。
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入 溶液,此过程中发生主要反应的离子方程式是:
溶液,此过程中发生主要反应的离子方程式是: 和
和_______ 。证明 沉淀完全的方法是
沉淀完全的方法是_______ 。
(2)工业可用电解法来处理含 废水,实验室利用如图模拟处理含
废水,实验室利用如图模拟处理含 的废水,阳极反应是
的废水,阳极反应是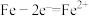 ,阴极反应式是
,阴极反应式是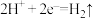 。
。
① 与酸性溶液中的
与酸性溶液中的 反应的离子方程式是
反应的离子方程式是_______ ,
②上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡角度解释其原因_______ 。
③若溶液中含有 ,则阳离子全部生成沉淀的物质的量是
,则阳离子全部生成沉淀的物质的量是_______  。
。
 转化为
转化为 沉淀除去,三种金属离子生成沉淀的pH如表。
沉淀除去,三种金属离子生成沉淀的pH如表。| 开始沉淀的pH | 完全沉淀的pH | |
 | 7.0 | 9.0 |
 | 1.9 | 3.2 |
 | 6.0 | 8.0 |

(1)某含铬废水处理的主要流程如图所示:

①初沉降池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)
②请补充并配平以下反应池中发生主要反应的离子方程式:
 。
。③根据“沉淀法”和“中和法”的原理,向沉淀池中加入
 溶液,此过程中发生主要反应的离子方程式是:
溶液,此过程中发生主要反应的离子方程式是: 和
和 沉淀完全的方法是
沉淀完全的方法是(2)工业可用电解法来处理含
 废水,实验室利用如图模拟处理含
废水,实验室利用如图模拟处理含 的废水,阳极反应是
的废水,阳极反应是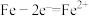 ,阴极反应式是
,阴极反应式是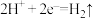 。
。①
 与酸性溶液中的
与酸性溶液中的 反应的离子方程式是
反应的离子方程式是②上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡角度解释其原因
③若溶液中含有
 ,则阳离子全部生成沉淀的物质的量是
,则阳离子全部生成沉淀的物质的量是 。
。
您最近一年使用:0次
名校
3 . 回答下列问题:
(1)将AlCl3溶液进行蒸干,得到的固体化学式为_______
(2)在日常生活中经常用Al2(SO4)3和NaHCO3混合溶液作灭火剂,请用离子方程式表示其灭火原理:_______
(3)常温下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_______ 。
(4)某CuSO4溶液中含有Fe3+杂质,溶液中CuSO4的浓度为3.0mol/L,通常认为残留在溶液中的离子浓度小于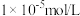 时即沉淀完全,常温下Fe(OH)3的溶度积Ksp = 1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,则:
时即沉淀完全,常温下Fe(OH)3的溶度积Ksp = 1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,则:
①该溶液中的Fe3+刚好沉淀完全时溶液的pH为_______ ;
②该溶液中的Cu2+开始形成Cu(OH)2沉淀时的pH为_______ 。
(1)将AlCl3溶液进行蒸干,得到的固体化学式为
(2)在日常生活中经常用Al2(SO4)3和NaHCO3混合溶液作灭火剂,请用离子方程式表示其灭火原理:
(3)常温下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(4)某CuSO4溶液中含有Fe3+杂质,溶液中CuSO4的浓度为3.0mol/L,通常认为残留在溶液中的离子浓度小于
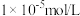 时即沉淀完全,常温下Fe(OH)3的溶度积Ksp = 1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,则:
时即沉淀完全,常温下Fe(OH)3的溶度积Ksp = 1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,则:①该溶液中的Fe3+刚好沉淀完全时溶液的pH为
②该溶液中的Cu2+开始形成Cu(OH)2沉淀时的pH为
您最近一年使用:0次
2022-12-13更新
|
348次组卷
|
2卷引用:辽宁省沈阳市第十中学2022-2023学年高二上学期期末综合测评化学试题
名校
4 . Ⅰ.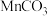 可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。它在空气中加热易转化为不同价态锰的氧化物,其固体残留率随温度的变化,如图所示。
可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。它在空气中加热易转化为不同价态锰的氧化物,其固体残留率随温度的变化,如图所示。
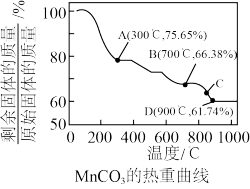
(1)300℃时,剩余固体中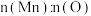 为
为_______ 。
(2)图中C点对应固体的成分为_______ (填化学式)。
Ⅱ. 是常见温室气体,将一定量的气体
是常见温室气体,将一定量的气体 通入100mL某浓度的NaOH溶液得F溶液,向F溶液中逐滴加入
通入100mL某浓度的NaOH溶液得F溶液,向F溶液中逐滴加入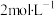 的盐酸,产生
的盐酸,产生 的体积与所加盐酸体积之间的关系如图所示。
的体积与所加盐酸体积之间的关系如图所示。
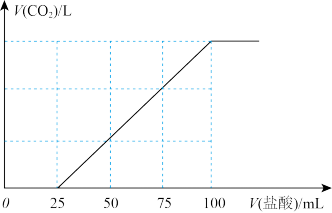
(3)F溶质与足量石灰水发生反应最多可得沉淀的质量为_______ 。
Ⅲ.完成问题
(4)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[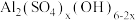 ]溶液。若溶液的pH偏高,则碱式硫酸铝产率下降且有气体C产生,用化学方程式表示其原因:
]溶液。若溶液的pH偏高,则碱式硫酸铝产率下降且有气体C产生,用化学方程式表示其原因:_______ 。
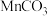 可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。它在空气中加热易转化为不同价态锰的氧化物,其固体残留率随温度的变化,如图所示。
可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。它在空气中加热易转化为不同价态锰的氧化物,其固体残留率随温度的变化,如图所示。
(1)300℃时,剩余固体中
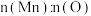 为
为(2)图中C点对应固体的成分为
Ⅱ.
 是常见温室气体,将一定量的气体
是常见温室气体,将一定量的气体 通入100mL某浓度的NaOH溶液得F溶液,向F溶液中逐滴加入
通入100mL某浓度的NaOH溶液得F溶液,向F溶液中逐滴加入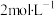 的盐酸,产生
的盐酸,产生 的体积与所加盐酸体积之间的关系如图所示。
的体积与所加盐酸体积之间的关系如图所示。
(3)F溶质与足量石灰水发生反应最多可得沉淀的质量为
Ⅲ.完成问题
(4)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[
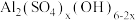 ]溶液。若溶液的pH偏高,则碱式硫酸铝产率下降且有气体C产生,用化学方程式表示其原因:
]溶液。若溶液的pH偏高,则碱式硫酸铝产率下降且有气体C产生,用化学方程式表示其原因:
您最近一年使用:0次
名校
解题方法
5 . 请根据信息回答下列问题。
(1)双氧水(H2O2)和水都是极弱电解质,H2O2可以看成一种二元弱酸。
①写出H2O2在水中的电离方程式:_______ 。
②水电离生成H3O+和OH-的过程叫做水的自耦电离。同水样,H2O2也有微弱的自耦电离,其自耦电离的方程式为:_______ 。
(2)相同温度、相同浓度的下列溶液中:①CH3COOH;②CH3COONH4;③CH3COONa,则溶液中CH3COO-浓度由大到小的顺序是_______ 。(填序号)
(3)相同温度、相同物质的量浓度的下列各溶液①NH4Cl;②HCl;③NaOH;④CH3COONa,其pH由大到小的顺序为:_______ 。(填序号)
(4)泡沫灭火器内外桶中各盛有一定浓度的NaHCO3、Al2(SO4)3溶液。使用时须将该灭火器反转并拔掉插销,让上述溶液混合并由喷嘴喷射出一定量的气流和难溶物,覆盖在可燃物的表面起到灭火效果。
①写出该反应的离子方程式_______ 。
②泡沫灭火器可适合于扑灭下列哪种物品的初期着火_______ 。(填序号)
A.植物油 B.Na、K着火 C.家用电器 D.棉纱纸张
(1)双氧水(H2O2)和水都是极弱电解质,H2O2可以看成一种二元弱酸。
①写出H2O2在水中的电离方程式:
②水电离生成H3O+和OH-的过程叫做水的自耦电离。同水样,H2O2也有微弱的自耦电离,其自耦电离的方程式为:
(2)相同温度、相同浓度的下列溶液中:①CH3COOH;②CH3COONH4;③CH3COONa,则溶液中CH3COO-浓度由大到小的顺序是
(3)相同温度、相同物质的量浓度的下列各溶液①NH4Cl;②HCl;③NaOH;④CH3COONa,其pH由大到小的顺序为:
(4)泡沫灭火器内外桶中各盛有一定浓度的NaHCO3、Al2(SO4)3溶液。使用时须将该灭火器反转并拔掉插销,让上述溶液混合并由喷嘴喷射出一定量的气流和难溶物,覆盖在可燃物的表面起到灭火效果。
①写出该反应的离子方程式
②泡沫灭火器可适合于扑灭下列哪种物品的初期着火
A.植物油 B.Na、K着火 C.家用电器 D.棉纱纸张
您最近一年使用:0次
6 . 铁、铜及其化合物在日常生活及工业生产中用途非常广泛。
I.FeCl3是常用的金属蚀刻剂和净水剂。
(1)FeCl3净水的原理是___ (用离子方程式及语言表示)。
(2)FeCl3在溶液中分三步水解:Fe3++H2O Fe(OH)2++H+ K1;Fe(OH)2++H2O
Fe(OH)2++H+ K1;Fe(OH)2++H2O Fe(OH)
Fe(OH) +H+ K2;Fe(OH)
+H+ K2;Fe(OH) +H2O
+H2O Fe(OH)3+H+ K3。以上水解反应的平衡常数K1、K2、K3由大到小的顺序是
Fe(OH)3+H+ K3。以上水解反应的平衡常数K1、K2、K3由大到小的顺序是___ 。
(3)配制FeCl3溶液时,常将FeCl3晶体溶于浓盐酸中,使用时加蒸馏水稀释至指定浓度。某同学误将FeCl3直接放入自来水中(含有Mg2+、Ca2+、HCO 、Cl-等杂质离子),看到红褐色沉淀和大量气泡,试解释出现该现象的原因
、Cl-等杂质离子),看到红褐色沉淀和大量气泡,试解释出现该现象的原因___ (用离子方程式表示)。
II.CuCl2常用作电镀添加剂、催化剂及饲料添加剂。
(4)①25℃时Fe(OH)2、Fe(OH)3、Cu(OH)2的Ksp如表所示,计算当溶液中Fe2+、Cu2+浓度均为0.1mol/L时,Fe(OH)2沉淀完全及Cu(OH)2开始沉淀时的pH值(已知lg2=0.3,离子浓度小于1.0×10-5mol/L视为沉淀完全)。
②为了除去CuCl2溶液中含有的少量FeCl2,可以用氧化剂将FeCl2氧化为FeCl3,调控溶液pH___ (填范围),将FeCl3转化为Fe(OH)3除去。
I.FeCl3是常用的金属蚀刻剂和净水剂。
(1)FeCl3净水的原理是
(2)FeCl3在溶液中分三步水解:Fe3++H2O
 Fe(OH)2++H+ K1;Fe(OH)2++H2O
Fe(OH)2++H+ K1;Fe(OH)2++H2O Fe(OH)
Fe(OH) +H+ K2;Fe(OH)
+H+ K2;Fe(OH) +H2O
+H2O Fe(OH)3+H+ K3。以上水解反应的平衡常数K1、K2、K3由大到小的顺序是
Fe(OH)3+H+ K3。以上水解反应的平衡常数K1、K2、K3由大到小的顺序是(3)配制FeCl3溶液时,常将FeCl3晶体溶于浓盐酸中,使用时加蒸馏水稀释至指定浓度。某同学误将FeCl3直接放入自来水中(含有Mg2+、Ca2+、HCO
 、Cl-等杂质离子),看到红褐色沉淀和大量气泡,试解释出现该现象的原因
、Cl-等杂质离子),看到红褐色沉淀和大量气泡,试解释出现该现象的原因II.CuCl2常用作电镀添加剂、催化剂及饲料添加剂。
(4)①25℃时Fe(OH)2、Fe(OH)3、Cu(OH)2的Ksp如表所示,计算当溶液中Fe2+、Cu2+浓度均为0.1mol/L时,Fe(OH)2沉淀完全及Cu(OH)2开始沉淀时的pH值(已知lg2=0.3,离子浓度小于1.0×10-5mol/L视为沉淀完全)。
| 分子式 | Ksp | 开始沉淀时的pH | 沉淀完全时的pH |
| Fe(OH)2 | 4.0×10-17 | 6.3 | a= |
| Fe(OH)3 | 2.79×10-39 | 1.5 | 2.8 |
| Cu(OH)2 | 1.6×10-20 | b= | 6.6 |
②为了除去CuCl2溶液中含有的少量FeCl2,可以用氧化剂将FeCl2氧化为FeCl3,调控溶液pH
您最近一年使用:0次
解题方法
7 . 全球气候变化对全球人类社会构成重大威胁。政府气候变化专门委员会(IPCC)报告认为,为了避免极端危害,世界必须将全球变暖幅度控制在1.5℃以内。只有全球都在21世纪中叶实现温室气体净零排放,才能有可能实现这一目标。请根据二氧化碳的利用回答下列问题:
(1)CO2催化氢化制甲烷的研究过程如图1:
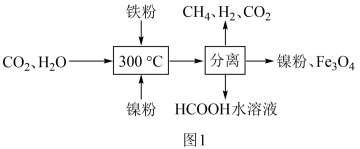
①上述过程中,加入铁粉的作用是__ 。
②HCOOH是CO2转化为CH4的中间体:CO2 HCOOH
HCOOH CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是__ 。
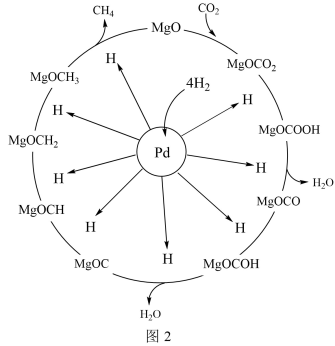
(2)一定条件下,Pd—Mg/SiO2催化剂可使CO2甲烷化从而变废为宝,其反应机理如图2所示,该反应的化学方程式为__ 。
(3)CO2加氢还可制备甲酸(HCOOH)。
①温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=
HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=__ k正。
②温度为T2℃时,k正=1.1k逆,则T2℃时平衡压强__ (填“>”“<”或“=”)T1℃时平衡压强。
(4)N—甲基二乙醇胺(用MDEA表示)水溶液具有吸收能力强、对设备腐蚀小等特点,MDEA吸收CO2的反应可以表示为:MDEA(aq)+CO2(g)+H2O(l) MDEAH+(aq)+HCO
MDEAH+(aq)+HCO (aq) △H。
(aq) △H。
①已知MDEA中的氮具有一元碱(类似于NH3)的性质,Kb=5.2×10-4,已知H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,推测溶液MDEAHHCO3显__ 性(填酸,碱,中)。
②标准平衡常数Kθ可以表示平衡时各物质的浓度关系:如反应A(aq)+2B(g) C(g)+D(aq)的Kθ=
C(g)+D(aq)的Kθ=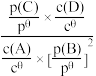 ,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=
,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=__ (计算结果保留两位小数)。
(5)设计二氧化碳熔盐捕获及电化学转化装置示意图如图:
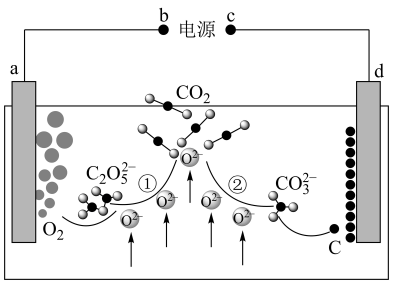
a极的电极反应式为__ 。
(1)CO2催化氢化制甲烷的研究过程如图1:

①上述过程中,加入铁粉的作用是
②HCOOH是CO2转化为CH4的中间体:CO2
 HCOOH
HCOOH CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是(2)一定条件下,Pd—Mg/SiO2催化剂可使CO2甲烷化从而变废为宝,其反应机理如图2所示,该反应的化学方程式为

(3)CO2加氢还可制备甲酸(HCOOH)。
①温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)
 HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=
HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=②温度为T2℃时,k正=1.1k逆,则T2℃时平衡压强
(4)N—甲基二乙醇胺(用MDEA表示)水溶液具有吸收能力强、对设备腐蚀小等特点,MDEA吸收CO2的反应可以表示为:MDEA(aq)+CO2(g)+H2O(l)
 MDEAH+(aq)+HCO
MDEAH+(aq)+HCO (aq) △H。
(aq) △H。①已知MDEA中的氮具有一元碱(类似于NH3)的性质,Kb=5.2×10-4,已知H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,推测溶液MDEAHHCO3显
②标准平衡常数Kθ可以表示平衡时各物质的浓度关系:如反应A(aq)+2B(g)
 C(g)+D(aq)的Kθ=
C(g)+D(aq)的Kθ=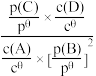 ,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=
,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=(5)设计二氧化碳熔盐捕获及电化学转化装置示意图如图:

a极的电极反应式为
您最近一年使用:0次
8 . 盐是一类常见的电解质,事实表明盐溶液不一定呈中性。
(1) 、
、 的水溶液分别呈
的水溶液分别呈___________ 性、___________ 性。
(2)盐中阴、阳离子的水解使盐溶液呈现的酸碱性不同,盐水解的离子方程式也不相同,如 和
和 水解的离子方程式分别为
水解的离子方程式分别为___________ 、___________ 。
(3)氯化铝水溶液呈___________ 性,原因是___________ (用离子方程式表示),将 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是___________ 。
(1)
 、
、 的水溶液分别呈
的水溶液分别呈(2)盐中阴、阳离子的水解使盐溶液呈现的酸碱性不同,盐水解的离子方程式也不相同,如
 和
和 水解的离子方程式分别为
水解的离子方程式分别为(3)氯化铝水溶液呈
 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是
您最近一年使用:0次
解题方法
9 . 描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。
请回答下列问题:
(1)上述四种酸中,酸性最弱的是___ (用化学式表示)。
(2)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是__ (填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(3)CH3COONH4的水溶液呈____ (选填“酸性”“中性”或“碱性”),溶液中各离子浓度大小的关系是___ 。
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HNO2 | 4.6×10-4 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3•H2O | 1.8×10-5 |
请回答下列问题:
(1)上述四种酸中,酸性最弱的是
(2)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(3)CH3COONH4的水溶液呈
您最近一年使用:0次
10 . (1)泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈现碱性的原因是(用离子方程式表示)__________________ ;灭火器内另一容器中装有Al2(SO4)3溶液,该溶液呈酸性的原因是(用离子方程式表示):_____________________ ,当意外失火时,使泡沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为:_________
(2)在25 ℃时,将a mol·L-1的KCN溶液与0.01 mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a________ 0.01 mol·L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=____________ 。
(2)在25 ℃时,将a mol·L-1的KCN溶液与0.01 mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a
您最近一年使用:0次



