解题方法
1 . t℃时, 在水中的沉淀溶解平衡曲线如图所示(t℃时
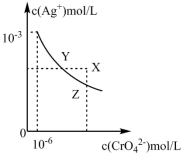
在水中的沉淀溶解平衡曲线如图所示(t℃时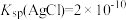 )。下列说法正确的是
)。下列说法正确的是
 在水中的沉淀溶解平衡曲线如图所示(t℃时
在水中的沉淀溶解平衡曲线如图所示(t℃时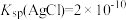 )。下列说法正确的是
)。下列说法正确的是
A.t℃时, 的Ksp数量级是10-9 的Ksp数量级是10-9 |
B.在饱和 溶液中加入 溶液中加入 固体可使溶液由Y点到X点 固体可使溶液由Y点到X点 |
C.t℃时,用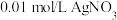 液滴定 液滴定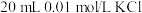 和 和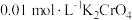 的混合液, 的混合液, 先沉淀 先沉淀 |
D.t℃时: 的平衡常数 的平衡常数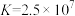 |
您最近一年使用:0次
2022-12-05更新
|
226次组卷
|
2卷引用:辽宁省朝阳市建平县高级中学2021-2022学年高二上学期第二次月考化学试题
解题方法
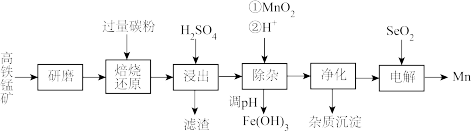
2 . 在钢铁工业中,主要用锰脱硫和脱氧:锰也是作为合金的添加料。一种以高铁锰矿(含 、
、 及少量
及少量 、
、 、
、 、
、 )为原料生产金属锰的工艺流程如图。
)为原料生产金属锰的工艺流程如图。
已知:常温下, 的
的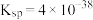 ;
; ;溶液中某离子浓度小于
;溶液中某离子浓度小于 认为该离子沉淀完全。
认为该离子沉淀完全。
回答下列问题:
(1)研磨的目的是_______ 。
(2)“焙烧还原”时,原料中高铁锰矿中 被还原为
被还原为 ,还有能被还原的成分为
,还有能被还原的成分为_______ 、_______ 。(填化学式)
(3)下表数据是焙烧后 元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为
元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为_______  。
。
(4)“浸出”产生两种“滤渣”的成分为_______ 、_______ (填化学式):该步骤中,工业上往往需再加入少量固体 以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因
以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因_______ 。
(5)常温下,“除杂”时 参加的反应的离子方程式为
参加的反应的离子方程式为_______ ;再逐步调
_______ 至 完全沉淀。
完全沉淀。
(6)研究表明,加入适量的 有利于
有利于 在电极上析出,电解过程中
在电极上析出,电解过程中 与水反应生成的
与水反应生成的 (二元弱酸)在阴极放电生成
(二元弱酸)在阴极放电生成 单质,该电极反应式为
单质,该电极反应式为_______ 。
 、
、 及少量
及少量 、
、 、
、 、
、 )为原料生产金属锰的工艺流程如图。
)为原料生产金属锰的工艺流程如图。
已知:常温下,
 的
的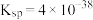 ;
; ;溶液中某离子浓度小于
;溶液中某离子浓度小于 认为该离子沉淀完全。
认为该离子沉淀完全。回答下列问题:
(1)研磨的目的是
(2)“焙烧还原”时,原料中高铁锰矿中
 被还原为
被还原为 ,还有能被还原的成分为
,还有能被还原的成分为(3)下表数据是焙烧后
 元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为
元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为 。
。还原温度/ | 焙烧后 元素在主要含锰物质中的分布/% 元素在主要含锰物质中的分布/% | ||
 | 高价锰( ) ) | 低价锰( ) ) | |
| 600 800 1000 1100 1200 | 40.92 10.56 6.01 痕量 痕量 | 34.76 6.63 2.70 0.46 0.30 | 24.32 82.81 91.29 98.76 97.94 |
 以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因
以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因(5)常温下,“除杂”时
 参加的反应的离子方程式为
参加的反应的离子方程式为
 完全沉淀。
完全沉淀。(6)研究表明,加入适量的
 有利于
有利于 在电极上析出,电解过程中
在电极上析出,电解过程中 与水反应生成的
与水反应生成的 (二元弱酸)在阴极放电生成
(二元弱酸)在阴极放电生成 单质,该电极反应式为
单质,该电极反应式为
您最近一年使用:0次
3 . 化学与生产、生活密切相关,下列说法正确的是
| A.牙膏中添加氟化物可预防龋齿 |
| B.沼气的主要成分为甲烷,沼气属于不可再生资源 |
| C.葡萄酒中添加适量二氧化硫,可以起到抗氧化和漂白的作用 |
| D.氢氧化镁和碳酸钠可用作胃酸的中和剂 |
您最近一年使用:0次
2021-12-25更新
|
209次组卷
|
3卷引用:山西省2021-2022学年高二上学期12月联合考试化学试题
4 . 某科研课题小组研究利用含H+、Na+、Zn2+、Mn2+、Fe2+、Fe3+、SO 的工业废电解质溶液,制备高纯的ZnO、MnO2、Fe2O3,设计实验流程如图:
的工业废电解质溶液,制备高纯的ZnO、MnO2、Fe2O3,设计实验流程如图:
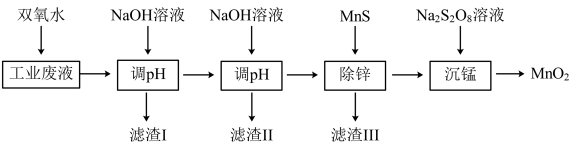
回答下列问题:
(1)加入双氧水的目的是___ 。
(2)第一次调pH使Fe3+完全沉淀,写出反应的离子方程___ 。
(3)第二次调pH前,科研小组成员分析此时的溶液,得到常温下相关数据如表(表中金属离子沉淀完全时,其浓度为1×10-5mol·L-1)。
为防止Mn2+同时沉淀造成产品不纯,最终选择将溶液的pH控制为7,则此时溶液中Zn2+的沉淀率为___ ,利用滤渣Ⅱ制备高纯的ZnO时,必然含有极其微量的___ (以化学式表示)。
(4)已知常温下,Ksp(MnS)=3.0×10-14,Ksp(ZnS)=1.5×10-24,在除锌时发生沉淀转化反应为:MnS(s)+Zn2+(aq) ZnS(s)+Mn2+(aq),其平衡常数K=
ZnS(s)+Mn2+(aq),其平衡常数K=___ 。(填数值)
(5)沉锰反应在酸性条件下完成,写出该反应的离子方程式___ 。
 的工业废电解质溶液,制备高纯的ZnO、MnO2、Fe2O3,设计实验流程如图:
的工业废电解质溶液,制备高纯的ZnO、MnO2、Fe2O3,设计实验流程如图:
回答下列问题:
(1)加入双氧水的目的是
(2)第一次调pH使Fe3+完全沉淀,写出反应的离子方程
(3)第二次调pH前,科研小组成员分析此时的溶液,得到常温下相关数据如表(表中金属离子沉淀完全时,其浓度为1×10-5mol·L-1)。
| 浓度/(mol·L-1) | 氢氧化物的Ksp | 开始沉淀的pH | 沉淀完全的pH | |
| Zn2+ | 0.12 | 1.2×10-17 | 6.0 | 8.1 |
| Mn2+ | 0.10 | 4.0×10-14 | 7.8 | 9.8 |
(4)已知常温下,Ksp(MnS)=3.0×10-14,Ksp(ZnS)=1.5×10-24,在除锌时发生沉淀转化反应为:MnS(s)+Zn2+(aq)
 ZnS(s)+Mn2+(aq),其平衡常数K=
ZnS(s)+Mn2+(aq),其平衡常数K=(5)沉锰反应在酸性条件下完成,写出该反应的离子方程式
您最近一年使用:0次
5 . 已知相同温度下,Ksp(BaSO4)<Ksp(BaCO3)。某温度下,饱和溶液中−lg[c(SO )]、−lg[c(CO
)]、−lg[c(CO )]与−lg[c(Ba2+)]的关系如图所示。
)]与−lg[c(Ba2+)]的关系如图所示。
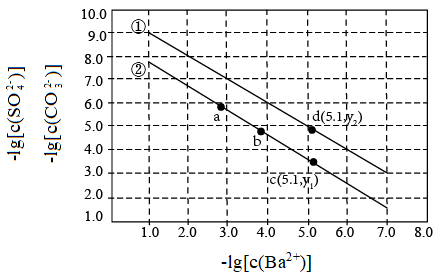
下列说法错误的是
 )]、−lg[c(CO
)]、−lg[c(CO )]与−lg[c(Ba2+)]的关系如图所示。
)]与−lg[c(Ba2+)]的关系如图所示。
下列说法错误的是
| A.曲线①中y2=4.9 |
B.曲线②中a点:2c(Ba2+)+c(H+)=2c(CO )+c(OH−)+c(HCO )+c(OH−)+c(HCO ) ) |
| C.加适量BaCl2固体可使溶液由c点变到b点 |
| D.该温度下:Ksp(BaSO4)=1.0×10—10 |
您最近一年使用:0次
解题方法
6 . 一定温度下,难溶电解质在水中存在沉淀溶解和生成的平衡,常用溶度积Ksp来表示溶解程度的大小,如Ksp(AgCl)=c(Ag+)·c(Cl—)。常温下用0.1000mol/L的AgNO3标准溶液(pH≈5)分别滴定20.00mL0.1000mol/L的NaCl溶液和NaBr溶液,混合溶液的pAg[定义为pAg=—lgc(Ag+)]与AgNO3溶液体积的变化关系如图所示。
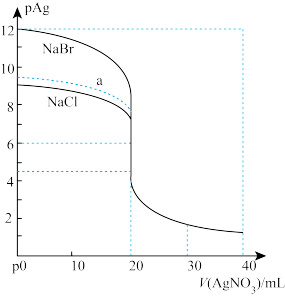
下列说法不正确的是

下列说法不正确的是
| A.Ksp(AgCl)>Ksp(AgBr) |
| B.当V(AgNO3溶液)=20mL时,NaBr溶液中:c(Ag+)+c(H+)=c(Br—)+c(OH—) |
C.当V(AgNO3溶液)=30mL时,NaCl溶液中:c(NO )>c(Na+)>c(Ag+)>c(Cl—)>c(H+) )>c(Na+)>c(Ag+)>c(Cl—)>c(H+) |
| D.相同实验条件下,若改用10.00mL0.2000mol/LNaCl溶液,则滴定曲线(滴定终点前)可能变为a |
您最近一年使用:0次
2021-06-02更新
|
881次组卷
|
6卷引用:浙江省名校新高考研究联盟(Z20联盟)2021届高三第三次联考化学试题
浙江省名校新高考研究联盟(Z20联盟)2021届高三第三次联考化学试题(已下线)【浙江新东方】高三化学20210527-004【2021】【高三下】【模拟考】【Z20】【高中化学】【李鼎收集】(已下线)第26讲 难溶电解质的溶解平衡(精练)-2022年高考化学一轮复习讲练测(已下线)考点26 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)考点29 沉淀溶解平衡-备战2023年高考化学一轮复习考点帮(全国通用)
名校
解题方法
7 . 用0.1000mol·L-1AgNO3溶液滴定50.00mL0.0500mol·L-1KI溶液的滴定曲线如图所示。
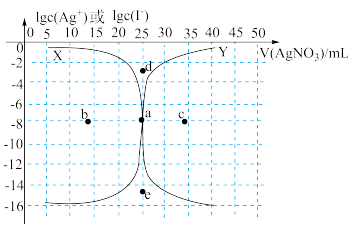
已知:Ksp(AgI)=4×10-16。下列有关描述正确的是

已知:Ksp(AgI)=4×10-16。下列有关描述正确的是
| A.曲线x代表lgc(Ag+)随v(AgNO3)变化而变化的曲线 |
| B.a点表示反应终点,其坐标是(25.00,-7.7) |
| C.相同实验条件下,若改为0.0500mol·L-1KCl溶液,反应终点由a向e方向移动 |
| D.相同实验条件下,若改为0.0500mol·L-1AgNO3溶液,反应终点a向b方向移动 |
您最近一年使用:0次
2021-05-31更新
|
730次组卷
|
4卷引用:四川省达州市普通高中2021届高三第二次诊断性测试理科综合化学试题
四川省达州市普通高中2021届高三第二次诊断性测试理科综合化学试题(已下线)第26讲 难溶电解质的溶解平衡(精练)-2022年高考化学一轮复习讲练测河北省石家庄市第二中学2021-2022学年高三上学期九月第四次考试化学试题辽宁省实验中学2021-2022学年度高三上学期第三次阶段测试化学试题
名校
解题方法
8 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
I.已知 在水中存在以下平衡:
在水中存在以下平衡: ,
,
(1)某温度下,若向 的
的 溶液中逐滴滴加
溶液中逐滴滴加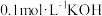 溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是
溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是_______ 。
A. B.
B.
C.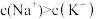 D.
D.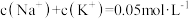
(2)已知常温下 的钙盐(CaA)的饱和溶液中存在以下平衡:
的钙盐(CaA)的饱和溶液中存在以下平衡: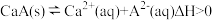 。若要使该溶液中
。若要使该溶液中 浓度变小,可采取的措施有
浓度变小,可采取的措施有_______ 。
A.升高温度 B.降低温度 C.加入 晶体 D.加入
晶体 D.加入 固体
固体
II.含有 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含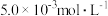 的
的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
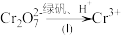 、
、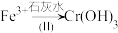 、
、
(3)该废水中加入绿矾和 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。
(4)若处理后的废水中残留的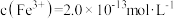 ,则残留的
,则残留的 的浓度为
的浓度为_______ 。(已知: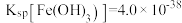 ,
,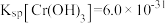 )
)
I.已知
 在水中存在以下平衡:
在水中存在以下平衡: ,
,
(1)某温度下,若向
 的
的 溶液中逐滴滴加
溶液中逐滴滴加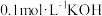 溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是
溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是A.
 B.
B.
C.
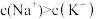 D.
D.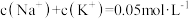
(2)已知常温下
 的钙盐(CaA)的饱和溶液中存在以下平衡:
的钙盐(CaA)的饱和溶液中存在以下平衡: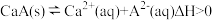 。若要使该溶液中
。若要使该溶液中 浓度变小,可采取的措施有
浓度变小,可采取的措施有A.升高温度 B.降低温度 C.加入
 晶体 D.加入
晶体 D.加入 固体
固体II.含有
 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含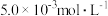 的
的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理: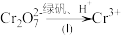 、
、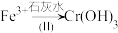 、
、
(3)该废水中加入绿矾和
 ,发生反应的离子方程式为
,发生反应的离子方程式为(4)若处理后的废水中残留的
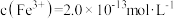 ,则残留的
,则残留的 的浓度为
的浓度为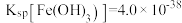 ,
,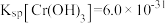 )
)
您最近一年使用:0次
名校
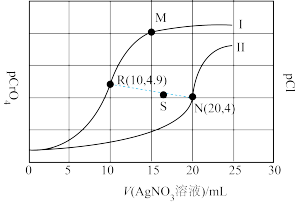
9 . 某温度下,分别向体积均为10 mL、浓度均为0.1 mol·L-1的KCl溶液和K2CrO4溶液中滴加0.1 mol·L-1的AgNO3溶液,滴加过程中pCl和pCrO4随加入AgNO3溶液的体积(V)的变化关系如图所示。已知:pCl=-lgc(Cl-),pCrO4=-lgc( )。下列说法不正确的是
)。下列说法不正确的是
 )。下列说法不正确的是
)。下列说法不正确的是
| A.曲线I表示pCl与V(AgNO3溶液)的变化关系 |
| B.若仅增大KCl的浓度,平衡点由R点沿虚线移向S点 |
C.M点溶液中:c( )>c(Ag+)>c(H+)>c(OH-) )>c(Ag+)>c(H+)>c(OH-) |
| D.该温度下,Ksp(Ag2CrO4)=4.0×10-12 |
您最近一年使用:0次
2021-04-06更新
|
1188次组卷
|
6卷引用:贵州省黔东南州2021届高三下学期3月高考模拟考试理综化学试题
贵州省黔东南州2021届高三下学期3月高考模拟考试理综化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)第10练 沉淀溶解平衡-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)安徽省舒城中学2021-2022学年高二下学期第一次月考化学试题(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
名校
解题方法
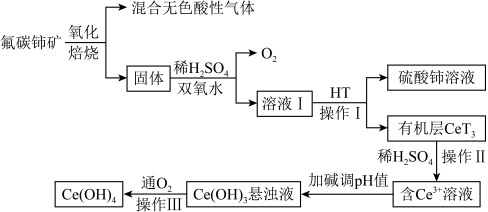
10 . 氢氧化铈是黄色难溶于水、可溶于酸的常用化学试剂。以氟碳铈矿(主要成分为CeFCO3)为原料提取氢氧化铈的工艺流程如图所示:
请回答下列问题:
(1)CeFCO3中Ce的化合价为____ 。“酸浸”时,为提高矿石的浸出率,下列措施可采取的是___ (填标号)。
A.提高浸出温度 B.延长浸出时间 C.用98%的硫酸
(2)氧化焙烧发生的反应方程式为__________ 。
(3)H2O2的作用是__________ 。
(4)HT是一种难溶于水的有机溶剂,它能将Ce3+从水溶液中萃取出来,该过程可表示为Ce3+(水层)+3HT(有机层) CeT3(有机层)+3H+(水层)。操作I的名称是
CeT3(有机层)+3H+(水层)。操作I的名称是________ ,操作III的步骤是_______ 。
(5)从平衡的角度解释加碱调pH值生成Ce(OH)3悬浊液的原因________ 。

请回答下列问题:
(1)CeFCO3中Ce的化合价为
A.提高浸出温度 B.延长浸出时间 C.用98%的硫酸
(2)氧化焙烧发生的反应方程式为
(3)H2O2的作用是
(4)HT是一种难溶于水的有机溶剂,它能将Ce3+从水溶液中萃取出来,该过程可表示为Ce3+(水层)+3HT(有机层)
 CeT3(有机层)+3H+(水层)。操作I的名称是
CeT3(有机层)+3H+(水层)。操作I的名称是(5)从平衡的角度解释加碱调pH值生成Ce(OH)3悬浊液的原因
您最近一年使用:0次
2020-09-25更新
|
247次组卷
|
3卷引用:山东省济南市历城第二中学2022届高三上学期开学考试化学试卷(A)
山东省济南市历城第二中学2022届高三上学期开学考试化学试卷(A)北京市清华大学附属中学中学生标准学术能力基础性测试2021届高三9月测试化学试题(已下线)北京市清华大学附属中学2021届高三上学期9月月考化学试题



