1 . ①已知t℃时AgCl的Ksp=2.0×10-10;②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是
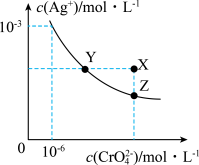

| A.在t℃时,Ag2CrO4的Ksp为1.0×10-12 |
| B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到Z点 |
C.在t℃时,以0.01mol·L-1AgNO3溶液滴定20.00mL0.01mol·L-1KCl和0.01mol·L-1K2CrO4的混合溶液, 先沉淀 先沉淀 |
D.在t℃时,反应Ag2CrO4(s)+2Cl-(aq) 2AgCl(s)+ 2AgCl(s)+ (aq)的平衡常数K=2.5×107 (aq)的平衡常数K=2.5×107 |
您最近一年使用:0次
2020-11-03更新
|
587次组卷
|
3卷引用:甘肃省天水市第一中学2020-2021学年高二下学期开学考试化学试题
甘肃省天水市第一中学2020-2021学年高二下学期开学考试化学试题(已下线)专题3.4.1 难溶电解质的溶解平衡(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)重庆市秀山高级中学校2020-2021学年高二上学期10月月考化学试题
名校
解题方法
2 . 氢氧化铈是黄色难溶于水、可溶于酸的常用化学试剂。以氟碳铈矿(主要成分为CeFCO3)为原料提取氢氧化铈的工艺流程如图所示:
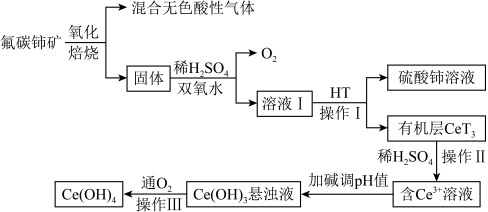
请回答下列问题:
(1)CeFCO3中Ce的化合价为____ 。“酸浸”时,为提高矿石的浸出率,下列措施可采取的是___ (填标号)。
A.提高浸出温度 B.延长浸出时间 C.用98%的硫酸
(2)氧化焙烧发生的反应方程式为__________ 。
(3)H2O2的作用是__________ 。
(4)HT是一种难溶于水的有机溶剂,它能将Ce3+从水溶液中萃取出来,该过程可表示为Ce3+(水层)+3HT(有机层) CeT3(有机层)+3H+(水层)。操作I的名称是
CeT3(有机层)+3H+(水层)。操作I的名称是________ ,操作III的步骤是_______ 。
(5)从平衡的角度解释加碱调pH值生成Ce(OH)3悬浊液的原因________ 。

请回答下列问题:
(1)CeFCO3中Ce的化合价为
A.提高浸出温度 B.延长浸出时间 C.用98%的硫酸
(2)氧化焙烧发生的反应方程式为
(3)H2O2的作用是
(4)HT是一种难溶于水的有机溶剂,它能将Ce3+从水溶液中萃取出来,该过程可表示为Ce3+(水层)+3HT(有机层)
 CeT3(有机层)+3H+(水层)。操作I的名称是
CeT3(有机层)+3H+(水层)。操作I的名称是(5)从平衡的角度解释加碱调pH值生成Ce(OH)3悬浊液的原因
您最近一年使用:0次
2020-09-25更新
|
248次组卷
|
3卷引用:山东省济南市历城第二中学2022届高三上学期开学考试化学试卷(A)
山东省济南市历城第二中学2022届高三上学期开学考试化学试卷(A)北京市清华大学附属中学中学生标准学术能力基础性测试2021届高三9月测试化学试题(已下线)北京市清华大学附属中学2021届高三上学期9月月考化学试题
3 . 已知溶解度也可用物质的量浓度表示,25℃时,Ag2SO4在不同浓度 溶液中的溶解度如图所示。下列说法正确的是
溶液中的溶解度如图所示。下列说法正确的是
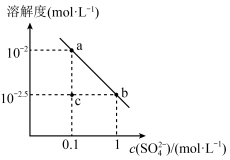
 溶液中的溶解度如图所示。下列说法正确的是
溶液中的溶解度如图所示。下列说法正确的是
| A.图中a、b两点c(Ag+)相同 |
| B.把a点的溶液加热蒸发掉一部分水,恢复到室温,可得到b点的溶液 |
| C.该温度下,Ag2SO4溶度积的数量级为10−5 |
| D.在c点的溶液中加入少量Na2SO4固体,溶液可变为a点 |
您最近一年使用:0次
2020-09-25更新
|
410次组卷
|
7卷引用:甘肃省民勤县第一中学2020-2021学年高二下学期(理)开学考试化学试题
甘肃省民勤县第一中学2020-2021学年高二下学期(理)开学考试化学试题山东省济南市历城第二中学2022届高三上学期开学考试化学试卷(A)北京市清华大学附属中学中学生标准学术能力基础性测试2021届高三9月测试化学试题(已下线)北京市清华大学附属中学2021届高三上学期9月月考化学试题(已下线)3.4.1 难溶电解质的沉淀溶解平衡(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(已下线)第24讲 沉淀溶解平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第5讲 难溶电解质的溶解平衡
名校
4 . 下列有关 沉淀溶解平衡的说法正确的是
沉淀溶解平衡的说法正确的是
 沉淀溶解平衡的说法正确的是
沉淀溶解平衡的说法正确的是A.平衡时 沉淀生成和溶解的速率都等于零 沉淀生成和溶解的速率都等于零 |
B. 难溶于水,溶液中不存在 难溶于水,溶液中不存在 和 和 |
C.向 沉淀溶解平衡体系中加入 沉淀溶解平衡体系中加入 固体, 固体, 的 的 不变 不变 |
D.升高温度, 的溶解度不变 的溶解度不变 |
您最近一年使用:0次
2020-09-19更新
|
495次组卷
|
8卷引用:湖南省长沙市明德中学2020-2021学年高二下学期开学考化学试卷
湖南省长沙市明德中学2020-2021学年高二下学期开学考化学试卷(已下线)3.4.1 难溶电解质的沉淀溶解平衡(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)黑龙江省佳木斯市第八中学2021-2022学年高二下学期开学考试化学试题湖北省十堰市汉江中学2021-2022学年高二上学期期中考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡(已下线)3.4+难溶电解质的溶解平衡-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)第三章 水溶液中的离子平衡(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版选修4)甘肃省金昌市永昌县第一高级中学2022-2023学年高二上学期期末考试化学试题
名校
5 . 某温度时,可用K2S沉淀Cu2+、Mn2+、Zn2+三种离子(M2+)。所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列说法正确的是
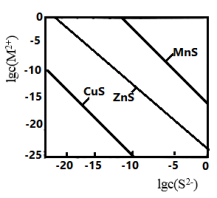

| A.三种离子对应的硫化物中Ksp(CuS)最小,约为1×10-20 |
| B.向MnS的悬浊液中加入少量水,沉淀溶解平衡向溶解的方向移动,c(S2-)增大 |
| C.可用MnS除去MnCl2溶液中混有的少量杂质ZnCl2 |
| D.向浓度均为1×10-5mol·L-1的Cu2+、Zn2+、Mn2+混合溶液中逐滴加入1×10-4mol·L-1的Na2S溶液,Zn2+先沉淀 |
您最近一年使用:0次
2020-08-29更新
|
660次组卷
|
8卷引用:湖北省武汉市新洲区城关高级中学2020-2021学年高二下学期开学收心考试化学试题
湖北省武汉市新洲区城关高级中学2020-2021学年高二下学期开学收心考试化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)第5讲 沉淀溶解平衡-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)四川省绵阳南山中学2019-2020学年高二下学期6月月考化学试题云南省大理州祥云县2019-2020学年高二下学期期末统测化学试题(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)安徽省池州市第一中学2022-2023学年高二下学期第一次月考化学试题
名校
6 . 化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq)。下列有关叙述中正确的是
CuS(s)+Mn2+(aq)。下列有关叙述中正确的是
①MnS的Ksp大于CuS的Ksp
②达到平衡时c(Mn2+)=c(Cu2+)
③向溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Mn2+)保持不变
④该反应的平衡常数K=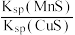
 CuS(s)+Mn2+(aq)。下列有关叙述中正确的是
CuS(s)+Mn2+(aq)。下列有关叙述中正确的是①MnS的Ksp大于CuS的Ksp
②达到平衡时c(Mn2+)=c(Cu2+)
③向溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Mn2+)保持不变
④该反应的平衡常数K=
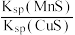
| A.①④ | B.②③ | C.①②③ | D.②③④ |
您最近一年使用:0次
2020-08-23更新
|
519次组卷
|
13卷引用:云南省昆明市四川师范大学昆明实验学校安宁校区2020-2021学年高二下学期入学化学试题
云南省昆明市四川师范大学昆明实验学校安宁校区2020-2021学年高二下学期入学化学试题新疆石河子第二中学2021-2022学年高二上学期第二次月考化学试题辽宁省沈阳市第十中学2021-2022学年高二上学期第一次月考化学试题云南省曲靖市宣威市第三中学2017-2018学年高二下学期3月月考化学试题(已下线)2019年1月7日 《每日一题》人教选修4-沉淀的生成与溶解黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期中考试化学试题云南省盈江县民族完全中学2019-2020学年高二上学期期末考试化学试题(已下线)本册综合检测(二)——2020-2021学年高二化学选修四同步单元AB卷(人教版)黑龙江绥化市第一中学2020-2021学年高二上学期第一次月考化学试题 (已下线)3.4.2 沉淀溶解平衡原理的应用(基础练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)江西省景德镇市乐平中学2021-2022学年高二下学期期末质量检测化学试题(已下线)BBWYhjhx1109.pdf海南省琼海市嘉积中学2023-2024学年高二上学期第一次月考化学试题
名校
7 . 痛风性关节病的发病机理和尿酸钠有关。室温下,将尿酸钠(NaUr)的悬浊液静置,取上层清液滴加盐酸,溶液中尿酸的浓度c(HUr)与pH的关系如图所示。已知Ksp(NaUr)=4.9×10-5mol2·L-2,Ka(HUr)=2.0×10-6mol·L-1。下列说法错误的是( )


| A.上层清液中,c(Ur-)=7.0×10-3mol·L-1 |
B.M→N的变化过程中,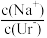 逐渐减小 逐渐减小 |
| C.N点时,c(Cl-)=c(HUr) |
| D.当c(HUr)=c(Ur-)时,c(H+)>c(OH-) |
您最近一年使用:0次
名校
8 . 现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的顺序是
①20mL 0.01mol·L-1 KCl溶液 ②30mL 0.02mol·L-1 CaCl2溶液③40mL 0.03mol·L-1 HCl溶液
①20mL 0.01mol·L-1 KCl溶液 ②30mL 0.02mol·L-1 CaCl2溶液③40mL 0.03mol·L-1 HCl溶液
| A.①>③>② | B.①>②>③ | C.②>①>③ | D.③>②>① |
您最近一年使用:0次
2020-04-28更新
|
85次组卷
|
4卷引用:江西省新建一中2020-2021学年高二下学期开学考试化学试题
19-20高二上·江西南昌·阶段练习
9 . 下列方程式书写正确的是( )
| A.Mg(OH)2的电离方程式:Mg(OH)2═Mg2+ +2OH- |
| B.小苏打溶液与少量澄清石灰水反应:HCO3- +OH- +Ca2+ ═CaCO3+H2O |
C.明矾净水原理:Al3+ + 3H2O Al(OH)3(胶体)+ 3H+ Al(OH)3(胶体)+ 3H+ |
| D.CaCO3沉淀溶解平衡方程式:CaCO3(s)═Ca2+(aq) +CO32-(aq) |
您最近一年使用:0次
2011·福建·一模
名校
解题方法
10 . 某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是( )
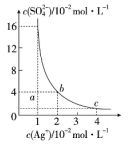

| A.b点对应的Ksp等于c点对应的Ksp |
| B.采取蒸发溶剂的方法可以使溶液从a点变到b点 |
| C.该温度下,Ag2SO4的溶度积常数(Ksp)为1.6×10-5(mol•L-1)3 |
| D.0.02mol•L-1的AgNO3溶液与的0.2mol•L-1的Na2SO4溶液等体积混合不会生成沉淀 |
您最近一年使用:0次
2020-04-17更新
|
604次组卷
|
16卷引用:新疆乌苏市第一中学2020-2021学年高二下学期入学检测化学(1-3班)试题
新疆乌苏市第一中学2020-2021学年高二下学期入学检测化学(1-3班)试题甘肃省兰州市第一中学2020-2021学年高二上学期期末考试化学试题(已下线)2011届福建省四地六校高三毕业班考前模拟考试(理综)化学部分(已下线)2012-2013学年福建省莆田一中高二下学期第一学段考试化学试卷2016-2017学年吉林省实验中学高二上学期期末化学试卷【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二上学期期末考试化学试题【全国百强校】江西省南昌市第二中学2018-2019学年高二上学期期末考试化学试题江西省上饶市上饶中学2019-2020学年高二上学期第二次月考化学(理科实验、重点)试题吉林省白城市第十四中学2020届高三上学期期末考试化学试题河北省保定市2019-2020学年高二上学期期末调研考试化学试题(已下线)【南昌新东方】2019 南大附中 高二上 期末河北省衡水市第十四中学2019-2020学年高二上学期第三次调研考试化学试题福建省福州第三中学2019-2020学年高二上学期期末考试化学试题江西省上高二中2020-2021学年高二上学期第三次月考化学试题江西省鄱阳县第一中学2019-2020学年高二上学期第二次检测化学试题云南省大理市下关第一中学2023-2024学年高二上学期12月月考化学试题



