1 . 下列实验操作、现象和所得到的结论均正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向某无色溶液中通入过量的 气体,产生白色沉淀 气体,产生白色沉淀 | 该溶液中一定含有 |
| B | 向浓度均为 的 的 和 和 的混合溶液中逐滴加入等浓度的 的混合溶液中逐滴加入等浓度的 溶液,先出现淡黄色沉淀 溶液,先出现淡黄色沉淀 |  |
| C | 在 溶液中加入一小块 溶液中加入一小块 ,金属 ,金属 溶解,并生成大量固体 溶解,并生成大量固体 | 该固体为 |
| D | 将浓硫酸滴到蔗糖表面,固体变黑膨胀 | 浓硫酸只表现脱水性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 工业上由MnS矿(还含少量FeCO3、MgO等)制备高纯硫酸锰,工艺如图所示:

已知相关金属离子(浓度为0.1mol·L-1)形成氢氧化物沉淀的pH范围如下:
(1)“酸浸”过程中,MnS(难溶)发生反应的离子方程式为_______ 。
(2)“酸浸”时MnO2应过量,目的是_______ 和_______ 。
(3)已知Ksp[Fe(OH)3]=4×10-38。常温下,当溶液的pH=2时,c(Fe3+)=_______ mol·L-1。
(4)“除杂”时若溶液pH过低,Mg2+沉淀不完全,原因是_______ 。
(5)“沉锰”反应的化学方程式为_______ 。

(6)用MnO2悬浊液吸收SO2也可以制取MnSO4。将SO2和空气的混合气通入MnO2悬浊液,测得吸收液中Mn2+、SO 的浓度随反应时间t变化如图。导致Mn2+、SO
的浓度随反应时间t变化如图。导致Mn2+、SO 浓度变化产生明显差异的原因是
浓度变化产生明显差异的原因是_______ 。

已知相关金属离子(浓度为0.1mol·L-1)形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Mg2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.8 | 8.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 3.2 | 10.9 |
(1)“酸浸”过程中,MnS(难溶)发生反应的离子方程式为
(2)“酸浸”时MnO2应过量,目的是
(3)已知Ksp[Fe(OH)3]=4×10-38。常温下,当溶液的pH=2时,c(Fe3+)=
(4)“除杂”时若溶液pH过低,Mg2+沉淀不完全,原因是
(5)“沉锰”反应的化学方程式为

(6)用MnO2悬浊液吸收SO2也可以制取MnSO4。将SO2和空气的混合气通入MnO2悬浊液,测得吸收液中Mn2+、SO
 的浓度随反应时间t变化如图。导致Mn2+、SO
的浓度随反应时间t变化如图。导致Mn2+、SO 浓度变化产生明显差异的原因是
浓度变化产生明显差异的原因是
您最近一年使用:0次
名校
解题方法
3 . 下列实验操作、现象和所得到的结论均正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向某无色溶液中通入过量的CO2气体,有白色沉淀产生 | 该溶液中一定含有SiO |
| B | 向浓度均为0.1mol·L-1的MgCl2和CuCl2的混合溶液中逐滴加入氨水,先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C | 在MgSO4溶液中加入一小块Na,金属Na溶解,并生成固体 | 该固体为Mg |
| D | 将浓硫酸滴到蔗糖表面固体变黑膨胀 | 浓硫酸只表现脱水性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-05-12更新
|
351次组卷
|
2卷引用:四川省南充市2022届高三适应性考试(三诊)理综化学试题
4 . 利用水钴矿(主要成分为Co2O3,含少量Fe2O3、FeO、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
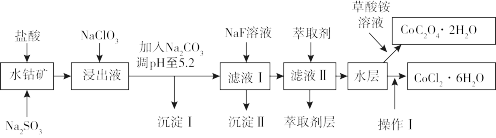
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中氧化剂与还原剂物质的量之比为___ 。
(2)NaClO3在浸出液中发生反应的离子方程式为___ 。
(3)加入Na2CO3调pH至5.2,目的是___ ;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为___ 。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___ 、___ 、过滤、洗涤、减压烘干等过程。
(5)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为___ 。[已知:CoC2O4·2H2O的摩尔质量为183g·mol-1]

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Co(OH)2 | 7.6 | 9.2 |
| Al(OH)3 | 4.0 | 5.2 |
| Mn(OH)2 | 7.7 | 9.8 |
(2)NaClO3在浸出液中发生反应的离子方程式为
(3)加入Na2CO3调pH至5.2,目的是
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,
(5)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
| 温度范围/℃ | 150~210 | 290~320 |
| 固体质量/g | 4.41 | 2.41 |
您最近一年使用:0次
2021-08-14更新
|
259次组卷
|
2卷引用:四川省蓬安中学校2020届高三10月月考化学试题
5 . 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol·L-1)如图所示。
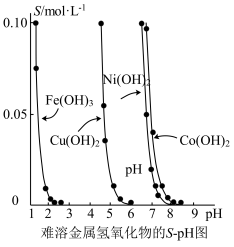
(1)pH=3时溶液中铜元素的主要存在形式是___________ 。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH___________(填序号)。
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,___________ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是___________ 。
(4)已知一些难溶电解质的溶度积常数如下表:
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的___________ (填序号)。
A.NaOH B.FeS C.Na2S
(5)向FeS的悬浊液加入Cu2+产生黑色的沉淀,反应的离子方程式为:___________ 该反应的平衡常数是:___________

(1)pH=3时溶液中铜元素的主要存在形式是
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH___________(填序号)。
| A.<1 | B.4左右 | C.>6 | D.>8 |
(4)已知一些难溶电解质的溶度积常数如下表:
| 物质 | FeS | MnS | CuS |
| Ksp | 6.5×10-18 | 2.5×10-13 | 1.3×10-35 |
| 物质 | PbS | HgS | ZnS |
| Ksp | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
A.NaOH B.FeS C.Na2S
(5)向FeS的悬浊液加入Cu2+产生黑色的沉淀,反应的离子方程式为:
您最近一年使用:0次
2021-08-14更新
|
1550次组卷
|
5卷引用:四川省蓬安中学校2019-2020学年高二下学期第一次阶段性考试化学试题
四川省蓬安中学校2019-2020学年高二下学期第一次阶段性考试化学试题(已下线)第3章 水溶液中的离子反应与平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)(已下线)第三章第四节 难溶电解的溶解平衡(备作业)-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)(已下线)3.4.2 沉淀溶解平衡原理的应用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)江苏省徐州市第七中学2021-2022学年高二下学期期中考试化学试题
6 . 常温下, 和
和 的沉淀溶解关系如图所示,其中
的沉淀溶解关系如图所示,其中 、
、 ,M为
,M为 或
或 ,
, 表示
表示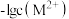 。下列说法正确的是
。下列说法正确的是
 和
和 的沉淀溶解关系如图所示,其中
的沉淀溶解关系如图所示,其中 、
、 ,M为
,M为 或
或 ,
, 表示
表示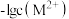 。下列说法正确的是
。下列说法正确的是
A.常温下,B点为 的不饱和溶液 的不饱和溶液 |
B.若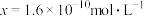 ,则 ,则 |
| C.若对A点浊液加热,A点沿曲线向上移动 |
D.在 和 和 同时沉淀的浊液中, 同时沉淀的浊液中, |
您最近一年使用:0次
2021-07-06更新
|
761次组卷
|
10卷引用:四川省南充市南部县第二中学2021-2022学年高二下学期5月月考化学试题
四川省南充市南部县第二中学2021-2022学年高二下学期5月月考化学试题四川省乐山市2020-2021学年高二下学期期末考试化学试题(已下线)必考点08 沉淀溶解平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)江西省抚州市2021-2022学年高二上学期期末学生学业质量监测化学试题四川省成都外国语学校2021-2022学年高二下学期入学考试化学试题四川省遂宁中学校2021-2022学年高二下学期期中考试化学试题山东师范大学附属中学2022-2023学年高二上学期期中水平测试化学试题广东省广州市华南师范大学附属中学2022-2023学年高二上学期12月月考化学试题广东省东莞市东莞中学松山湖学校2023-2024学年高二上学期期中考试化学试题 江西省南昌市第十中学2023-2024学年高二上学期第二次月考化学试题
解题方法
7 . 以菱锰矿(主要成分为MnCO3,还含有Fe3O4、FeO、MgCO3等杂质)为原料制备MnSO4的工艺流程如下图:
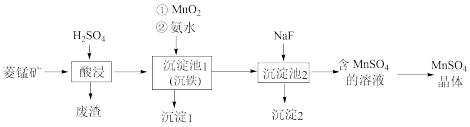
已知:常温下,Ksp(MnS)=1×10-11.金属离子生成氢氧化物沉淀的pH如下表:
(1)酸浸时选择H2SO4而不是HCl的原因可能是___________ 和___________ ,沉淀池1中,加入MnO2时发生反应的离子方程式为___________ 。
(2)该工艺流程中废渣和沉淀1、2均需用水洗涤,并将洗涤液返回酸浸工序,目的是___________ 。
(3)沉淀2的化学式是___________ ,不能用NaOH代替NaF,其原因是___________ 。
(4)含MnSO4溶液中还含有___________ 杂质(填离子符号),利用KMnO4溶液与Mn2+反应生成黑色沉淀的现象可以检验Mn2+,发生反应的离子方程式为___________ 。
(5)电解MnSO4溶液可进一步获得二氧化锰,电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥___________ mol·L-1。

已知:常温下,Ksp(MnS)=1×10-11.金属离子生成氢氧化物沉淀的pH如下表:
| 金属离子 | Fe3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀 | 1.5 | 6.3 | 7.6 | 9.6 |
| 完全沉淀 | 2.8 | 8.3 | 10.2 | 11.6. |
(2)该工艺流程中废渣和沉淀1、2均需用水洗涤,并将洗涤液返回酸浸工序,目的是
(3)沉淀2的化学式是
(4)含MnSO4溶液中还含有
(5)电解MnSO4溶液可进一步获得二氧化锰,电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥
您最近一年使用:0次
8 . 回答下列问题:
I.用石油裂化和裂解过程得到的乙烯、丙烯来合成聚丙烯酸乙酯的路线如下:
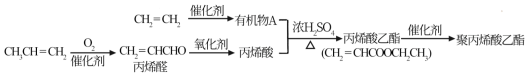
根据以上材料和你所学的化学知识回答:
(1)由CH2=CH2制得有机物A的化学反应类型是_______ 。
(2)有机物A与丙烯酸反应的方程式是_______ 。
(3)聚丙烯酸乙酯的结构简式是_______ 。
II.孔雀石的主要成分是CuCO3•Cu(OH)2,还含有少量的SiO2和铁的化合物。实验室以该孔雀石为原料制备CuSO4•5H2O的流程设计如下:
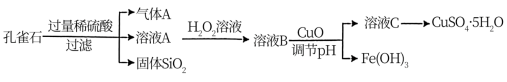
请回答:
(4)溶液A的金属离子有Cu2+、Fe3+、Fe2+。若要检验溶液A中的Fe2+,可选用的试剂_______ (填序号)。
a. KMnO4 b. KSCN c. NaCl d. K3[Fe(CN)6]
(5)溶液A中加入H2O2溶液的目的是将溶液中的Fe2+氧化为Fe3+,反应的离子方程式是:______ 。
(6)从溶液C中获得CuSO4•5H2O,需要经过蒸发浓缩、_______ 、过滤等操作。
I.用石油裂化和裂解过程得到的乙烯、丙烯来合成聚丙烯酸乙酯的路线如下:

根据以上材料和你所学的化学知识回答:
(1)由CH2=CH2制得有机物A的化学反应类型是
(2)有机物A与丙烯酸反应的方程式是
(3)聚丙烯酸乙酯的结构简式是
II.孔雀石的主要成分是CuCO3•Cu(OH)2,还含有少量的SiO2和铁的化合物。实验室以该孔雀石为原料制备CuSO4•5H2O的流程设计如下:

请回答:
(4)溶液A的金属离子有Cu2+、Fe3+、Fe2+。若要检验溶液A中的Fe2+,可选用的试剂
a. KMnO4 b. KSCN c. NaCl d. K3[Fe(CN)6]
(5)溶液A中加入H2O2溶液的目的是将溶液中的Fe2+氧化为Fe3+,反应的离子方程式是:
(6)从溶液C中获得CuSO4•5H2O,需要经过蒸发浓缩、
您最近一年使用:0次
9 . 氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
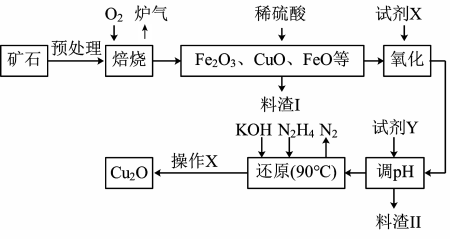
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
(1)炉气中的有害气体成分是________ ,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为______ 。
(2)试剂X是H2O2溶液,当试剂X是___________ 时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是________ 。
(4)“还原”步骤中为提高N2H4转化率可采取的措施有_________ (填序号)。
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为_______________
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是____________ 。

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
| Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀 | 7.5 | 2.7 | 4.8 |
| 完全沉淀 | 9.0 | 3.7 | 6.4 |
(2)试剂X是H2O2溶液,当试剂X是
(3)加入试剂Y调pH时,pH的调控范围是
(4)“还原”步骤中为提高N2H4转化率可采取的措施有
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是
您最近一年使用:0次
名校
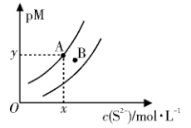
10 . t ℃时,两种碳酸盐MCO3(M表示X2+或Y2+)的沉淀溶解平衡曲线如图所示。已知:pM=-lgc(M2+),p(CO )=-lgc(CO
)=-lgc(CO ),XCO3溶解度比YCO3大。下列说法正确的是
),XCO3溶解度比YCO3大。下列说法正确的是

 )=-lgc(CO
)=-lgc(CO ),XCO3溶解度比YCO3大。下列说法正确的是
),XCO3溶解度比YCO3大。下列说法正确的是
| A.线b表示YCO3的溶解平衡曲线 |
B.a、b线上任意点均存在c(M2+)=c(CO ) ) |
C.t ℃时,XCO3(s)+Y2+(aq) YCO3(s)+X2+(aq)平衡常数为K,其数量级为102 YCO3(s)+X2+(aq)平衡常数为K,其数量级为102 |
| D.向YCO3悬浊液中加入饱和X(NO3)2溶液,可能有XCO3生成 |
您最近一年使用:0次



