1 . 化学与生活等密切相关,下列说法错误的是
| A.铁质菜刀生锈与氧化还原反应有关 |
| B.明矾溶于水后能形成胶体,可用于净水 |
| C.铵态氮肥与熟石灰混合研磨时有刺激性气味的气体产生 |
| D.利用同位素的放射性可以进行医疗诊断和治疗,所以放射性同位素都是有益的 |
您最近一年使用:0次
2 . 下列装置(容器中的液体均足量)中,铁的腐蚀速率最快的是
A.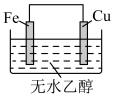 | B.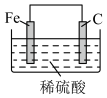 |
C.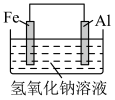 | D.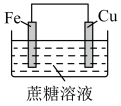 |
您最近一年使用:0次
3 . 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
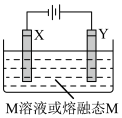

| A.电流由电源正极经导线流向Y极,再经电解质溶液或熔融态电解质流到X极,最后X极经导线流回电源负极 |
| B.铜电解精炼中,X是粗铜,Y是纯铜,M是CuSO4溶液 |
| C.X、Y均为石墨电极,电解熔融氯化铝制备金属铝 |
| D.外加电流的阴极保护法中,Y是待保护金属 |
您最近一年使用:0次
2023-12-11更新
|
94次组卷
|
2卷引用:福建省南平市高级中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
4 . 请回答下列问题:
(1)高铁酸钾( )不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图所示是高铁电池的模拟实验装置。
)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图所示是高铁电池的模拟实验装置。
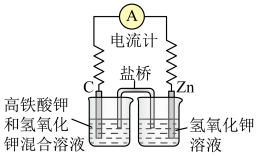
①该电池放电时正极反应式为___________ 。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向___________ (填“左”或“右”)移动;
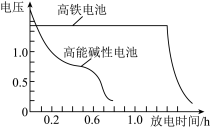
③下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有___________ 。
(2)铜是人类最早使用的金属,它与人类生产、生活关系密切,请运用所学知识解释下列与铜有关的化学现象。
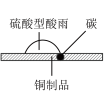
①如图,在硫酸型酸雨地区,不纯的铜制品发生电化学腐蚀,Cu发生___________ (填“氧化”或“还原”)反应,写出正极的电极反应式:___________ 。
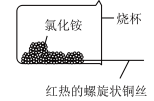
②如下图,将螺旋状的铜丝在酒精灯上灼烧,铜丝变黑色,然后将红热的铜丝插入 固体中,过一会取出,发现插入部分黑色变为光亮的红色,查阅资料可知,该过程有
固体中,过一会取出,发现插入部分黑色变为光亮的红色,查阅资料可知,该过程有 生成,写出由黑色变为光亮红色过程中反应的化学方程式:
生成,写出由黑色变为光亮红色过程中反应的化学方程式:___________ 。
(3)一定温度下,反应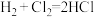 中的某一基元反应为
中的某一基元反应为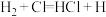 ,其能量变化如图所示。
,其能量变化如图所示。 表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。
表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。
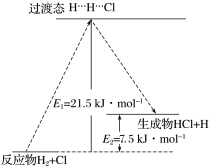
该基元反应的活化能为___________ kJ/mol, 为
为___________ kJ/mol。
(4)键能也可以用于估算化学反应的反应热( )。下表是部分化学键的键能数据:
)。下表是部分化学键的键能数据:
已知白磷的标准燃烧热为-2378kJ/mol,白磷的结构为正四面体,白磷完全燃烧的产物结构如图所示,则上表中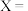
___________ 。
(1)高铁酸钾(
 )不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图所示是高铁电池的模拟实验装置。
)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图所示是高铁电池的模拟实验装置。
①该电池放电时正极反应式为
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向
③下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有

(2)铜是人类最早使用的金属,它与人类生产、生活关系密切,请运用所学知识解释下列与铜有关的化学现象。
①如图,在硫酸型酸雨地区,不纯的铜制品发生电化学腐蚀,Cu发生

②如下图,将螺旋状的铜丝在酒精灯上灼烧,铜丝变黑色,然后将红热的铜丝插入
 固体中,过一会取出,发现插入部分黑色变为光亮的红色,查阅资料可知,该过程有
固体中,过一会取出,发现插入部分黑色变为光亮的红色,查阅资料可知,该过程有 生成,写出由黑色变为光亮红色过程中反应的化学方程式:
生成,写出由黑色变为光亮红色过程中反应的化学方程式:
(3)一定温度下,反应
 中的某一基元反应为
中的某一基元反应为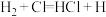 ,其能量变化如图所示。
,其能量变化如图所示。 表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。
表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。
该基元反应的活化能为
 为
为(4)键能也可以用于估算化学反应的反应热(
 )。下表是部分化学键的键能数据:
)。下表是部分化学键的键能数据:| 化学键 |  |  |  | 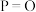 |
| 键能/(kJ/mol) | 172 | 335 | 498 | X |

您最近一年使用:0次
解题方法
5 . 研究金属腐蚀和防腐的原理很有现实意义。
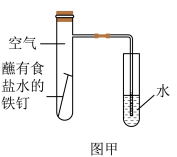
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置实验,导管中液柱上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有_______(填序号)。
(2)该小组将甲图装置改进成乙图装置并进行实验,导管中红墨水液柱高度随时间的变化如表,根据数据判断腐蚀的速率随时间逐渐_______ (填“加快”、“不变”、“减慢”),你认为影响因素为_______ 。
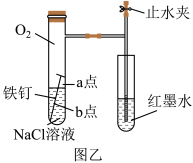
(3)为探究铁钉腐蚀实验a、b两点所发生的反应,进行以下实验,完成表格空白(已知铁氰化钾溶液遇亚铁离子显蓝色,常用于亚铁离子的检验);
根据以上实验探究,试判断③_______ (填“a”或“b”)为负极,该点腐蚀更严重。
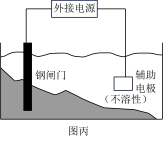
(4)图丙中钢闸门应与外接电源的_______ 相连(填“正极”或“负极”)钢闸门不会被腐蚀,属于_______ 保护法。
(5)金属阳极钝化是另一种电化学防腐方法。将Fe作阳极置于H2SO4溶液中,一定条件下Fe钝化形成致密Fe3O4氧化膜,写出该阳极电极反应式是_______ 。
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置实验,导管中液柱上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有_______(填序号)。

| A.用纯氧气代替试管内空气 | B.用酒精灯加热试管提高温度 |
| C.将铁钉换成铁粉和炭粉混合粉末 | D.换成更细的导管,水中滴加红墨水 |
(2)该小组将甲图装置改进成乙图装置并进行实验,导管中红墨水液柱高度随时间的变化如表,根据数据判断腐蚀的速率随时间逐渐

| 时间/min | 1 | 3 | 5 | 7 | 9 |
| 液柱高度/cm | 0.8 | 2.1 | 3.0 | 3.7 | 4.2 |
(3)为探究铁钉腐蚀实验a、b两点所发生的反应,进行以下实验,完成表格空白(已知铁氰化钾溶液遇亚铁离子显蓝色,常用于亚铁离子的检验);
| 实验操作 | 实验现象 | 实验结论 |
| 向NaCl溶液中滴加2~3滴酚酞指示剂 | a点附近溶液出现红色 | a点电极反应为① |
| 然后再滴加2~3滴铁氰化钾溶液 | b点周围出现蓝色沉淀 | b点电极反应为② |
(4)图丙中钢闸门应与外接电源的

(5)金属阳极钝化是另一种电化学防腐方法。将Fe作阳极置于H2SO4溶液中,一定条件下Fe钝化形成致密Fe3O4氧化膜,写出该阳极电极反应式是
您最近一年使用:0次
2023-11-18更新
|
172次组卷
|
2卷引用:福建省漳州市十校2023-2024学年高二上学期期中联考化学试题
名校
解题方法
6 . 某小相同学为探究电极对金属腐蚀与防护的影响,设计如下实验:将饱和食盐水与琼脂(凝固剂,不参与反应)的混合液置于两个培养皿中,向其中滴入少量酚酞溶液和 溶液,混合均匀,分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如表。已知:
溶液,混合均匀,分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如表。已知: 遇到
遇到 能产生蓝色沉淀,对有关实验现象及分析不正确的是
能产生蓝色沉淀,对有关实验现象及分析不正确的是
 溶液,混合均匀,分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如表。已知:
溶液,混合均匀,分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如表。已知: 遇到
遇到 能产生蓝色沉淀,对有关实验现象及分析不正确的是
能产生蓝色沉淀,对有关实验现象及分析不正确的是变红变蓝 | 变红 |
| ⅰ.包裹铜片的铁钉 | ⅱ.包裹锌片的铁钉 |
| A.两个培养皿中金属均发生吸氧腐蚀,且铁钉腐蚀速度ⅰ快 |
| B.该实验证明,若给金属表面镀活泼性比被保护金属强的金属,则破损后依旧可以防护 |
| C.培养皿ⅱ中对铁钉的防护是牺牲阳极的阴极保护法 |
| D.随着反应的进行,培养皿ⅰ和ⅱ中均出现红褐色浑浊 |
您最近一年使用:0次
2023-11-16更新
|
396次组卷
|
2卷引用:福建省龙岩第一中学2023-2024学年高二上学期第三次月考化学试题
7 . 某小组学生研究常见的金属腐蚀现象,分析其原理。按要求回答下列问题。
(1)化学反应速率由快到慢的顺序为___________________ 。(填序号,下同)探究浓度对化学反应速率影响的是___________ ;探究温度对化学反应速率影响的是___________ ;①③探究___________ 对化学反应速率影响。某同学查资料得知向上面的实验体系中加入硫酸铜固体能加快反应速率,其原因为___________ 。
(2)乙同学将锥形瓶内壁用酸化的饱和食盐水润洗后,放入混合均匀的铁粉和碳粉,塞紧瓶塞,同时用压强传感器测得锥形瓶内压强的变化,如图所示。
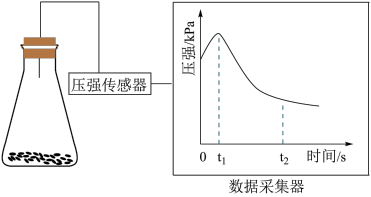
①0~ 时,碳粉表面生成的气体为
时,碳粉表面生成的气体为___________ 。
② ~
~ 时,碳粉表面发生的电极反应式为
时,碳粉表面发生的电极反应式为___________ 。
③0~ 电化学腐蚀过程中,铁极的电极反应式为
电化学腐蚀过程中,铁极的电极反应式为___________ 。
(3)丙同学研读如下一次性保暖贴说明书,并分析暖贴工作原理。
①暖贴工作时,铁粉发生的反应为___________ (填“氧化反应”或“还原反应”)。
②暖贴发热时,正极材料为___________ ;食盐的作用为___________ 。
③当暖贴放热结束时,铁粉转化成的物质中可能含有___________ 。(填两种物质)
| 实验 | ① | ② | ③ | ④ |
| 浓度 | 50mL 4mol /L 溶液 溶液 | 50mL 2mol/L  溶液 溶液 | 50mL 4mol/L  溶液 溶液 | 50mL 4mol/L  溶液 溶液 |
| 温度/℃ | 20 | 20 | 20 | 40 |
| 固体形状 |  块状 Zn 块状 Zn |  块状 Zn 块状 Zn |  粉末状 Zn 粉末状 Zn |  块状Zn 块状Zn |
(2)乙同学将锥形瓶内壁用酸化的饱和食盐水润洗后,放入混合均匀的铁粉和碳粉,塞紧瓶塞,同时用压强传感器测得锥形瓶内压强的变化,如图所示。

①0~
 时,碳粉表面生成的气体为
时,碳粉表面生成的气体为②
 ~
~ 时,碳粉表面发生的电极反应式为
时,碳粉表面发生的电极反应式为③0~
 电化学腐蚀过程中,铁极的电极反应式为
电化学腐蚀过程中,铁极的电极反应式为(3)丙同学研读如下一次性保暖贴说明书,并分析暖贴工作原理。
| 品名:一次性保暖贴 主要成分:铁粉、水、食盐、活性炭、蛭石、吸水性树脂 产品性能:平均温度55,最高温度63,发热时间12小时以上 |
②暖贴发热时,正极材料为
③当暖贴放热结束时,铁粉转化成的物质中可能含有
您最近一年使用:0次
名校
解题方法
8 . 用如图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强随时间变化关系以及溶解氧随时间变化关系的曲线如下。下列说法正确的是
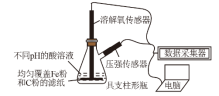



| A.pH=6.0时,正极电极反应式为:O2+2H2O+4e-=4OH– |
| B.整个过程中,负极电极反应式均为:Fe–3e-=Fe3+ |
| C.pH=4.0时,同时发生析氢腐蚀和吸氧腐蚀 |
| D.将铁换成铜进行实验,pH=2.0时,压强随时间变化的曲线走势与铁基本相同 |
您最近一年使用:0次
2023-11-11更新
|
238次组卷
|
3卷引用:福建省福州市八县一中2023-2024学年高二上学期11月期中化学试题
9 . NA代表阿伏加德罗常数的值。下列说法正确的是
| A.在氢氧燃料电池中,负极有11.2L(标准状况)气体参与反应时,转移的电子数为2NA |
| B.在氯碱工业中,制备80g烧碱时,阴极生成气体的分子数为NA |
| C.在钢铁吸氧腐蚀中,若有1mol Fe被腐蚀,被还原的O2分子数最多为0.5NA |
| D.甲烷燃烧热ΔH=-890kJ·mol-1,当0.5mol甲烷完全燃烧放出445kJ热量时,生成H2O(g)为NA |
您最近一年使用:0次
2023-11-11更新
|
145次组卷
|
2卷引用:福建省福州市八县一中2023-2024学年高二上学期11月期中化学试题
名校
10 . 下列说法正确的是
| A.在电镀中,镀层金属作阳极,待镀金属作阴极 |
| B.已知C(石墨,s)=C(金刚石,s) ∆H=+1.9kJ·mol-1,则金刚石比石墨稳定 |
| C.水库的钢闸门与电源负极相连以防止其生锈,此为牺牲阳极的阴极保护法 |
| D.增大浓度能增大单位体积内活化分子的百分数,从而增大反应速率 |
您最近一年使用:0次



