名校
解题方法
1 . 任何化学反应都伴随着能量的变化,通过化学反应,化学能可以与热能、电能等不同形式的能量相互转化,用于生产、生活和科研。请回答下列问题:
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋利用_____ (填“放热”或“吸热”)的化学变化或物理变化的原理。
(2)世博会中国馆、主题馆等建筑所使用的光伏电池,总功率达4兆瓦,是历届世博会之最。光伏电池能将_____ 直接转变为电能(填:“化学能”“太阳能”“热能”等)
(3)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过氨热分解法制氢气。相关化学键的键能数据
一定温度下,利用催化剂将 分解为
分解为 和3 mol
和3 mol  ,吸收90.8 kJ热量,则
,吸收90.8 kJ热量,则
_____ 。
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“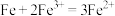 ”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液
”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液_____ 。______ (填“正”或“负”)极,其电极反应式为_____ 。
②电池工作过程中,若A极区产生14 g ,则转移的电子数目为
,则转移的电子数目为______ 。
③有人提出可用甲烷去替代肼,此时惰性电极A发生的电极反应式为______ 。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋利用
(2)世博会中国馆、主题馆等建筑所使用的光伏电池,总功率达4兆瓦,是历届世博会之最。光伏电池能将
(3)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过氨热分解法制氢气。相关化学键的键能数据
| 化学键 |  |  |  |
键能E/(kJ·mol ) ) | 946.0 | a | 390.8 |
 分解为
分解为 和3 mol
和3 mol  ,吸收90.8 kJ热量,则
,吸收90.8 kJ热量,则
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“
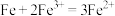 ”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液
”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液
②电池工作过程中,若A极区产生14 g
 ,则转移的电子数目为
,则转移的电子数目为③有人提出可用甲烷去替代肼,此时惰性电极A发生的电极反应式为
您最近一年使用:0次
2024-05-04更新
|
543次组卷
|
2卷引用:广东省深圳市翠园中学、龙城高级中学2023-2024学年高一下学期第一次月考化学试题
名校
2 . 某化学兴趣小组为了探索Zn电极在原电池中的作用,设计并进行了以下一系列实验。
已知:Zn与Al的化学性质基本相似, 。
。
回答下列问题:
(1)实验1:电极材料为Mg和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Zn。
①正极的电极反应式为___________ 。
②每转移0.1 mol电子,此时负极材料减少的质量为___________ g。
(2)实验2:电极材料为Cu和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Cu。
由实验1和实验2可知,Mg、Zn、Cu三种金属活动性由强到弱的顺序为___________ 。
(3)实验3:电极材料为石墨和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
①电池工作一段时间后,电解质溶液的pH将___________ (填“变大”、“变小”或“不变”)。
②石墨电极上发生___________ (填“氧化”或“还原”)反应。
(4)实验4:电极材料为Mg和Zn,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向Mg。
①负极的电极反应式为___________ 。
②外电路中电子的流动方向为___________ 。
(5)根据实验1、实验2、实验3、实验4,可总结出影响Zn电极在原电池中得到或失去电子的因素为___________ 。
已知:Zn与Al的化学性质基本相似,
 。
。回答下列问题:
(1)实验1:电极材料为Mg和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Zn。
①正极的电极反应式为
②每转移0.1 mol电子,此时负极材料减少的质量为
(2)实验2:电极材料为Cu和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Cu。
由实验1和实验2可知,Mg、Zn、Cu三种金属活动性由强到弱的顺序为
(3)实验3:电极材料为石墨和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
①电池工作一段时间后,电解质溶液的pH将
②石墨电极上发生
(4)实验4:电极材料为Mg和Zn,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向Mg。
①负极的电极反应式为
②外电路中电子的流动方向为
(5)根据实验1、实验2、实验3、实验4,可总结出影响Zn电极在原电池中得到或失去电子的因素为
您最近一年使用:0次
2023-04-18更新
|
350次组卷
|
7卷引用:广东省汕头市2022-2023学年高一下学期4月期中考试化学试题
名校
3 . 回答下列问题
(1)依据反应: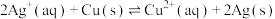 设计的原电池如下图甲所示。
设计的原电池如下图甲所示。
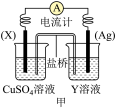
①电极 的材料是
的材料是_______ ;Y溶液可以是_______ ;
②银电极上发生的电极反应式是_______ , 电极上发生的电极反应为
电极上发生的电极反应为_______ 反应(填“氧化”或“还原”);外电路中的电子_______ (填“流出”或“流向”)Ag电极。
(2)次磷酸 是一种精细化工产品,已知
是一种精细化工产品,已知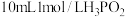 与
与 的
的 溶液充分反应后生成组成为
溶液充分反应后生成组成为 的盐,则:
的盐,则:
①次磷酸 属于
属于_______ (填“一元酸”“二元酸”或“无法确定”)。
②设计实验方案,证明次磷酸是弱酸:_______ 。
(3)某课外兴趣小组用 的
的 标准溶液滴定未知浓度的盐酸溶液,实验操作如下,请完成以下问题。
标准溶液滴定未知浓度的盐酸溶液,实验操作如下,请完成以下问题。
①该小组同学选用酚酞做指示剂,滴定终点的现象为_______ 。
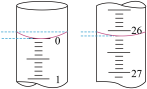
②该小组某一次滴定操作中,酸式滴定管的始终液面如图所示,则本次滴入的盐酸体积为_______  。
。
③下列操作中,可能使所测盐酸溶液的浓度值偏低的是_______
A.碱式滴定管末用标准氢氧化钠溶液润洗就直接注入标准溶液
B.碱式滴定管在滴定前有气泡,滴定后气泡消失
C.读取氢氧化钠体积时,滴定结束时俯视读数
D.滴定前盛放盐酸溶液的锥形瓶用蒸馏水洗净后没有干燥
(1)依据反应:
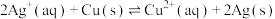 设计的原电池如下图甲所示。
设计的原电池如下图甲所示。
①电极
 的材料是
的材料是②银电极上发生的电极反应式是
 电极上发生的电极反应为
电极上发生的电极反应为(2)次磷酸
 是一种精细化工产品,已知
是一种精细化工产品,已知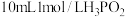 与
与 的
的 溶液充分反应后生成组成为
溶液充分反应后生成组成为 的盐,则:
的盐,则:①次磷酸
 属于
属于②设计实验方案,证明次磷酸是弱酸:
(3)某课外兴趣小组用
 的
的 标准溶液滴定未知浓度的盐酸溶液,实验操作如下,请完成以下问题。
标准溶液滴定未知浓度的盐酸溶液,实验操作如下,请完成以下问题。①该小组同学选用酚酞做指示剂,滴定终点的现象为
②该小组某一次滴定操作中,酸式滴定管的始终液面如图所示,则本次滴入的盐酸体积为
 。
。
③下列操作中,可能使所测盐酸溶液的浓度值偏低的是
A.碱式滴定管末用标准氢氧化钠溶液润洗就直接注入标准溶液
B.碱式滴定管在滴定前有气泡,滴定后气泡消失
C.读取氢氧化钠体积时,滴定结束时俯视读数
D.滴定前盛放盐酸溶液的锥形瓶用蒸馏水洗净后没有干燥
您最近一年使用:0次
2023-01-08更新
|
179次组卷
|
2卷引用:广东省广州中学2022-2023学年高二上学期期末考试化学试题
解题方法
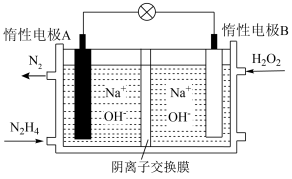
4 . 无论是在环境保护领域还是在工农业生产领域,氮及其化合物一直是我国科研重点。回答下列问题:
(1)下列过程属于氮的固定过程的是_______(填选项字母)。
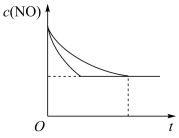
(2)消除汽车尾气中的氮氧化合物的原理之一为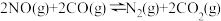 。一定温度下,向体积为5L的刚性密闭容器中充入0.5molNO和0.5molCO,发生上述反应,测得部分气体的物质的量随时间变化关系如图所示:
。一定温度下,向体积为5L的刚性密闭容器中充入0.5molNO和0.5molCO,发生上述反应,测得部分气体的物质的量随时间变化关系如图所示:
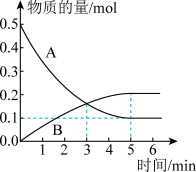
①其中B表示_______ (填“ ”或“
”或“ ”)物质的量的变化曲线。
”)物质的量的变化曲线。
②该温度下,反应开始至5min时该反应的平均反应速率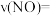
_______ 。
③3min时,反应_______ (填“达到”或“未达到”)化学平衡,6min时,正反应速率_______ (填“>”“<”或“=”)逆反应速率。
④下列情况能说明该反应达到平衡状态的是_______ (填选项字母)。
A.化学反应速率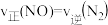
B.CO与 的物质的量之和不再发生变化
的物质的量之和不再发生变化
C.容器内气体压强不再发生变化
D.容器内混合气体密度不再发生变化
(3)实验室用NaOH溶液对氮氧化合物进行尾气吸收,例如NaOH溶液可将 转化为
转化为 和
和 。该吸收过程中发生反应的离子方程式为
。该吸收过程中发生反应的离子方程式为_______ 。
(4)某固体氧化物为电解质的新型燃料电池是以液态肼(N2H4)为燃料,氧气为氧化剂构成,其原理示意图如图所示。
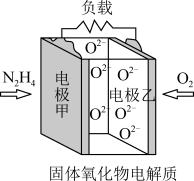
该电池的正极为_______ (填“电极甲”或“电极乙”,下同);电池工作时, 向
向_______ 移动。
(1)下列过程属于氮的固定过程的是_______(填选项字母)。
| A.工业合成氨 |
| B.工业利用氨气合成硝酸 |
| C.雷雨天中氮气与氧气生成氮氧化合物 |
| D.通过碱性试剂将气态的氮氧化合物转化为固态含氮化合物 |
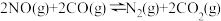 。一定温度下,向体积为5L的刚性密闭容器中充入0.5molNO和0.5molCO,发生上述反应,测得部分气体的物质的量随时间变化关系如图所示:
。一定温度下,向体积为5L的刚性密闭容器中充入0.5molNO和0.5molCO,发生上述反应,测得部分气体的物质的量随时间变化关系如图所示:
①其中B表示
 ”或“
”或“ ”)物质的量的变化曲线。
”)物质的量的变化曲线。②该温度下,反应开始至5min时该反应的平均反应速率
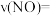
③3min时,反应
④下列情况能说明该反应达到平衡状态的是
A.化学反应速率
B.CO与
 的物质的量之和不再发生变化
的物质的量之和不再发生变化C.容器内气体压强不再发生变化
D.容器内混合气体密度不再发生变化
(3)实验室用NaOH溶液对氮氧化合物进行尾气吸收,例如NaOH溶液可将
 转化为
转化为 和
和 。该吸收过程中发生反应的离子方程式为
。该吸收过程中发生反应的离子方程式为(4)某固体氧化物为电解质的新型燃料电池是以液态肼(N2H4)为燃料,氧气为氧化剂构成,其原理示意图如图所示。

该电池的正极为
 向
向
您最近一年使用:0次
名校
5 . 阅读题目,回答问题:
(1)FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为____ ,若将此反应设计成原电池,请写出该原电池负极电极反应为____ ,正极电极反应为____ 。
(2)为探究FeCl3在H2O2制取O2反应中的作用,某兴趣小组进行下列实验:向试管中加入5mL11mol·L-1H2O2溶液,静置几分钟,无明显现象;滴加2滴1mol·L-1FeCl3溶液,立即产生大量气泡。(已知H2O2不与Cl-反应)
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5mol·L-1,则20min内H2O2的平均反应速率为_____ 。
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以实验,可推断出:在H2O2制O2反应中,FeCl3作____ 剂。
(3)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。某兴趣小组为探究外界条件对H2O2分解反应速率的影响,设计如表所示实验。
填写表中空白内容:II____ ,III____ ,IV____ 。
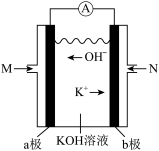
(4)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。

①该电池的正极是电极____ (填“a”或“b”),负极发生反应的方程式为____ 。
②电池工作时,溶液中的K+会向____ 区移动(填“正极”或“负极”),当外电路中转移1mol电子时,消耗的O2在标准状况下体积为____ 。
(1)FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为
(2)为探究FeCl3在H2O2制取O2反应中的作用,某兴趣小组进行下列实验:向试管中加入5mL11mol·L-1H2O2溶液,静置几分钟,无明显现象;滴加2滴1mol·L-1FeCl3溶液,立即产生大量气泡。(已知H2O2不与Cl-反应)
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5mol·L-1,则20min内H2O2的平均反应速率为
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以实验,可推断出:在H2O2制O2反应中,FeCl3作
(3)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。某兴趣小组为探究外界条件对H2O2分解反应速率的影响,设计如表所示实验。
| 试管编号 | 实验目的 | H2O2溶液 | 温度 | 水的体积/mL | FeCl3溶液体积/mL | |
| 质量分数 | 体积/mL | |||||
| I | 为编号II实验的参照 | 12% | 5.0 | 常温 | 0 | 0 |
| II | 温度对反应速率的影响 | —— | 5.0 | 60℃ | 0 | 0 |
| III | 为编号IV实验的参照 | 4.0% | 5.0 | 常温 | —— | 0 |
| IV | —— | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中空白内容:II
(4)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。

①该电池的正极是电极
②电池工作时,溶液中的K+会向
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题:
(1)已知Al与NaOH溶液发生反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑,某同学欲根据此反应设计一个原电池装置,部分设计如图:
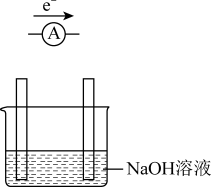
①请将该原电池装置补充完整,并于装置中标明电极正负极____ 。
②负极所用电极材料为____ ,该电极对应的电极反应方程式为___ 。
(2)实验小组对可逆反应aX(g)+bY(g) pZ(g)进行探究。回答下列问题:
pZ(g)进行探究。回答下列问题:
T℃时,起始向10L恒容密闭容器中充入X、Y,测得反应过程中X、Y、Z三种气体的物质的量(n)与时间(t)的关系如图所示。
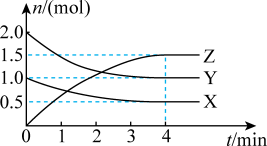
①0~4min内的反应速率 (Y)=
(Y)=____ 。
②为提高此反应的速率,下列措施可行的是____ (填字母代号)。
A.移出Z B.使用适合催化剂 C.降低温度 D.增大压强
③该反应达最大限度时Y的体积分数为____ (保留一位小数)。
④下列描述能表示该反应达平衡状态的是____ 。
A.容器内的混合气体的平均相对分子质量不再改变
B.容器内压强不再发生变化
C.2 (X)=
(X)= (Y)
(Y)
D.X的体积分数不再改变
(1)已知Al与NaOH溶液发生反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑,某同学欲根据此反应设计一个原电池装置,部分设计如图:

①请将该原电池装置补充完整,并于装置中标明电极正负极
②负极所用电极材料为
(2)实验小组对可逆反应aX(g)+bY(g)
 pZ(g)进行探究。回答下列问题:
pZ(g)进行探究。回答下列问题:T℃时,起始向10L恒容密闭容器中充入X、Y,测得反应过程中X、Y、Z三种气体的物质的量(n)与时间(t)的关系如图所示。

①0~4min内的反应速率
 (Y)=
(Y)=②为提高此反应的速率,下列措施可行的是
A.移出Z B.使用适合催化剂 C.降低温度 D.增大压强
③该反应达最大限度时Y的体积分数为
④下列描述能表示该反应达平衡状态的是
A.容器内的混合气体的平均相对分子质量不再改变
B.容器内压强不再发生变化
C.2
 (X)=
(X)= (Y)
(Y)D.X的体积分数不再改变
您最近一年使用:0次
2022-05-13更新
|
357次组卷
|
4卷引用:广东珠海市斗门第一中学2021-2022学年高一下学期期中考试化学试题
广东珠海市斗门第一中学2021-2022学年高一下学期期中考试化学试题广东省揭阳市惠来县第一中学2021-2022学年高一下学期第二次阶段考试化学试题(已下线)第08练 化学反应的限度-2022年【暑假分层作业】高一化学(人教版2019必修第二册)河北省张家口市张北县第一中学2021-2022学年高一下学期6月月考化学试题
名校
解题方法
7 . 请回答下列问题:
(1)I氮的氧化物(NOx)是大气主要污染物,有效去除大气中的NOx是环境保护的重要课题。
已知:①N2(g)+O2(g)= 2NO(g) △H1 =+ 180.5kJ/mol
②2NO(g)+ O2(B) = 2NO2(g) △H2 = - 114.14kJ/mol
③3NO(g) = N2O(g)+ NO2(g) △H3 = -115.52kJ/mol
则反应:2N2O(g) = 2N2(g)+ O2(g) △H =___________ kJ/mol
II.依据氧化还原反应:2Ag+(aq)+ Cu(s)= Cu2+(aq)+ 2Ag(s)设计的原电池如图所示。请回答下列问题:
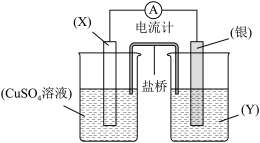
(2)电极X的材料是___________ ;电解质溶液Y是 ___________ ;
(3)银电极为电池的___________ 极,发生的电极反应为___________ ;X电极上发生的电极反应为 ___________ ;
III.锂锰电池的体积小,性能优良,是常用的一次电池,该电池的反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入 MnO2晶格中,生成LiMnO2。回答下列问题:
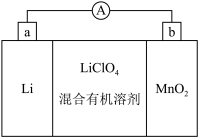
(4)电池正极反应式为___________ 。
(5)是否可用水代替电池中的混合有机溶剂?___________ (填“是”或“否”),原因是: ___________ 。
(6)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为___ 。
(1)I氮的氧化物(NOx)是大气主要污染物,有效去除大气中的NOx是环境保护的重要课题。
已知:①N2(g)+O2(g)= 2NO(g) △H1 =+ 180.5kJ/mol
②2NO(g)+ O2(B) = 2NO2(g) △H2 = - 114.14kJ/mol
③3NO(g) = N2O(g)+ NO2(g) △H3 = -115.52kJ/mol
则反应:2N2O(g) = 2N2(g)+ O2(g) △H =
II.依据氧化还原反应:2Ag+(aq)+ Cu(s)= Cu2+(aq)+ 2Ag(s)设计的原电池如图所示。请回答下列问题:

(2)电极X的材料是
(3)银电极为电池的
III.锂锰电池的体积小,性能优良,是常用的一次电池,该电池的反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入 MnO2晶格中,生成LiMnO2。回答下列问题:

(4)电池正极反应式为
(5)是否可用水代替电池中的混合有机溶剂?
(6)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为
您最近一年使用:0次
名校
8 . 甲烷和乙烯是常见的两种有机化合物,在生产生活中有广泛的应用。
Ⅰ.以甲烷等碳氢化合物为燃料的新型燃料电池,成本大大低于以氢气为燃料的传统燃料电池。一种以甲烷为燃料的电池装置示意图如图。
(1)N口通入的气体是_______ (填化学式)。
(2)外电路中电流的方向是由_______ 极到_______ 极(填“a”或“b”)。
(3)a极为_______ 极(填“正”或“负”),其电极方程式为_______ 。
(4)电路中每转移0.8mol电子,标准状况下消耗O2的体积是_______ L。
Ⅱ.石油裂解可得到重要的化工原料乙烯(CH2=CH2),有关乙烯的部分转化关系如图:
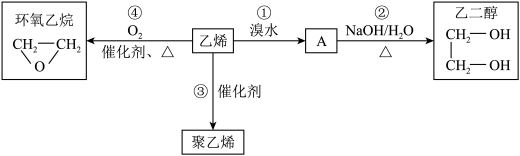
回答下列问题:
(5)写出A的结构简式:_______ 。
(6)②的反应类型为_______ 。
(7)反应③的化学方程式为_______ 。
(8)已知反应④的原子利用率为100%,其化学方程式为_______ 。
Ⅰ.以甲烷等碳氢化合物为燃料的新型燃料电池,成本大大低于以氢气为燃料的传统燃料电池。一种以甲烷为燃料的电池装置示意图如图。

(1)N口通入的气体是
(2)外电路中电流的方向是由
(3)a极为
(4)电路中每转移0.8mol电子,标准状况下消耗O2的体积是
Ⅱ.石油裂解可得到重要的化工原料乙烯(CH2=CH2),有关乙烯的部分转化关系如图:

回答下列问题:
(5)写出A的结构简式:
(6)②的反应类型为
(7)反应③的化学方程式为
(8)已知反应④的原子利用率为100%,其化学方程式为
您最近一年使用:0次
解题方法
9 . I.种新型催化剂能使 和
和 发生反应:
发生反应: 。为研究化学反应速率的影响因素,在恒容条件下,某同学设计了三组实验,如表所示。
。为研究化学反应速率的影响因素,在恒容条件下,某同学设计了三组实验,如表所示。
(1) 末,
末,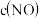 为
为 ,则
,则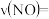
____ 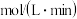 ,
,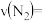
___ 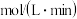 。
。
(2)下列选项中,能说明反应达到平衡的标志是_____ 。
A.单位时间消耗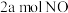 时,同时生成
时,同时生成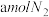
B.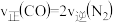
C.容器内压强不再发生改变
D.容器内气体的密度不再发生改变
(3)对比实验编号I和III,能验证_______ 对化学反应速率影响。下图是实验____ 和___ (填实验编号)的对比。
II.知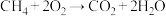 ,为了提高甲烷的能量利用率,可以把
,为了提高甲烷的能量利用率,可以把 设计成燃料电池使用,如图所示,
设计成燃料电池使用,如图所示, 为质子交换膜,只允许
为质子交换膜,只允许 通过,回答下列问题。
通过,回答下列问题。
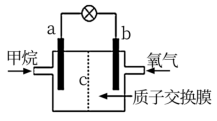
(1)该燃料电池外电路的电流方向由_______ 到_______ (填“a“b)。
(2) 在电池内部电解质溶液中向
在电池内部电解质溶液中向_______ (填“左”或“右”)移动。
(3)a极反应方程式:_______ 。
(4)在标准状况下,若每分钟通过质子交换膜的 为
为 ,消耗甲烷的体积为
,消耗甲烷的体积为_______ L
 和
和 发生反应:
发生反应: 。为研究化学反应速率的影响因素,在恒容条件下,某同学设计了三组实验,如表所示。
。为研究化学反应速率的影响因素,在恒容条件下,某同学设计了三组实验,如表所示。| 实验编号 | t/℃ |  初始浓度 初始浓度 |  初始浓度 初始浓度 | 催化剂的比表面积 |
| I | 280 | 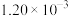 |  | 82 |
| II | 280 | 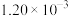 |  | 124 |
| III | 350 | 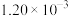 |  | 82 |
 末,
末,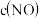 为
为 ,则
,则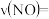
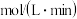 ,
,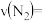
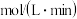 。
。(2)下列选项中,能说明反应达到平衡的标志是
A.单位时间消耗
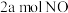 时,同时生成
时,同时生成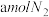
B.
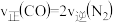
C.容器内压强不再发生改变
D.容器内气体的密度不再发生改变
(3)对比实验编号I和III,能验证

II.知
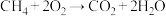 ,为了提高甲烷的能量利用率,可以把
,为了提高甲烷的能量利用率,可以把 设计成燃料电池使用,如图所示,
设计成燃料电池使用,如图所示, 为质子交换膜,只允许
为质子交换膜,只允许 通过,回答下列问题。
通过,回答下列问题。
(1)该燃料电池外电路的电流方向由
(2)
 在电池内部电解质溶液中向
在电池内部电解质溶液中向(3)a极反应方程式:
(4)在标准状况下,若每分钟通过质子交换膜的
 为
为 ,消耗甲烷的体积为
,消耗甲烷的体积为
您最近一年使用:0次



