名校
1 . 国际无机化学命名委员会在1989年做出决定,把长式元素周期表原先的主副族及族号取消,由左至右改为18列。如碱金属元素为第1列,稀有气体元素为第18列。按此规定,下列说法错误的是
| A.第9列元素中没有非金属元素 |
| B.第15列元素原子最外层有5个电子 |
| C.在整个18列元素中,第3列的元素种类最多 |
| D.只有第2列元素原子最外层有2个电子 |
您最近一年使用:0次
2021-12-27更新
|
203次组卷
|
4卷引用:云南省罗平县第二中学2021-2022学年高一3月月考化学(文科)试题
云南省罗平县第二中学2021-2022学年高一3月月考化学(文科)试题2014-2015浙江省杭州市西湖高级中学高一下学期5月月考化学试卷山东省济南外国语学校2017-2018学年高一下学期第一次月考化学试题(已下线)5.1.2 元素周期表(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)
名校
解题方法
2 . 第四周期过渡元素如铁、锰、铜、锌等在太阳能电池、磁性材料等科技方面有广泛的应用,回答下列问题:
(1)Fe 的基态原子共有_______ 种不同能级的电子。
(2)已知高温下CuO→Cu2O+O2从铜原子价层电子结构(3d 和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是________ 。比较铁与锰的第三电离能(I3):铁______ 锰(填“>”“=”或“<”),原因是_________ 。
(3)某含铜化合物的离子结构如图所示。

①该离子中存在的作用力有________ (填序号)。
a.离子键 b.共价键 c.配位键 d.氢键 e. 范德华力
②该离子中N原子的杂化类型有______
(4)图是Mg、Ge、O三种元素形成的某化合物的晶胞示意图。
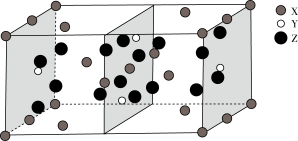
①已知化合物中Ge和O的原子个数比为1:4,图中Z表示_____ 原子(填元素符号),该化合物的化学式为____________ 。
②已知该晶胞的晶胞参数分别为a nm、b nm、 c nm,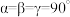 ,则该晶体的密度
,则该晶体的密度 =
=______ g·cm-3(设阿伏加德罗常数的值为NA,用含a、b、c、 N、的代数式表示)。
(1)Fe 的基态原子共有
(2)已知高温下CuO→Cu2O+O2从铜原子价层电子结构(3d 和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是
(3)某含铜化合物的离子结构如图所示。

①该离子中存在的作用力有
a.离子键 b.共价键 c.配位键 d.氢键 e. 范德华力
②该离子中N原子的杂化类型有
(4)图是Mg、Ge、O三种元素形成的某化合物的晶胞示意图。

①已知化合物中Ge和O的原子个数比为1:4,图中Z表示
②已知该晶胞的晶胞参数分别为a nm、b nm、 c nm,
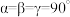 ,则该晶体的密度
,则该晶体的密度 =
=
您最近一年使用:0次
2021-10-20更新
|
427次组卷
|
2卷引用:云南省曲靖市第一中学2022届高三第一次质量监测卷理科综合化学试题
13-14高一·全国·课时练习
名校
3 . A、B两元素原子的核电荷数均小于18,A元素原子的第二层比B元素原子的第二层少3个电子,B原子核外电子总数比A原子核外电子总数多5,则A和B形成化合物的化学式为
| A.A2B3 | B.BA2 | C.AB4 | D.B3A2 |
您最近一年使用:0次
2021-10-16更新
|
158次组卷
|
10卷引用:云南省曲靖市马龙区一中2021-2022学年高一下学期2月考试化学试题
云南省曲靖市马龙区一中2021-2022学年高一下学期2月考试化学试题(已下线)2014年高一化学人教版必修二 1-2-1原子核外电子排布练习卷2014-2015学年湖北省荆州市松滋四中高一下学期6月月考化学试卷吉林省长春市长春外国语学校2015-2016学年高一下第一次月考化学卷河北省承德第一中学2019-2020学年高二上学期开学考试化学试题人教版(2019)高一必修第一册 第四章 物质结构 元素周期律 第一节 原子结构与元素周期表 教材帮江苏省苏州大学附属中学2021-2022学年高一上学期第一阶段检测化学试题(已下线)专题九 元素周期律 化学键(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)(已下线)第1讲 原子结构 核外电子排布江苏省盐城市伍佑中学2022-2023学年高一上学期10月期中考试化学试题
4 . 下列化学用语不正确的是
A.基态铬的价电子排布式: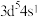 |
B.基态铁原子的简化电子排布式: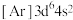 |
C.氧原子核外电子轨道表达式: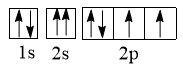 |
D. 电子排布式: 电子排布式: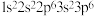 |
您最近一年使用:0次
2021-07-14更新
|
635次组卷
|
3卷引用:云南省曲靖市第一中学2023-2024学年高二下学期3月月考化学试题
云南省曲靖市第一中学2023-2024学年高二下学期3月月考化学试题湖北省孝感市普通高中2020-2021学年高二下学期期末化学试题(已下线)第36讲 原子结构与性质(精讲)-2022年一轮复习讲练测
名校
5 . 下列关于元素的“最”及其因果关系描述正确的是
| A.元素周期表的f区包括镧系、锕系元素,所以周期表中含元素种类最多的区为f区 |
| B.因为F元素的得电子能力最强,所以元素周期表中第一电离能最大的是F |
C.因为元素非金属性F>O,所以最简单氢化物的沸点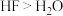 |
D.因为C原子易形成 杂化轨道,可以以四个价键进行不同方式的连接,所以形成化合物种类最多的元素在第ⅣA族 杂化轨道,可以以四个价键进行不同方式的连接,所以形成化合物种类最多的元素在第ⅣA族 |
您最近一年使用:0次
2021-07-13更新
|
142次组卷
|
3卷引用:云南省曲靖市第一中学2023-2024学年高二下学期3月月考化学试题
6 . 以下是同周期三种主族元素R、W、T的电离能数据(单位: ),下列判断错误的是
),下列判断错误的是
 ),下列判断错误的是
),下列判断错误的是| 元素代号 |  |  |  |  |
| R | 496 | 4562 | 6912 | 9543 |
| W | 578 | 1817 | 2745 | 11575 |
| T | 738 | 1451 | 7733 | 10540 |
| A.元素R是ⅠA族元素 |
| B.元素T位于元素周期表s区 |
C.元素W价电子排布式为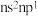 |
D.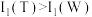 ,故金属性:W>T ,故金属性:W>T |
您最近一年使用:0次
2021-07-09更新
|
249次组卷
|
4卷引用:云南省曲靖市第一中学2023-2024学年高二下学期3月月考化学试题
云南省曲靖市第一中学2023-2024学年高二下学期3月月考化学试题广东省肇庆市2020-2021学年高二下学期末教学质量检测化学(物质结构与性质)试题(已下线)1.2.2 原子结构与元素周期律(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)河南省信阳市浉河区新时代学校2021-2022学年高一下学期期中教学质量检测化学试题
7 . 下列有关图示,能直观形象地展示化学知识。以下图示正确的是
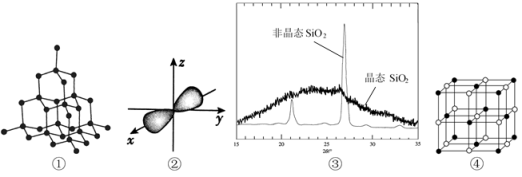
| A.①表示石墨的空间结构 |
| B.②表示2s电子云轮廓图 |
| C.③表示非晶态SiO2、晶态SiO2X-衍射粉末图谱 |
| D.④表示NaCl晶体的晶胞结构图 |
您最近一年使用:0次
2021-07-06更新
|
212次组卷
|
2卷引用:云南省曲靖市第一中学2023-2024学年高二下学期3月月考化学试题
解题方法
8 . Ⅰ.艾姆斯实验室已制造出包含钙、钾、铁和砷以及少量镍的CaK(Fe1-xNix)4As4新型化合物材料。回答下列问题:
(1)基态镍原子的外围电子排布式为_______ 。
(2)在稀氨水介质中,Ni2+与丁二酮肟(分子式为C4H8N2O2)反应可生成鲜红色沉淀,其分子结构如图所示,该结构中碳原子的杂化方式为_______ ;其中碳、氮、氧三种元素第一电离能由大到小的顺序为_______ (用元素符号表示)。

(3)NCl3的立体构型为_______ ,其中心原子的杂化轨道类型为_______ 。
Ⅱ.叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3。HN3的酸性和醋酸相近,可微弱电离出H+和N 。试回答下列问题:
。试回答下列问题:
(1)下列有关说法正确的是_______ (填序号)。
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.肼(N2H4)的沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮酸根能与许多金属离子等形成配合物,如[Co(N3)(NH3)5]SO4,在该配合物中钴显_______ 价;根据价层电子对互斥理论判断SO 的空间构型为
的空间构型为_______ 。
(3)与N 互为等电子体的分子有
互为等电子体的分子有_______ (写两种即可)。
(1)基态镍原子的外围电子排布式为
(2)在稀氨水介质中,Ni2+与丁二酮肟(分子式为C4H8N2O2)反应可生成鲜红色沉淀,其分子结构如图所示,该结构中碳原子的杂化方式为

(3)NCl3的立体构型为
Ⅱ.叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3。HN3的酸性和醋酸相近,可微弱电离出H+和N
 。试回答下列问题:
。试回答下列问题:(1)下列有关说法正确的是
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.肼(N2H4)的沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮酸根能与许多金属离子等形成配合物,如[Co(N3)(NH3)5]SO4,在该配合物中钴显
 的空间构型为
的空间构型为(3)与N
 互为等电子体的分子有
互为等电子体的分子有
您最近一年使用:0次
名校
9 . 青蒿素是一种无色针状晶体,具有较好的抗疟疾效果,其分子结构如图所示。有关青蒿素的说法中错误的是
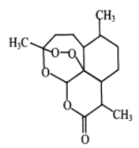

| A.该分子中元素电负性最大的是O元素 |
| B.该分子中碳原子为sp2、sp3杂化 |
| C.一个青蒿素分子中含有7个手性碳原子 |
| D.该有机物的同分异构体中无芳香族化合物 |
您最近一年使用:0次
2021-02-23更新
|
378次组卷
|
5卷引用:云南省曲靖市罗平县第五中学2021-2022学年高二上学期期末考试化学试题
名校
10 . 如图为元素周期表中短周期的一部分,下列说法正确的是


| A.第一电离能:Z>M |
| B.离子半径:M->Z2->Y- |
| C.Y和M元素基态原子的未成对电子数均为1 |
| D.Z元素基态原子的简化电子排布式为[Ar]3s23p4 |
您最近一年使用:0次
2021-01-20更新
|
434次组卷
|
4卷引用:云南省宣威市第三中学2023-2024学年高三上学期收心考化学试题
云南省宣威市第三中学2023-2024学年高三上学期收心考化学试题辽宁省锦州市2020-2021学年高二上学期期末考试化学试题(已下线)1.2 原子结构与元素的性质(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)(已下线)第1.2.2讲 元素周期律-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)



