名校
1 . 铬、钛、钴都属于过渡元素。
(1)铬元素属于周期表的___________ 区,基态Cr原子有___________ 个未成对电子。同周期的基态原子中,与Cr最高能层电子数相同的还有___________ (写元素符号)。
(2)钛元素形成的钛酸钡晶体的晶胞结构如图所示,该晶体经X射线分析得出,重复单元为立方体,顶点位置被Ti4+所占据,体心位置被Ba2+所占据,棱心位置被O2-所占据。___________ 。
②若将Ti4+置于晶胞的体心,Ba2+置于晶胞顶点,则O2-处于立方体的___________ 位置。
③Ti4+的氧配位数和Ba2+的氧配位数分别为___________ 。
(3)钴的某种配合物的化学式为[Co(H2O)6]F2,该配合物的立方晶胞如图所示,其晶胞参数为apm。___________ 个。
②设阿伏加德罗常数的值为NA,则[Co(H2O)6]F2晶体的密度为___________ g·cm-3。
(1)铬元素属于周期表的
(2)钛元素形成的钛酸钡晶体的晶胞结构如图所示,该晶体经X射线分析得出,重复单元为立方体,顶点位置被Ti4+所占据,体心位置被Ba2+所占据,棱心位置被O2-所占据。
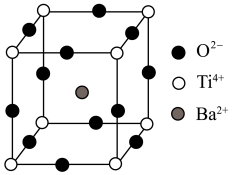
②若将Ti4+置于晶胞的体心,Ba2+置于晶胞顶点,则O2-处于立方体的
③Ti4+的氧配位数和Ba2+的氧配位数分别为
(3)钴的某种配合物的化学式为[Co(H2O)6]F2,该配合物的立方晶胞如图所示,其晶胞参数为apm。
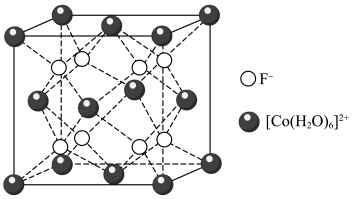
②设阿伏加德罗常数的值为NA,则[Co(H2O)6]F2晶体的密度为
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题:
(1)Fe成为阳离子时首先失去___________ 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为___________ 。
(2)基态S原子电子占据最高能级的电子云轮廓图为___________ 形。
(3)某元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,该原子价层电子的轨道表示式___________ ,该元素名称为___________ 。
(4)已知CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为___________ 。
(5)某有机物的结构简式为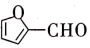 ,该分子内含有___________ (填序号)。
,该分子内含有___________ (填序号)。
(6)已知元素X的气态原子逐个失去第1个至第4个电子所需能量如下表所示:
元素X的常见化合价是___________(填序号)。
(1)Fe成为阳离子时首先失去
(2)基态S原子电子占据最高能级的电子云轮廓图为
(3)某元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,该原子价层电子的轨道表示式
(4)已知CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
(5)某有机物的结构简式为
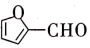 ,该分子内含有___________ (填序号)。
,该分子内含有___________ (填序号)。| A.11个σ键、2个π键 | B.10个σ键、2个π键 |
| C.10个σ键、3个π键 | D.11个σ键、3个π键 |
| I1 | I2 | I3 | I4 | |
| 电离能/(kJ·mol-1) | 578 | 1817 | 2745 | 11578 |
| A.+1 | B.+2 | C.+3 | D.+4 |
您最近一年使用:0次
3 . 下列状态的磷微粒中,失去最外层一个电子所需能量最大的是
| A.[Ne]3s23p3 | B.[Ne]3s23p2 | C.[Ne]3s23p24s1 | D.[Ne]3s23p14s1 |
您最近一年使用:0次
4 . 下列说法正确的是
| A.气态Mn2+再失去一个电子比气态Fe2+再失去一个电子容易 |
| B.离子半径Na+>Mg2+>O2- |
C.基态硫原子的电子排布式若写成 违背了洪特规则 违背了洪特规则 |
| D.两个p轨道之间只能形成π键,不能形成σ键 |
您最近一年使用:0次
5 . 一种工业洗涤剂中间体的结构如图,其中 、
、 、
、 、
、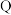 、
、 原子序数依次增大且分属三个短周期。
原子序数依次增大且分属三个短周期。 、
、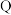 元素的基态原子中均有两个未成对电子,下列说法正确的是
元素的基态原子中均有两个未成对电子,下列说法正确的是
 、
、 、
、 、
、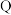 、
、 原子序数依次增大且分属三个短周期。
原子序数依次增大且分属三个短周期。 、
、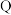 元素的基态原子中均有两个未成对电子,下列说法正确的是
元素的基态原子中均有两个未成对电子,下列说法正确的是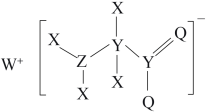
A.电负性大小: |
B.简单离子半径: |
C.简单氢化物的沸点: |
D.阴离子中各原子都满足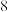 电子稳定结构 电子稳定结构 |
您最近一年使用:0次
2024-04-08更新
|
96次组卷
|
14卷引用:2024届高考化学考点剖析精创专题卷——专题七 物质结构 元素周期律
2024届高考化学考点剖析精创专题卷——专题七 物质结构 元素周期律云南省大理州实验中学2021-2022学年高二下学期化学期中考试题山东省德州市2020-2021学年高二下学期期末考试化学试题福建省三明市五县2021-2022学年高二下学期联合质检考试(期中)化学试题厦门外国语学校2021-2022学年高二下学期期中考试化学试题湖北省黄冈市麻城市第二中学2021-2022学年高二下学期3月月考化学试题 吉林省吉林第一中学2022-2023学年高二上学期11月月考化学试题陕西省武功县普集高级中学2022-2023学年高二下学期第一次月考化学试题广西钦州市第四中学2022-2023学年高二下学期2月考试化学试题福建省龙岩市一级校联盟2022-2023学年高二下学期4月期中考试化学试题福建省三明第一中学2022-2023学年高二下学期期中考试化学试题福建省厦门市湖滨中学2022-2023学年高二下学期期中考试化学试题四川省达州市万源中学2023-2024学年高二下学期4月月考化学试题河南省郑州市十校2023-2024学年高二下学期期中联考化学试卷
解题方法
6 . X、Y、Z、W、R为五种短周期主族元素,原子序数依次增大。X原子半径最小,Y、Z处于同一周期,Y与X形成的简单化合物键角约为107°,基态Z原子有两个未成对电子。W是地壳中含量最高的金属元素,R的最高价氧化物对应的水化物是酸性最强的无机含氧酸。下列说法正确的是
| A.简单离子半径大小:R>W>Y>Z>X |
| B.基态原子第一电离能:Y>Z |
C.实验室可电解熔融 获得W的单质 获得W的单质 |
| D.X、Y、Z形成的化合物既含有离子键又含有共价键 |
您最近一年使用:0次
7 .  为原子序数依次增大的短周期主族元素,W与Z可形成两种常温下呈液态的化合物。Q的基态原子核外电子有29种运动状态,由
为原子序数依次增大的短周期主族元素,W与Z可形成两种常温下呈液态的化合物。Q的基态原子核外电子有29种运动状态,由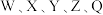 形成的一种化合物结构如图所示。
形成的一种化合物结构如图所示。 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
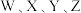 为原子序数依次增大的短周期主族元素,W与Z可形成两种常温下呈液态的化合物。Q的基态原子核外电子有29种运动状态,由
为原子序数依次增大的短周期主族元素,W与Z可形成两种常温下呈液态的化合物。Q的基态原子核外电子有29种运动状态,由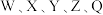 形成的一种化合物结构如图所示。
形成的一种化合物结构如图所示。 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是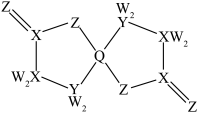
A.第一电离能: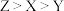 | B.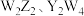 均为非极性分子 均为非极性分子 |
C. 该化合物中含 该化合物中含 键的数目为 键的数目为 | D.Q的基态原子价层电子排布式为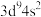 |
您最近一年使用:0次
2024-04-07更新
|
172次组卷
|
2卷引用:云南省昆明市2024届高三“三诊一模”教学质量检测(二模)理综-化学试题
名校
解题方法
8 . X、Y、Z三种元素基态原子的价电子排布式分别为 、
、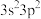 和
和 ,由这三种元素组成的化合物的化学式是
,由这三种元素组成的化合物的化学式是
 、
、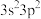 和
和 ,由这三种元素组成的化合物的化学式是
,由这三种元素组成的化合物的化学式是A. | B.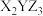 | C.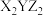 | D. |
您最近一年使用:0次
2024-04-04更新
|
151次组卷
|
10卷引用:云南省玉溪市华宁二中2020-2021学年高二下学期期中考试化学试题
云南省玉溪市华宁二中2020-2021学年高二下学期期中考试化学试题云南省宁蒗彝族自治县第一中学2021-2022学年高二下学期3月考试化学试题2014-2015河南省实验中学高二下学期期中考试化学试卷宁夏银川市唐徕回民中学2017-2018学年高二4月月考化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题吉林省吉林市第五十五中学2018-2019学年高二下学期3月月考化学试题湖南省汨罗市楚雄中学2021-2022学年高二12月月考化学试题四川省广元中学2021-2022学年高二下学期第一次段考化学试题黑龙江省绥化市绥棱县第一中学2023-2024学年高二上学期12月月考化学试题甘肃省武山县第一高级中学2023-2024学年高二下学期第一次月考化学试卷
名校
9 . 下列有关化学用语或图示表达正确的是
A.HCl分子中σ键的形成为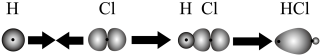 |
B.HClO的电子式为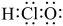 |
C.三氧化硫的VSEPR模型: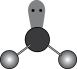 |
D.基态铜原子的价层电子轨道表示式为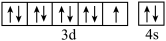 |
您最近一年使用:0次
2024-04-04更新
|
493次组卷
|
6卷引用:云南省曲靖市第一中学2024届高三下学期第八次月考理综试题-高中化学
云南省曲靖市第一中学2024届高三下学期第八次月考理综试题-高中化学北京市第一六一中学2023-2024学年高三下学期一模适应性训练化学试题(已下线)通关练07 原子、分子、晶体结构再归纳-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)化学(北京卷03)-2024年高考押题预测卷(已下线)北京市通州区2024届高三下学期三模化学试题(已下线)湖南省岳阳市湘阴县第一中学2023-2024学年高三下学期5月期中考试化学试题
解题方法
10 . 硒、碲广泛应用于传感、光学器件、红外探测等领域。以下是利用碲碱渣(主要含Na2TeO3、Na2SeO3,还有微量的Cu2+、Pb2+及部分不溶性杂质)为原料分离硒、回收碲的流程图:
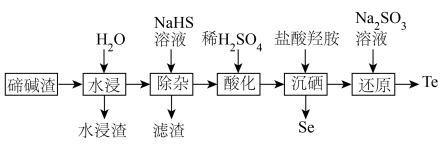
已知:① 时溶度积常数:
时溶度积常数:
②当c(Mn+)≤1.0×10-5mol/L时认为 离子已经沉淀完全
离子已经沉淀完全
③盐酸羟胺(NH2OH·HCl)是一种还原剂,其氧化产物是
回答下列问题:
(1)基态硒原子的价电子排布式为___________ ,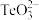 的中心原子的孤电子对数为
的中心原子的孤电子对数为___________ 。
(2)当 完全沉淀时,
完全沉淀时, 的浓度≤
的浓度≤___________ mol/L。
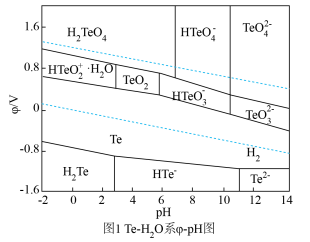
(3)下图是Te—H2O系电位( )—pH图,“酸化”步骤中,当pH为5时,在体系中Te(Ⅳ)主要以
)—pH图,“酸化”步骤中,当pH为5时,在体系中Te(Ⅳ)主要以___________ 形式存在,Te(Ⅳ)可被氧化形成相应的高价Te(Ⅵ)离子,氧化电位随pH值的变化规律为___________ 。
(4)“沉硒”步骤中加入盐酸羟胺,反应的化学方程式为___________ 。
(5)工业上可用电解法制备高纯碲,同时回收工业造纸废液中的NaOH,工作原理如图所示,装置中采用___________ 离子交换膜(填“阳”或“阴”),写出B电极的电极反应式___________ ,若电解8小时,获得1.28吨高纯碲,则电流强度I=___________ C·h-1(已知:一个电子的电荷量e=1.6×10-19C,用含NA的式子表示)。


已知:①
 时溶度积常数:
时溶度积常数:
②当c(Mn+)≤1.0×10-5mol/L时认为
 离子已经沉淀完全
离子已经沉淀完全③盐酸羟胺(NH2OH·HCl)是一种还原剂,其氧化产物是

回答下列问题:
(1)基态硒原子的价电子排布式为
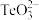 的中心原子的孤电子对数为
的中心原子的孤电子对数为(2)当
 完全沉淀时,
完全沉淀时, 的浓度≤
的浓度≤(3)下图是Te—H2O系电位(
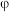 )—pH图,“酸化”步骤中,当pH为5时,在体系中Te(Ⅳ)主要以
)—pH图,“酸化”步骤中,当pH为5时,在体系中Te(Ⅳ)主要以
(4)“沉硒”步骤中加入盐酸羟胺,反应的化学方程式为
(5)工业上可用电解法制备高纯碲,同时回收工业造纸废液中的NaOH,工作原理如图所示,装置中采用

您最近一年使用:0次



