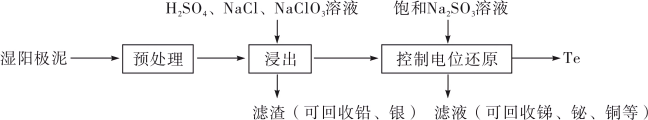
1 . 碲(Te)是一种重要的稀有分散元素,广泛应用于冶金、石油、化工、航空、电子等领域。以某冶炼厂的湿阳极泥(含水26%,主要含锑、砷、铅、铋、银和少量铜、碲等)为原料回收碲的流程如下:
请回答下列问题:
(1)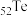 的基态原子的电子排布式为
的基态原子的电子排布式为___________ 。
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是___________ ;氧化后的原料还需粉碎、过筛,目的是___________ 。
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为___________ 、___________ ;添加 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、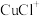 而被浸出的离子方程式
而被浸出的离子方程式___________ 。
(4)电解时为防止除Te以外的单质生成,需控制电位的范围为___________ ;加入饱和 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成___________ (填化学式)。
(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为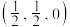 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为___________ 。若Te的原子半径为rpm,碲化锌晶胞中面心与顶点的碲原子相切,晶体的密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
___________  (列出计算式)。
(列出计算式)。
| 物质 | 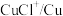 | 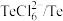 | 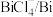 | 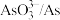 | 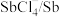 |
| 氧化还原电位(E)/V | 0.342 | 0.568 | 0.16 | 小于0.16 | 小于0.16 |
(1)
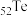 的基态原子的电子排布式为
的基态原子的电子排布式为(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为
 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、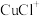 而被浸出的离子方程式
而被浸出的离子方程式(4)电解时为防止除Te以外的单质生成,需控制电位的范围为
 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为
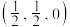 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为 ,则阿伏加德罗常数
,则阿伏加德罗常数
 (列出计算式)。
(列出计算式)。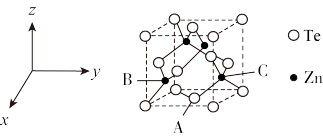
您最近一年使用:0次
2 . 黄铵铁矾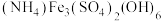 和
和 常用作净水剂。
常用作净水剂。
已知: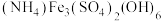 热分解过程发生的反应如下:
热分解过程发生的反应如下:
①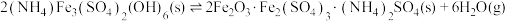
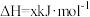
②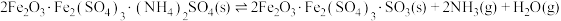
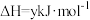
③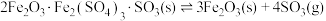
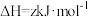
回答下列问题:
(1)基态 的M层电子排布式为
的M层电子排布式为_______ , 中N原子的
中N原子的_______ 轨道与H原子的s轨道重叠形成σ键。
(2) 的
的
_______  。
。
(3)一定温度下,在恒容密闭容器中加入一定量的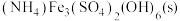 ,只发生反应:
,只发生反应: ,下列可判断该反应达到平衡状态的是_______(填序号)。
,下列可判断该反应达到平衡状态的是_______(填序号)。
(4)500℃时,在体积可变的密闭容器中加入一定量的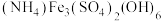 固体,只发生反应:
固体,只发生反应: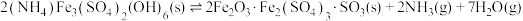 ,达到平衡时测得
,达到平衡时测得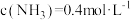 。保持温度不变,将容器体积变为原来的一半,达到新平衡时
。保持温度不变,将容器体积变为原来的一半,达到新平衡时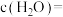
_______  。
。
(5)一定温度下,总压强恒定时,向体积可变的密闭容器中加入一定量的 和
和 氩气,仅发生反应②。测得平衡状态下
氩气,仅发生反应②。测得平衡状态下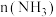 与
与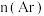 的关系如下图所示。随着通入的
的关系如下图所示。随着通入的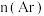 增大,
增大,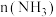 也增大的原因是
也增大的原因是_______ 。 的分解过程会发生下列反应:
的分解过程会发生下列反应:
主反应:

副反应: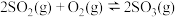
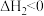
两个反应的平衡常数比值 随反应温度升高而
随反应温度升高而_______ (填“增大”“减小”或“不变”);若平衡时总压为25kPa, 的体积分数为0.4,主反应的平衡常数
的体积分数为0.4,主反应的平衡常数
_______ 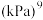 。
。
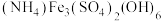 和
和 常用作净水剂。
常用作净水剂。已知:
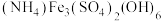 热分解过程发生的反应如下:
热分解过程发生的反应如下:①
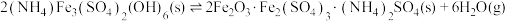
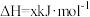
②
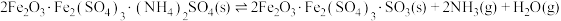
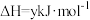
③
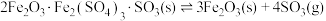
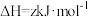
回答下列问题:
(1)基态
 的M层电子排布式为
的M层电子排布式为 中N原子的
中N原子的(2)
 的
的
 。
。(3)一定温度下,在恒容密闭容器中加入一定量的
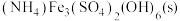 ,只发生反应:
,只发生反应: ,下列可判断该反应达到平衡状态的是_______(填序号)。
,下列可判断该反应达到平衡状态的是_______(填序号)。A. 质量不随时间变化 质量不随时间变化 | B. 体积分数不随时间变化 体积分数不随时间变化 |
| C.混合气体密度不随时间变化 | D.气体平均摩尔质量不随时间变化 |
(4)500℃时,在体积可变的密闭容器中加入一定量的
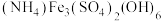 固体,只发生反应:
固体,只发生反应: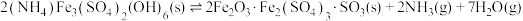 ,达到平衡时测得
,达到平衡时测得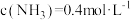 。保持温度不变,将容器体积变为原来的一半,达到新平衡时
。保持温度不变,将容器体积变为原来的一半,达到新平衡时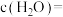
 。
。(5)一定温度下,总压强恒定时,向体积可变的密闭容器中加入一定量的
 和
和 氩气,仅发生反应②。测得平衡状态下
氩气,仅发生反应②。测得平衡状态下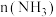 与
与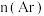 的关系如下图所示。随着通入的
的关系如下图所示。随着通入的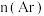 增大,
增大,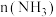 也增大的原因是
也增大的原因是
 的分解过程会发生下列反应:
的分解过程会发生下列反应:主反应:


副反应:
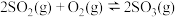
两个反应的平衡常数比值
 随反应温度升高而
随反应温度升高而 的体积分数为0.4,主反应的平衡常数
的体积分数为0.4,主反应的平衡常数
 。
。
您最近一年使用:0次
2024-04-18更新
|
100次组卷
|
2卷引用:2024届”3+3+3“高考备考诊断性联考卷(二)理综试题-高中化学
3 . 实验室以含钴废料(主要成分是CoO、Co2O3,含少量Fe2O3、Al2O3等杂质)为原料制备CoCO3的流程如图所示。
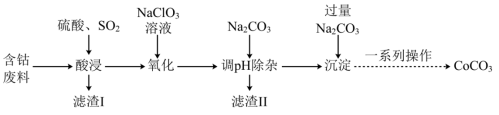
已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
回答下列问题:
(1)基态钴原子的价层电子排布式为_______ ,在“酸浸”之前,先要对含钴废料进行粉碎处理,其目的是_______ 。
(2)“酸浸”时需通入SO2,其中SO2作______ (填“氧化剂”或“还原剂”),由于“酸浸”时,溶液中会产生Fe3+,写出SO2与Fe3+反应的离子方程式:______ 。
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为______ 。
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为______ 至______ 。(加入NaClO3和Na2CO3时,溶液的体积变化忽略)
(5)“滤渣II”的主要成分为______ 。
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有_______ 。
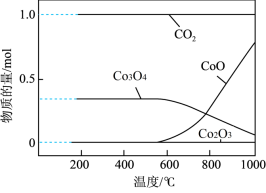
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为_______ 。

已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
| 沉淀 | Al(OH)3 | Fe(OH)3 | Co(OH)2 |
| 恰好完全沉淀时的pH | 5.2 | 2.8 | 9.4 |
(1)基态钴原子的价层电子排布式为
(2)“酸浸”时需通入SO2,其中SO2作
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为
(5)“滤渣II”的主要成分为
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为

您最近一年使用:0次
名校
解题方法
4 . 氮元素是重要的非金属元素,可形成多种铵盐、氮化物、叠氮化物及配合物等。
(1)基态氮原子价电子的轨道表示式(价电子排布图)为___________ ;第二周期元素原子中第一电离能大于氮原子的有___________ 种, 中阴离子的空间构型为
中阴离子的空间构型为___________ 。
(2)C、N、O、S四种元素中,电负性最大的是___________ 。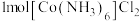 中含有σ键的数目为
中含有σ键的数目为___________ ;已知 比
比 的沸点低得多,试解释原因
的沸点低得多,试解释原因___________ 。
(3)含有多个配位原子的配体与同一中心离子(或原子)通过整合配位成环而形成的配合物为螯合物。一种 配合物的结构如图所示,1mol该螯合物中通过螯合作用形成的配位键有
配合物的结构如图所示,1mol该螯合物中通过螯合作用形成的配位键有___________ mol。 作简单立方堆积,两个立方体共用的面中心存在一个
作简单立方堆积,两个立方体共用的面中心存在一个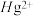 ,
, 位于立方体的体心,相邻的
位于立方体的体心,相邻的 的距离均为apm,阿伏加德罗常数的值为
的距离均为apm,阿伏加德罗常数的值为 ,该物质的化学式为
,该物质的化学式为___________ ,该晶体的密度为___________  。
。 可以与
可以与 、
、 等形成配合物。与
等形成配合物。与 互为等电子体且为非极性分子的化学式为
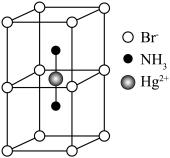
互为等电子体且为非极性分子的化学式为___________ 。在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为___________ ,两种晶体中空间利用率较高的是___________ 。(填“图1”或“图2”)
(1)基态氮原子价电子的轨道表示式(价电子排布图)为
 中阴离子的空间构型为
中阴离子的空间构型为(2)C、N、O、S四种元素中,电负性最大的是
 中含有σ键的数目为
中含有σ键的数目为 比
比 的沸点低得多,试解释原因
的沸点低得多,试解释原因(3)含有多个配位原子的配体与同一中心离子(或原子)通过整合配位成环而形成的配合物为螯合物。一种
 配合物的结构如图所示,1mol该螯合物中通过螯合作用形成的配位键有
配合物的结构如图所示,1mol该螯合物中通过螯合作用形成的配位键有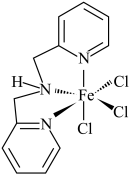
 作简单立方堆积,两个立方体共用的面中心存在一个
作简单立方堆积,两个立方体共用的面中心存在一个 ,
, 位于立方体的体心,相邻的
位于立方体的体心,相邻的 的距离均为apm,阿伏加德罗常数的值为
的距离均为apm,阿伏加德罗常数的值为 ,该物质的化学式为
,该物质的化学式为 。
。
 可以与
可以与 、
、 等形成配合物。与
等形成配合物。与 互为等电子体且为非极性分子的化学式为
互为等电子体且为非极性分子的化学式为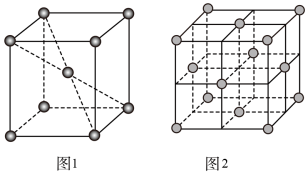
您最近一年使用:0次
5 . 褪黑素是迄今发现的最强的内源性自由基清除剂。褪黑素的基本功能就是参与抗氧化系统,防止细胞产生氧化损伤,在这方面,它的功效超过了已知的所有体内物质。某研究小组以乙炔为原料,设计合成褪黑素,合成路线如下(部分反应条件已省略):

已知:无水乙酸钠在碱石灰作用下发生反应:
回答下列问题:
(1)B→C的反应类型为___________ ,C中含氧官能团的名称为___________ ,C分子是否为手性分子:___________ (填“是”或“否”)。
(2)已知: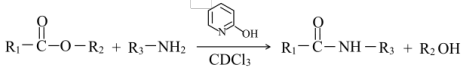 ,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间
,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间电负性差值大小 解释原因___________ 。
(3)E→F过程中,反应i的化学方程式为:___________ 。
(4)J的结构简式为___________ ,其中氮原子的杂化轨道类型为___________ 。
(5)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式___________ 。
i.含有3个六元环,其中1个是苯环;
ii.含有 结构,不含
结构,不含 键;
键;
iii.含有4种不同化学环境的氢原子。
(6)综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①________ ;②_________ ;③___________ 。


已知:无水乙酸钠在碱石灰作用下发生反应:

回答下列问题:
(1)B→C的反应类型为
(2)已知:
 ,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间
,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间| 元素 | H | C | O |
| 电负性 | 2.1 | 2.5 | 3.5 |
(3)E→F过程中,反应i的化学方程式为:
(4)J的结构简式为
(5)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式
i.含有3个六元环,其中1个是苯环;
ii.含有
 结构,不含
结构,不含 键;
键;iii.含有4种不同化学环境的氢原子。
(6)综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①

您最近一年使用:0次
名校
解题方法
6 . 碲具有独特的理化性质,被广泛应用于军工、航天、石油化工、冶金等领域。从碲铜渣[主要成分为 ,含Bi(Ⅲ)、Sb(Ⅲ)、Pb(Ⅱ)、Se等杂质]中分离提纯碲的一种流程如下图所示。
,含Bi(Ⅲ)、Sb(Ⅲ)、Pb(Ⅱ)、Se等杂质]中分离提纯碲的一种流程如下图所示。
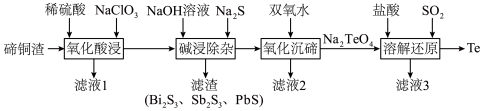
回答下列问题:
(1)“氧化酸浸”时,
 发生反应生成难溶的
发生反应生成难溶的 ,该反应的化学方程式为
,该反应的化学方程式为(2)已知“碱浸除杂”所得浸出液中硒和碲的化合价相同,“氧化沉碲”的目的是利用钠盐的溶解性差异分离硒和碲,推测滤液2中硒的存在形式是
 表面吸附的杂质,将其置于氢氧化钠溶液中进行常温漂洗,漂洗液与滤液2合并,经煮沸后可返回上述流程中的
表面吸附的杂质,将其置于氢氧化钠溶液中进行常温漂洗,漂洗液与滤液2合并,经煮沸后可返回上述流程中的(3)
 在“溶解还原”工序中生成单质Te的总反应的离子方程式为
在“溶解还原”工序中生成单质Te的总反应的离子方程式为(4)滤液1、2、3中,含铜量较高,可用于回收铜的是
(5)碲是第五周期氧族元素,其基态原子的价层电子排布式为
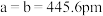 、
、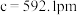 ,
, ,
,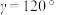 ,碲晶体的密度为
,碲晶体的密度为 (列出计算式即可)。
(列出计算式即可)。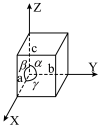
您最近一年使用:0次
名校
解题方法
7 . 铜盐中毒可用青霉胺解毒,解毒原理如下: 能与青霉胺形成环状络合物,其结构如图所示。该环状络合物无毒、易溶于水,可经尿液排出。下列说法错误的是
能与青霉胺形成环状络合物,其结构如图所示。该环状络合物无毒、易溶于水,可经尿液排出。下列说法错误的是
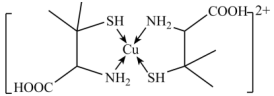
 能与青霉胺形成环状络合物,其结构如图所示。该环状络合物无毒、易溶于水,可经尿液排出。下列说法错误的是
能与青霉胺形成环状络合物,其结构如图所示。该环状络合物无毒、易溶于水,可经尿液排出。下列说法错误的是
A.比较硫化氢与氨气键角的大小: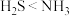 |
| B.第二周期主族元素中,第一电离能大于N的元素有1种 |
| C.该环状络合物易溶于水的主要原因是其与水可形成分子间氢键 |
| D.该环状络合物中,VSEPR模型为四面体或正四面体的非金属原子共有13个 |
您最近一年使用:0次
解题方法
8 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1) 的价电子排布图为:
的价电子排布图为:_________________________ ,基态磷原子的所有电子中有________ 种空间运动状态。
(2)Li、O、P三种元素的电负性由大到小的顺序是:________________________ 。
(3)无水硫酸铜为白色粉末溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有___________ 。
A.配位键 B.金属键 C.离子键 D.共价键
E.氢键 F.范德华力
(4)N和P是同主族元素,但是 分子中的键角大子
分子中的键角大子 分子中的键角,原因是:
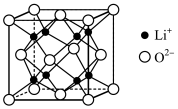
分子中的键角,原因是:___________________________________________ 。 为离子晶体,具有反萤石结构,晶胞如图所示。若晶胞参数为b nm,阿伏加德罗常数的值为
为离子晶体,具有反萤石结构,晶胞如图所示。若晶胞参数为b nm,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为____________  (列出计算式即可),
(列出计算式即可), 和
和 的最短距离等于
的最短距离等于____________ nm(用含b的代数式表示)。
(1)
 的价电子排布图为:
的价电子排布图为:(2)Li、O、P三种元素的电负性由大到小的顺序是:
(3)无水硫酸铜为白色粉末溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有
A.配位键 B.金属键 C.离子键 D.共价键
E.氢键 F.范德华力
(4)N和P是同主族元素,但是
 分子中的键角大子
分子中的键角大子 分子中的键角,原因是:
分子中的键角,原因是: 为离子晶体,具有反萤石结构,晶胞如图所示。若晶胞参数为b nm,阿伏加德罗常数的值为
为离子晶体,具有反萤石结构,晶胞如图所示。若晶胞参数为b nm,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为 (列出计算式即可),
(列出计算式即可), 和
和 的最短距离等于
的最短距离等于
您最近一年使用:0次
解题方法
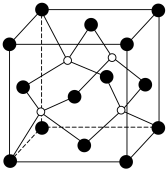
9 . 磷酸锌常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰( 主要含ZnO,还含少量FeO、Al2O3、 CuO 及SiO2)为原料制取磷酸锌的工艺流程如图所示:
已知:①Zn3(PO4)2在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
回答下列问题:
(1)基态锌原子的价电子排布式为_____________ 。
(2)加入H2O2的作用是___________________________ 。
(3)经过滤2得到滤渣的主要成分是Fe( OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是___________ 。
(4)通入H2S的目的是除去Cu2+,写出该反应的离子方程式:_________________ 。
(5)洗涤磷酸锌沉淀时应选用________ (填“冷水”或“热水”),洗涤沉淀的操作是________________ 。
(6)图是碳化硅的晶胞结构,其晶体类型属于___________ 晶体。若碳化硅晶胞边长为a pm,阿伏加德罗常数的值为NA,则碳化硅晶体的密度为______________ g·cm-3 (列出计算式即可)。

已知:①Zn3(PO4)2在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
| 金属离子 | Al3+ | Fe3+ | Cu2+ | Zn2+ |
| 开始沉淀的pH | 3.0 | 2.2 | 5.4. | 6.5 |
| 完全沉淀的pH | 5.0 | 3.6 | 6.7 | 8.5 |
(1)基态锌原子的价电子排布式为
(2)加入H2O2的作用是
(3)经过滤2得到滤渣的主要成分是Fe( OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是
(4)通入H2S的目的是除去Cu2+,写出该反应的离子方程式:
(5)洗涤磷酸锌沉淀时应选用
(6)图是碳化硅的晶胞结构,其晶体类型属于

您最近一年使用:0次
名校
10 .  的配位化合物较稳定且应用广泛。
的配位化合物较稳定且应用广泛。 可与
可与 、
、 、
、 等配体形成使溶液呈浅紫色的
等配体形成使溶液呈浅紫色的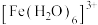 、红色的
、红色的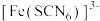 、无色的
、无色的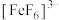 等配离子。某同学按如下步骤进行实验:
等配离子。某同学按如下步骤进行实验:

已知:大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为 。下列说法正确的是
。下列说法正确的是
 的配位化合物较稳定且应用广泛。
的配位化合物较稳定且应用广泛。 可与
可与 、
、 、
、 等配体形成使溶液呈浅紫色的
等配体形成使溶液呈浅紫色的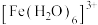 、红色的
、红色的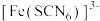 、无色的
、无色的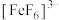 等配离子。某同学按如下步骤进行实验:
等配离子。某同学按如下步骤进行实验:
已知:大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为 。下列说法正确的是
。下列说法正确的是A. 的第一电离能 的第一电离能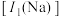 大于 大于 的第一电离能 的第一电离能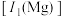 |
B. 与 与 均为直线形结构, 均为直线形结构, 中存在大π键,可表示为 中存在大π键,可表示为 |
C.基态 和基态 和基态 的核外电子排布中,未成对电子数之比 的核外电子排布中,未成对电子数之比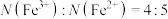 |
D.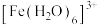 中 中 的键角小于 的键角小于 分子中 分子中 的键角 的键角 |
您最近一年使用:0次
2023-07-10更新
|
360次组卷
|
6卷引用:云南省楚雄彝族自治州2022-2023学年高二下学期期末考试化学试题



