名校
解题方法
1 . 下列说法不正确的是
| A.熔点:金刚石>碳化硅>晶体硅>冰>干冰 |
B.丙氨酸(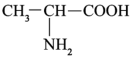 )分子中含有2个手性碳原子 )分子中含有2个手性碳原子 |
| C.等离子体具有良好的导电性,冠醚能识别碱金属离子 |
| D.某元素X气态基态原子的逐级电离能(kJ·mol-1)分别为738、1451、7733、10540、13630,当它与氯气反应时可能生成的阳离子是X2+ |
您最近一年使用:0次
2 . X、Y、Z、W是同周期主族元素,四种元素均是短周期元素,W元素形成的某种单质具有强氧化性,可用于杀菌消毒。四种元素与锂组成的盐是一种新型锂离子电池的电解质,结构如图所示,下列说法正确的是
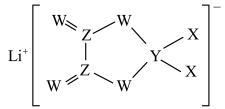

| A.组成这种新型电解质的所有元素均处于元素周期表p区 |
| B.Z元素的含氧酸不可能使酸性高锰酸钾溶液褪色 |
| C.最简单氢化物的沸点: X>W |
| D.同周期中第一电离能比W元素小的有4种元素 |
您最近一年使用:0次
名校
解题方法
3 . 重铬酸钾( )在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为
)在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为 ,还含杂质
,还含杂质 )为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
)为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
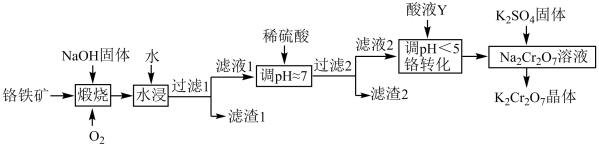
回答下列问题:
(1)基态Cr原子的未成对电子数为_______ 。二氧化硅比二氧化碳熔点高得多的最主要原因是_______ 。
(2)煅烧铬铁矿后生成 和
和 等,已知
等,已知 遇水强烈水解,生成红褐色沉淀,
遇水强烈水解,生成红褐色沉淀, 水解的离子方程式为
水解的离子方程式为_______ ;滤液1中的阴离子主要有 、
、_______ 。
(3)流程中若省去 这一操作,产品中可能含有的杂质是
这一操作,产品中可能含有的杂质是_______ 。
(4)结合离子方程式,从化学平衡移动的角度分析加入酸液Y的作用:_______ 。
(5)由于 是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含
是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含 酸性废水需要进行处理,可用焦亚硫酸钠(
酸性废水需要进行处理,可用焦亚硫酸钠( )将
)将 转化为毒性较低的
转化为毒性较低的 ,室温下再调节溶液的pH,生成
,室温下再调节溶液的pH,生成 沉淀,分离出污泥,保证废水中
沉淀,分离出污泥,保证废水中 的质量浓度小于
的质量浓度小于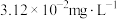 。已知室温下,
。已知室温下,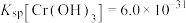 。
。
① 参加反应的离子方程式为
参加反应的离子方程式为_______ 。
②溶液的pH至少要大于_______ 。
 )在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为
)在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为 ,还含杂质
,还含杂质 )为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
)为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
回答下列问题:
(1)基态Cr原子的未成对电子数为
(2)煅烧铬铁矿后生成
 和
和 等,已知
等,已知 遇水强烈水解,生成红褐色沉淀,
遇水强烈水解,生成红褐色沉淀, 水解的离子方程式为
水解的离子方程式为 、
、(3)流程中若省去
 这一操作,产品中可能含有的杂质是
这一操作,产品中可能含有的杂质是(4)结合离子方程式,从化学平衡移动的角度分析加入酸液Y的作用:
(5)由于
 是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含
是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含 酸性废水需要进行处理,可用焦亚硫酸钠(
酸性废水需要进行处理,可用焦亚硫酸钠( )将
)将 转化为毒性较低的
转化为毒性较低的 ,室温下再调节溶液的pH,生成
,室温下再调节溶液的pH,生成 沉淀,分离出污泥,保证废水中
沉淀,分离出污泥,保证废水中 的质量浓度小于
的质量浓度小于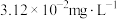 。已知室温下,
。已知室温下,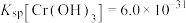 。
。①
 参加反应的离子方程式为
参加反应的离子方程式为②溶液的pH至少要大于
您最近一年使用:0次
2023-02-17更新
|
356次组卷
|
4卷引用:云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题
(已下线)云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题湖南省名校联盟2022-2023学年高三下学期2月联考化学试题湖南省岳阳市第一中学2023届高三下学期第七次月考化学试题
名校
解题方法
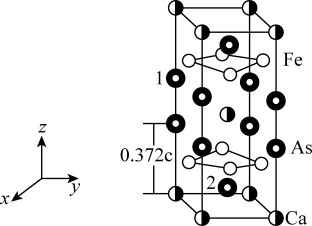
4 . 最近合成的一种铁基超导材料 ,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
(1)Fe的基态原子共有_______ 种不同能级的电子。
(2) 的沸点(1935℃)高于
的沸点(1935℃)高于 的沸点(130.2℃)原因是
的沸点(130.2℃)原因是_______ 。
(3)Fe可以与CO、NO、 等多种微粒形成配合物。
等多种微粒形成配合物。
①C、N、O的第一电离能由大到小的顺序为_______ 。
②写出 的一种等电子体分子
的一种等电子体分子_______ 。
(4) 溶液中含有的微粒内部及微粒间作用力除共价键外还有
溶液中含有的微粒内部及微粒间作用力除共价键外还有_______ ,溶质阴离子的中心原子杂化轨道类型为_______ 。
(5)该材料的化学式为_______ ,已知:体心的Ca原子与顶点的Ca原子有着相同的化学环境(化学环境受周围粒子的数目与距离所影响),该晶胞的晶胞参数为a pm、a pm、c pm,晶胞中As原子1分数坐标为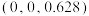 ,则As原子2的分数坐标为
,则As原子2的分数坐标为_______ 。
 ,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
(1)Fe的基态原子共有
(2)
 的沸点(1935℃)高于
的沸点(1935℃)高于 的沸点(130.2℃)原因是
的沸点(130.2℃)原因是(3)Fe可以与CO、NO、
 等多种微粒形成配合物。
等多种微粒形成配合物。①C、N、O的第一电离能由大到小的顺序为
②写出
 的一种等电子体分子
的一种等电子体分子(4)
 溶液中含有的微粒内部及微粒间作用力除共价键外还有
溶液中含有的微粒内部及微粒间作用力除共价键外还有(5)该材料的化学式为
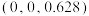 ,则As原子2的分数坐标为
,则As原子2的分数坐标为
您最近一年使用:0次
2022-11-13更新
|
104次组卷
|
2卷引用:福建省宁德市2022-2023学年高三上学期期中区域性学业质量检测化学试题
名校
解题方法
5 . 某锂盐的结构如图所示,其阴离子是由原子序数依次增大的短周期主族元素X、Y,Z、W形成,X,Y与Z同一周期,Y与W同族。下列说法正确的是( )
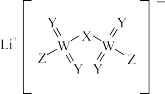
A.元素的电负性: | B.第一电离能: |
C.简单气态氢化物的热稳定性: | D.简单离子的半径: |
您最近一年使用:0次
2022-05-05更新
|
2640次组卷
|
17卷引用:云南省楚雄彝族自治州民族中学2022-2023学年高二下学期5月月考化学试题
云南省楚雄彝族自治州民族中学2022-2023学年高二下学期5月月考化学试题山东省济南市2022届高三第二次模拟化学试题安徽省怀宁中学2021-2022学年高二下学期5月阶段考试化学试题山东省济南第一中学2023届高三上学期开学考试化学试题辽宁省沈阳市第十中学2022-2023学年高二上学期期末综合测评化学试题新疆乌鲁木齐市第八中学2022-2023学年高二上学期期末考试化学试题贵州省江口中学2022-2023学年高二下学期3月份月考化学试题第一章 原子结构与性质(B卷·能力提升练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)(已下线)2023年湖南卷高考真题变式题(选择题6-10)(已下线)选择题1-5湖南省邵阳市武冈市2023-2024学年高三上学期期中考试化学试题河南省驻马店市确山县第一高级中学2023~2024学年高二上学期第二次月考化学试题河北省沧州市泊头市第一中学2023-2024学年高二上学期12月月考化学试题黑龙江省大兴安岭实验中学2023-2024学年高二下学期开学考试化学试卷宁夏石嘴山市第三中学2023-2024学年高二下学期3月月考化学试题山东省临沂市平邑县第一中学西校区2023-2024学年高二上学期1月份阶段性考试化学试题2024届安徽省六安第一中学高三下学期质量检测(三 )化学试题
6 . 南京理工大学化工学院胡炳成教授团队于2017年1月成功合成世界首个全氮阴离子盐(N5)6(H3O)3(NH4)4Cl,时隔不久,他们又成功制得全氮阴离子(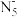 )金属盐Co(N5)2(H2O)4·4H2O,使氦原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
)金属盐Co(N5)2(H2O)4·4H2O,使氦原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
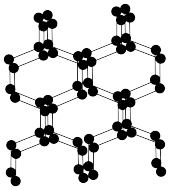
(1)基态氨原子最高能层电子所占用能级的电子云形状为___________ 。与N2互为等电子体的全氧离子化学式为___________ ;具有空间网状结构的高聚氮结构如图所示,则N70的端点小于高聚氮的沸点,原因是___________ ;N70和高聚氮属于___________ (填序号)。
A.同素异形体 B.同分异构体 C.同位素 D.同系物
(2)叠氙化物见研究较早的含全氮阴离子的化合物,如:氢叠氦酸(HN3)、叠氮化钠(NaN3)等。叠氮化物能形成多种配合物,在[Co(N3)(NH3)5]SO4,其中钻的配体是NH3和______ , 的立体构型为
的立体构型为_______ 。
(3)N2H4分子中N原子均采取_______ 杂化;NaN3的晶格能大于KN3的晶格能,原因是________ 。
(4)试就胡炳成教授团队合成的上述两种盐进行有关分析:
①热分析结果显示盐(N5)6(H3O)3(NH4)4Cl分解温度高达116.8吨,具有非常好的热稳定性。这与其结构中含有类似苯分子中的大π键有关。 中的σ键总数为
中的σ键总数为___________ 个。
②试画出金属盐Co(N5)2(H2O)4·4H2O中钴离子的价电子排布图:___________
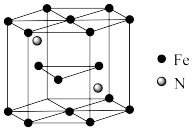
(5)一种氨铁化合物的结构如图所示,若图中六棱柱的体积为Vcm3,用NA表示阿伏加德罗常数的值,则该晶体的密度为___________ g·cm-3。
 )金属盐Co(N5)2(H2O)4·4H2O,使氦原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
)金属盐Co(N5)2(H2O)4·4H2O,使氦原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:(1)基态氨原子最高能层电子所占用能级的电子云形状为

A.同素异形体 B.同分异构体 C.同位素 D.同系物
(2)叠氙化物见研究较早的含全氮阴离子的化合物,如:氢叠氦酸(HN3)、叠氮化钠(NaN3)等。叠氮化物能形成多种配合物,在[Co(N3)(NH3)5]SO4,其中钻的配体是NH3和
 的立体构型为
的立体构型为(3)N2H4分子中N原子均采取
(4)试就胡炳成教授团队合成的上述两种盐进行有关分析:
①热分析结果显示盐(N5)6(H3O)3(NH4)4Cl分解温度高达116.8吨,具有非常好的热稳定性。这与其结构中含有类似苯分子中的大π键有关。
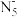 中的σ键总数为
中的σ键总数为②试画出金属盐Co(N5)2(H2O)4·4H2O中钴离子的价电子排布图:
(5)一种氨铁化合物的结构如图所示,若图中六棱柱的体积为Vcm3,用NA表示阿伏加德罗常数的值,则该晶体的密度为

您最近一年使用:0次
名校
解题方法
7 . 北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜。”回答下列问题:
(1)基态Cu原子的电子排布式为_______ ; 量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,基态Cu原子核外电子有_______ 个空间运动状态。
(2)胆矾的化学式为CuSO4·5H2O, 其中SO 的空间构型为
的空间构型为_______
(3)Cu2+能与乙二胺四乙酸根阴离子(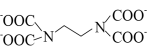 )形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是
)形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是_______ ,第一电离能最大的是______ ;C、N原子的轨道杂化类型分别为_____________ 。
(4)Cu的某种含结晶水的氯化物晶体的晶胞结构如图所示。
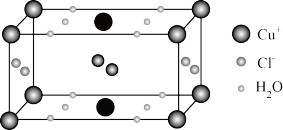
①该晶体的化学式为_____________ 。
②已知晶胞参数为: apm,bpm、 cpm,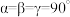 , 设NA为阿伏加德罗常数的值,则该晶体的密度为
, 设NA为阿伏加德罗常数的值,则该晶体的密度为__________ g·cm-3。
(1)基态Cu原子的电子排布式为
(2)胆矾的化学式为CuSO4·5H2O, 其中SO
 的空间构型为
的空间构型为(3)Cu2+能与乙二胺四乙酸根阴离子(
 )形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是
)形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是(4)Cu的某种含结晶水的氯化物晶体的晶胞结构如图所示。

①该晶体的化学式为
②已知晶胞参数为: apm,bpm、 cpm,
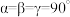 , 设NA为阿伏加德罗常数的值,则该晶体的密度为
, 设NA为阿伏加德罗常数的值,则该晶体的密度为
您最近一年使用:0次
8 . 现有七种元素,其中A,B,C,D,E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)已知BA5为离子化合物,写出其电子式___________ ;
(2)B基态原子中能量最高的电子,其电子云在空间有___________ 个方向,原子轨道呈_________ 形;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为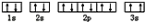 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了___________ ;
(4)G位于____ 族__ 区,价电子排布式为___________ ;
(5)DE3中心原子的杂化方式为___________ ,用价层电子对互斥理论推测其空间构型为___________ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kT/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子排布为
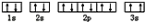 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了(4)G位于
(5)DE3中心原子的杂化方式为
您最近一年使用:0次
9 . 按照下列元素基态原子的电子排布特征回答问题。
A元素的原子中只有一个能层且只含1个电子;B元素的原子3p轨道上得到1个电子后不能再容纳外来电子;C元素的原子2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D元素的原子第三能层上有8个电子,第四能层上只有1个电子;E元素的原子最外层电子排布式为3s23p6;F为金属元素且原子核外p电子数和s电子数相等。
(1)B元素在元素周期表中的位置:___________ 。
(2)上述元素中位于s区的有___________ (填元素符号)。
(3)写出C元素基态原子价电子排布图:___________ 。
(4)检验某溶液中是否含有D+,可通过___________ 反应来实现;检验某溶液中是否含有B-,通常所用的试剂是___________ 和___________ 。
(5)写出E的元素符号:___________ ,要证明太阳上是否含有E元素,可采用的方法是___________ 。
A元素的原子中只有一个能层且只含1个电子;B元素的原子3p轨道上得到1个电子后不能再容纳外来电子;C元素的原子2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D元素的原子第三能层上有8个电子,第四能层上只有1个电子;E元素的原子最外层电子排布式为3s23p6;F为金属元素且原子核外p电子数和s电子数相等。
(1)B元素在元素周期表中的位置:
(2)上述元素中位于s区的有
(3)写出C元素基态原子价电子排布图:
(4)检验某溶液中是否含有D+,可通过
(5)写出E的元素符号:
您最近一年使用:0次
2021-06-02更新
|
733次组卷
|
5卷引用:云南省新平县一中2020-2021学年高二下学期期中考试化学试题
云南省新平县一中2020-2021学年高二下学期期中考试化学试题云南省景东彝族自治县第一中学2021-2022学年高二下学期开学考试化学试题(已下线)第1章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修1)广东省江门市第二中学2021-2022学年高二上学期期中考试化学试题(已下线)BBWYhjhx1112.pdf
10 . 根据科技日报网报道南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现丙烯醇高效、绿色合成。丙烯醇及其化合物可合成甘油、医药、农药、香料等,合成维生素E及天然抗癌药物紫杉醇中都含有关键的丙烯醇结构。丙烯醇的结构简式为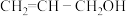 。请回答下列问题:
。请回答下列问题:
(1) 与
与 处于同一周期,且核外最外层电子构型相同,请写出基态钙原子的电子排布式:
处于同一周期,且核外最外层电子构型相同,请写出基态钙原子的电子排布式:_______ ;金属镍能与 形成配合物
形成配合物 ,写出与
,写出与 互为等电子体的一种分子或一种离子的化学式:
互为等电子体的一种分子或一种离子的化学式:_______ 。
(2)
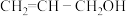 中
中 键和
键和 键的个数比为
键的个数比为_______ ,丙烯醇分子中碳原子的杂化类型为_______ 。
(3)丙醛(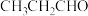 )的沸点为49℃,丙烯醇(
)的沸点为49℃,丙烯醇( )的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是
)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是_______ 。
(4)羧基镍[ ]用于制备高纯度镍粉,它的熔点为
]用于制备高纯度镍粉,它的熔点为 ℃,沸点为43℃。羧基镍的晶体类型是
℃,沸点为43℃。羧基镍的晶体类型是_______ 。
(5) 与
与 处于同一周期,且核外最外层电子构型相同,但金属
处于同一周期,且核外最外层电子构型相同,但金属 的熔点和沸点都比金属
的熔点和沸点都比金属 高,原因为
高,原因为_______ 。区分晶体 和非晶体
和非晶体 的最可靠的科学方法为
的最可靠的科学方法为_______ 。
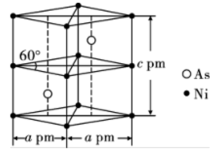
(6)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为 ,该晶体的密度
,该晶体的密度
_______  。
。
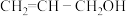 。请回答下列问题:
。请回答下列问题:(1)
 与
与 处于同一周期,且核外最外层电子构型相同,请写出基态钙原子的电子排布式:
处于同一周期,且核外最外层电子构型相同,请写出基态钙原子的电子排布式: 形成配合物
形成配合物 ,写出与
,写出与 互为等电子体的一种分子或一种离子的化学式:
互为等电子体的一种分子或一种离子的化学式:(2)

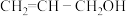 中
中 键和
键和 键的个数比为
键的个数比为(3)丙醛(
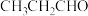 )的沸点为49℃,丙烯醇(
)的沸点为49℃,丙烯醇( )的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是
)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是(4)羧基镍[
 ]用于制备高纯度镍粉,它的熔点为
]用于制备高纯度镍粉,它的熔点为 ℃,沸点为43℃。羧基镍的晶体类型是
℃,沸点为43℃。羧基镍的晶体类型是(5)
 与
与 处于同一周期,且核外最外层电子构型相同,但金属
处于同一周期,且核外最外层电子构型相同,但金属 的熔点和沸点都比金属
的熔点和沸点都比金属 高,原因为
高,原因为 和非晶体
和非晶体 的最可靠的科学方法为
的最可靠的科学方法为(6)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为
 ,该晶体的密度
,该晶体的密度
 。
。
您最近一年使用:0次



