名校
1 . 五氧化二钒(V2O5)广泛用于冶金、化工等行业,一种以富钒炉渣(其中钒以FeO•V2O3、V2O5的形式存在,还有少量的SiO2、Al2O3等)为原料制备V2O5的流程如图所示:
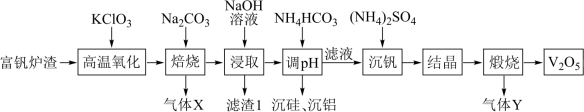
已知:①钒有多种价态,其中+5价最稳定;②V2O5在碱性条件下转化为 。
。
回答下列问题:
(1)基态V原子的价电子轨道表示式为_______ 。
(2)“滤渣1”的主要成分是一种红色固体,它的用途是_______ (写出一种即可)。
(3)“高温氧化”发生反应的化学方程式为_______ 。
(4)“调pH”步骤得到含铝沉淀的离子方程式为_______ 。
(5)“结晶”步骤得到的NH4VO3需进行水洗,证明NH4VO3已洗涤干净的实验操作及现象为_______ 。
(6)实验室“煅烧”使用的硅酸盐质仪器有酒精灯、泥三角和_______ 。
(7)钒的一种配合物的结构简式为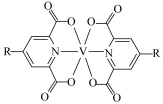 ,1mol该配合物中配体的数目为
,1mol该配合物中配体的数目为_______ (NA为阿伏加德罗常数的值)。

已知:①钒有多种价态,其中+5价最稳定;②V2O5在碱性条件下转化为
 。
。回答下列问题:
(1)基态V原子的价电子轨道表示式为
(2)“滤渣1”的主要成分是一种红色固体,它的用途是
(3)“高温氧化”发生反应的化学方程式为
(4)“调pH”步骤得到含铝沉淀的离子方程式为
(5)“结晶”步骤得到的NH4VO3需进行水洗,证明NH4VO3已洗涤干净的实验操作及现象为
(6)实验室“煅烧”使用的硅酸盐质仪器有酒精灯、泥三角和
(7)钒的一种配合物的结构简式为
 ,1mol该配合物中配体的数目为
,1mol该配合物中配体的数目为
您最近一年使用:0次
名校
2 . 我国科学家在研究点击化学过程中,意外发现一种新化合物,其结构式如图所示,其中X、Y、Z和W是原子序数依次增大的短周期元素,Y与W是同一主族元素。下列说法正确的是


A.第一电离能: |
| B.X的氢化物中只存在极性键 |
| C.电解Z的简单氢化物的水溶液可制得Z单质 |
| D.W的最高价含氧酸根的空间构型为三角锥形 |
您最近一年使用:0次
2024-04-03更新
|
175次组卷
|
2卷引用:2024届云南省曲靖市高三上学期第一次复习检测理综试卷-高中化学
解题方法
3 . 我国科学家在嫦娥五号月壤样品中发现一种新矿物“嫦娥石”,其中含有原子序数依次增大的短周期主族元素X、Y、Z、R。X在地壳中含量最多,Y的电子层数是其最外层电子数的3倍,基态Z原子无未成对电子,基态R原子的p轨道半充满。下列说法错误的是
| A.Y的简单离子半径比Z的简单离子半径大 |
| B.R的简单氢化物的VSEPR模型为三角锥形 |
| C.Z的第一电离能大于同周期相邻元素 |
| D.X、R的简单氢化物的稳定性前者强于后者 |
您最近一年使用:0次
4 . 某种双核钴配合物阳离子的结构如图。X的第一电离能在第二周期主族元素中位居第二,Y的核外电子只有一种运动状态,Z的一种同素异形体是极性分子。下列说法错误的是
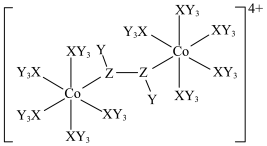
| A.简单氢化物的稳定性:Z>X |
| B.电负性:Z>X>Y |
| C.Co位于元素周期表ds区,在该阳离子中呈+2价 |
| D.从结构推测该配合物阳离子不稳定,且具有一定的氧化性 |
您最近一年使用:0次
2024-04-02更新
|
609次组卷
|
4卷引用:2024届东北三省三校高三下学期第二次联合模拟考试理综重组卷-高中化学
解题方法
5 . 科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种新型超分子,其分子结构如下图所示(Y和Y之间重复单元的W、X未全部标出),W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素,下列说法正确的是


A.简单气态氢化物的沸点: |
B.第一电离能: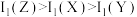 |
C.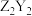 只含有离子键 只含有离子键 |
D.原子半径: |
您最近一年使用:0次
6 . 硒化锌(ZnSe)常用作荧光粉、电子工业掺杂材料和高纯试剂,也是一种重要的半导体材料。其中以锌矿(主要成分是ZnS,含少量 、CuS、NiS、
、CuS、NiS、 等)为原料制备ZnSe的工艺流程如下图所示:
等)为原料制备ZnSe的工艺流程如下图所示:
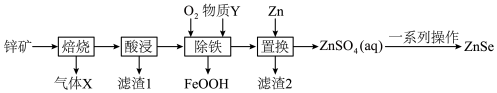
已知:pH较高时,FeOOH沉淀会转化成胶体。
(1)Se元素在周期表中的位置是_______ ,基态Zn原子的价层电子排布式为_______ 。
(2)写出气体X的一种用途_______ 。
(3)浸出液中含有 ,“除铁”步骤中通入氧气时发生反应的离子方程式为
,“除铁”步骤中通入氧气时发生反应的离子方程式为_______ ,同时需补充适量物质Y,Y是_______ (写出一种即可)。“除铁”最佳pH为3.0,如果pH过高,会导致溶液中 的含量降低,其主要原因是
的含量降低,其主要原因是_______ 。
(4)“置换”时滤渣2的主要成分为_______ 。也可以在酸性含 的溶液中加入锌粉和
的溶液中加入锌粉和 ,生成
,生成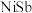 ,其离子方程式为
,其离子方程式为_______ 。
(5) 晶体与NaCl晶体的结构相似,
晶体与NaCl晶体的结构相似, 晶胞为正方体,边长为apm。其结构如图所示:
晶胞为正方体,边长为apm。其结构如图所示:
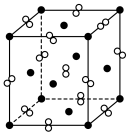
晶胞的密度ρ=_______ g·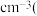 列出计算式,阿伏加德罗常数的值为
列出计算式,阿伏加德罗常数的值为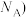 。
。
 、CuS、NiS、
、CuS、NiS、 等)为原料制备ZnSe的工艺流程如下图所示:
等)为原料制备ZnSe的工艺流程如下图所示:
已知:pH较高时,FeOOH沉淀会转化成胶体。
(1)Se元素在周期表中的位置是
(2)写出气体X的一种用途
(3)浸出液中含有
 ,“除铁”步骤中通入氧气时发生反应的离子方程式为
,“除铁”步骤中通入氧气时发生反应的离子方程式为 的含量降低,其主要原因是
的含量降低,其主要原因是(4)“置换”时滤渣2的主要成分为
 的溶液中加入锌粉和
的溶液中加入锌粉和 ,生成
,生成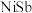 ,其离子方程式为
,其离子方程式为(5)
 晶体与NaCl晶体的结构相似,
晶体与NaCl晶体的结构相似, 晶胞为正方体,边长为apm。其结构如图所示:
晶胞为正方体,边长为apm。其结构如图所示:
晶胞的密度ρ=
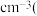 列出计算式,阿伏加德罗常数的值为
列出计算式,阿伏加德罗常数的值为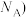 。
。
您最近一年使用:0次
7 . 元素X的价电子排布为(n+1)sn(n+1)pn+2,元素Y位于第四周期的ds区,其基态原子不存在不成对电子。X与Y所形成化合物晶体的晶胞如图所示。下列说法错误的是
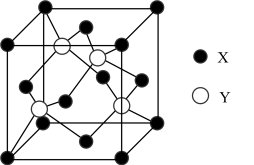

| A.X元素可形成多种同素异形体 | B.晶胞中含有4个X原子 |
| C.X、Y形成的晶体属于原子晶体 | D.X与Y所形成化合物晶体的化学式为YX |
您最近一年使用:0次
2024-03-28更新
|
101次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
8 . 下列叙述正确的是
| A.第三能层某能级的符号为3f |
| B.同一能层中的不同能级的能量高低相同 |
| C.每个能层最多可容纳的电子数是2n2 |
| D.3d能级最多容纳5个电子 |
您最近一年使用:0次
2024-03-28更新
|
107次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高二下学期3月月考化学试题
名校
9 . 按要求完成下列小题。
(1)Cu2+基态核外电子排布式为_______ 。
(2)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①基态Mn原子未成对的电子数为_______ 。
②第三电离能I3(Fe)<I3(Mn),原因是_______ 。
(3)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为_______
②H2O分子的空间结构分别是_______ ,键角H2O_______ NH3。(填>、<或=)
(1)Cu2+基态核外电子排布式为
(2)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①基态Mn原子未成对的电子数为
②第三电离能I3(Fe)<I3(Mn),原因是
(3)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为
②H2O分子的空间结构分别是
您最近一年使用:0次
解题方法
10 . 有A、B、C、D、E五种元素。其相关信息如下:
回答下列问题:
(1)E元素原子基态时的外围电子排布式为_____ 。
(2)C元素的第一电离能比氧元素的第一电离能_____ (填“大”或“小”),原因是_____ 。
(3)C2A4分子中C原子的杂化轨道类型是_____ 。
(4)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有_____ (填序号)。
①配位键②金属键③极性共价键④非极性共价键⑤离子键⑥氢键
[E(CA3)4]2+具有对称的空间构型,若[E(CA3)4]2+中的两个CA3被两个其他基团取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为_____ (填字母)。
a.平面正方形 b.正四面体 c.三角锥形 d.V形
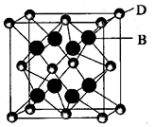
(5)B与D可形成离子化合物,其晶胞结构如图所示。其中D离子的配位数为_____ 。
| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道中有三个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有两个运动状态不同的电子 |
| E | E能与氧形成砖红色E2O和黑色的EO两种氧化物 |
(1)E元素原子基态时的外围电子排布式为
(2)C元素的第一电离能比氧元素的第一电离能
(3)C2A4分子中C原子的杂化轨道类型是
(4)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有
①配位键②金属键③极性共价键④非极性共价键⑤离子键⑥氢键
[E(CA3)4]2+具有对称的空间构型,若[E(CA3)4]2+中的两个CA3被两个其他基团取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示。其中D离子的配位数为

您最近一年使用:0次



