名校
1 . 几种主族元素在周期表中的位置如下:
根据上表回答下列问题:
(1)画出⑩的原子结构示意图:_______ 。
(2)④和⑨两种元素形成的化合物的电子式是_______ 。
(3)②、⑦、⑧三种元素离子半径由大到小的顺序是_______ (用离子符号表示)。
(4)由⑥、⑨组成的化合物分子中,⑥、⑨原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物和一种碱性气体,试写出该反应的化学方程式:_______ 。
(5)对于元素②与④,能说明②的金属性比④强的是_______(填标号)。
(6)由①、③、⑦组成的化合物中含有的化学键有_______ 。
(7)在含有①、④、⑤简单阳离子的 溶液中,逐滴滴加
溶液中,逐滴滴加 的
的 溶液到过量,生成沉淀的质量与加入的
溶液到过量,生成沉淀的质量与加入的 溶液的体积关系如图所示。由图中数据分析计算:
溶液的体积关系如图所示。由图中数据分析计算:
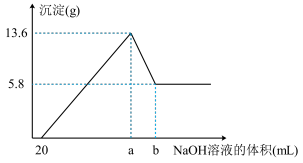
i.沉淀减少时发生的离子方程式:_______ 。
ii.a点的数值为_______  。
。
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ④ | ⑤ | ⑧ | ⑨ | |||
| 4 | ③ | ⑩ | ||||||
(1)画出⑩的原子结构示意图:
(2)④和⑨两种元素形成的化合物的电子式是
(3)②、⑦、⑧三种元素离子半径由大到小的顺序是
(4)由⑥、⑨组成的化合物分子中,⑥、⑨原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物和一种碱性气体,试写出该反应的化学方程式:
(5)对于元素②与④,能说明②的金属性比④强的是_______(填标号)。
A.②与 反应比④与 反应比④与 反应剧烈 反应剧烈 |
| B.②单质的熔、沸点比④的低 |
| C.②的最高价氧化物对应的水化物的碱性比④的最高价氧化物对应的水化物的碱性强 |
| D.与非金属单质反应时,②原子失电子数目比④原子失电子数目少 |
(7)在含有①、④、⑤简单阳离子的
 溶液中,逐滴滴加
溶液中,逐滴滴加 的
的 溶液到过量,生成沉淀的质量与加入的
溶液到过量,生成沉淀的质量与加入的 溶液的体积关系如图所示。由图中数据分析计算:
溶液的体积关系如图所示。由图中数据分析计算:
i.沉淀减少时发生的离子方程式:
ii.a点的数值为
 。
。
您最近一年使用:0次
名校
2 . 三氧化二锑,又称锑白,在工业上作阻燃剂、填充剂等,用途广泛。一种利用辉锑矿粉(含 及少量
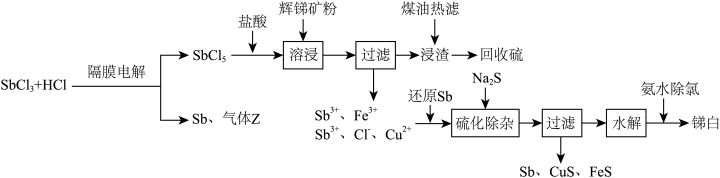
及少量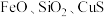 )制取锑白的工艺流程如图:
)制取锑白的工艺流程如图:
已知:①常温下,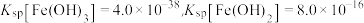 ,
, 。
。
②锑的常见价态为+3、+5价,其中 具有强氧化性,在溶液中能发生较剧烈的水解生成
具有强氧化性,在溶液中能发生较剧烈的水解生成 。
。
(1)锑元素的原子序数为51,位于元素周期表第___________ 周期第___________ 族。
(2)溶浸时发生的主要反应的离子方程式为___________ 。
(3)加入还原Sb还原高价金属离子,能够提高产物锑白的纯度,原因是___________ 。
(4) 水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:
水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:___________ ,锑白洗涤后便可干燥保存,检验洗净的试剂为___________ 。
(5)隔膜电解时,气体Z的分子式为___________ ;为平衡两极电荷,应使用___________ 交换膜(填“阴离子”“阳离子”或“质子”),理由是___________ 。
 及少量
及少量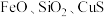 )制取锑白的工艺流程如图:
)制取锑白的工艺流程如图:
已知:①常温下,
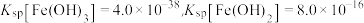 ,
, 。
。②锑的常见价态为+3、+5价,其中
 具有强氧化性,在溶液中能发生较剧烈的水解生成
具有强氧化性,在溶液中能发生较剧烈的水解生成 。
。(1)锑元素的原子序数为51,位于元素周期表第
(2)溶浸时发生的主要反应的离子方程式为
(3)加入还原Sb还原高价金属离子,能够提高产物锑白的纯度,原因是
(4)
 水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:
水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:(5)隔膜电解时,气体Z的分子式为
您最近一年使用:0次
2023-02-03更新
|
423次组卷
|
2卷引用:江苏省扬州中学2022-2023学年高三下学期开学摸底考试化学试题
名校
解题方法
3 . 近年来我国航天事业成果显著,其制造材料中包含了铝、镁、锌、钛、锰、铜、镍、铬、硅、氮、氧等多种元素。回答下列问题:
(1)铬元素属于周期表中_______ 区的元素,其基态原子核外电子空间运动状态有_______ 种,
(2)钛能形成多种配合物,如Ti(CO)6、[Ti(H2O)6]Cl3、[Ti(NH3)6]Cl3等。其配合物的配位数均为_______ ,其中配位原子的电负性由小到大的顺序是_______ (写元素符号),[Ti(NH3)6]Cl3中∠H-N-H_______ (填“大于”、“小于”或“等于”)单个氨气分子中∠H-N-H,原因是_______ 。
(3)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为_______ 。
(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为_______ ,其配位数为_______ 。已知晶胞参数为a pm,设阿伏加德罗常数的值为NA,晶胞密度
_______  。(列出计算式即可)
。(列出计算式即可)

(1)铬元素属于周期表中
(2)钛能形成多种配合物,如Ti(CO)6、[Ti(H2O)6]Cl3、[Ti(NH3)6]Cl3等。其配合物的配位数均为
(3)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为
(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为

 。(列出计算式即可)
。(列出计算式即可) 
您最近一年使用:0次
名校
4 . 下列表格是元素周期表的一部分。请按要求填空(用化学用语填写)
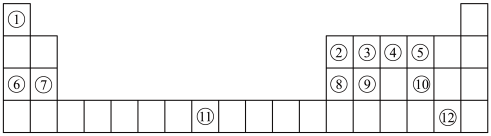
(1)元素①和⑥形成的化合物中存在的化学键类型为_______ 。
(2)用化学方程式表示④的简单氢化物的工业制法_______ 。
(3)写出由③④⑥形成的化合物的电子式_______ 。
(4)列举元素⑨形成的氧化物的一种用途_______ ,元素⑪在周期表中的位置_______ 。
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为_______ 。
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为_______ 。
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为_______ 。

(1)元素①和⑥形成的化合物中存在的化学键类型为
(2)用化学方程式表示④的简单氢化物的工业制法
(3)写出由③④⑥形成的化合物的电子式
(4)列举元素⑨形成的氧化物的一种用途
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol
 ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为
您最近一年使用:0次
2022-11-28更新
|
340次组卷
|
2卷引用:天津市南开中学2022-2023学年高三上学期第二次月考化学试题
5 . 某学习小组探究B及其化合物的性质。
(1)元素周期表中虚线相连的元素的性质具有一定的相似性,即对角线法则。
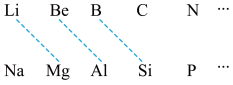
B在元素周期表中的位置是_______ 。其最高价氧化物的化学式为_______ ,与氢氧化钠溶液反应的化学方程式为_______ 。
(2)某科研团队研究发现硼氢化钠( )在催化剂表面与水反应可生成
)在催化剂表面与水反应可生成 。
。
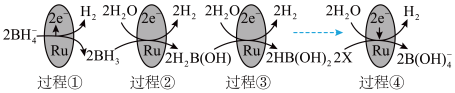
①上图中X的化学式为_______ 。
② 以二聚物的形式存在,分子结构中存在两个
以二聚物的形式存在,分子结构中存在两个 键共用一对共用电子的氢桥键,用
键共用一对共用电子的氢桥键,用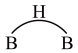 表示,则二聚物结构式为
表示,则二聚物结构式为_______ 。
③图中反应的总化学方程式为_______ 。
④_______ g 的还原能力与标准状况下22.4L
的还原能力与标准状况下22.4L 的还原能力相当(还原能力即生成
的还原能力相当(还原能力即生成 失去电子的量)。
失去电子的量)。
(1)元素周期表中虚线相连的元素的性质具有一定的相似性,即对角线法则。

B在元素周期表中的位置是
(2)某科研团队研究发现硼氢化钠(
 )在催化剂表面与水反应可生成
)在催化剂表面与水反应可生成 。
。
①上图中X的化学式为
②
 以二聚物的形式存在,分子结构中存在两个
以二聚物的形式存在,分子结构中存在两个 键共用一对共用电子的氢桥键,用
键共用一对共用电子的氢桥键,用 表示,则二聚物结构式为
表示,则二聚物结构式为③图中反应的总化学方程式为
④
 的还原能力与标准状况下22.4L
的还原能力与标准状况下22.4L 的还原能力相当(还原能力即生成
的还原能力相当(还原能力即生成 失去电子的量)。
失去电子的量)。
您最近一年使用:0次
名校
解题方法
6 . 某固态结晶水合物 X 由 5 种元素组成。某学习小组进行了如下实验:
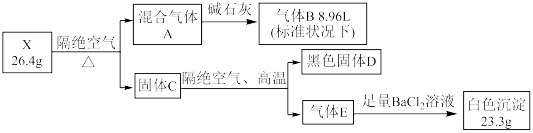
已知气体B能与 AgNO3 溶液反应, D中两种元素质量比为4:1 ,请回答:
(1)上述五种元素中,写出原子序数最大的元素在周期表中的位置___________
(2)气体 B 的实验方法是___________
(3)写出 X 在隔绝空气条件下加热,生成 A 、D 、E 的化学方程式:___________
(4)已知气体B和固体D加热时会发生反应,产物中有两种单质,当参加反应的 D 质量是1.2g时,所生成的两种单质的质量差为___________ g

已知气体B能与 AgNO3 溶液反应, D中两种元素质量比为4:1 ,请回答:
(1)上述五种元素中,写出原子序数最大的元素在周期表中的位置
(2)气体 B 的实验方法是
(3)写出 X 在隔绝空气条件下加热,生成 A 、D 、E 的化学方程式:
(4)已知气体B和固体D加热时会发生反应,产物中有两种单质,当参加反应的 D 质量是1.2g时,所生成的两种单质的质量差为
您最近一年使用:0次
解题方法
7 . NiO晶体与NaCl具有相同晶胞结构。在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如图所示),可以认为 作密置单层排列,
作密置单层排列, 填充其中。设
填充其中。设 为阿伏加德罗常数的值,
为阿伏加德罗常数的值, 半径为r pm。下列说法错误的是
半径为r pm。下列说法错误的是
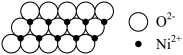
 作密置单层排列,
作密置单层排列, 填充其中。设
填充其中。设 为阿伏加德罗常数的值,
为阿伏加德罗常数的值, 半径为r pm。下列说法错误的是
半径为r pm。下列说法错误的是
| A.Ni位于元素周期表第4周期第Ⅷ族 |
B.NiO晶体中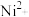 、 、 的配位数均为6 的配位数均为6 |
| C.NiO晶胞中八面体空隙与四面体空隙比为1:2 |
D.该“单分子层”面积密度为 |
您最近一年使用:0次
2022-07-25更新
|
1005次组卷
|
3卷引用:山东省青岛市黄岛区2021-2022学年高二下学期期末考试化学试题
8 . 据Nature Energy报道,最近科研人员研制出一种低浓度锂盐水系电解质溶液,充放电过程中锂离子具有较高的扩散速率,使得锂离子电池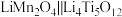 表现出优异的稳定性和放电容量。
表现出优异的稳定性和放电容量。
(1)对电极材料组成元素的分析。
①O原子核外电子有___________ 种运动状态。
②Mn元素位于元素周期表的___________ 区。
③基态Ti原子的核外电子排布式为___________ 。
(2)将 和
和 按
按 的物质的量比配料,经研磨后升温至600~750℃可制得电极材料
的物质的量比配料,经研磨后升温至600~750℃可制得电极材料 。
。
①该反应的化学方程式为___________ 。
② 中锰元素的平均价态为+3.5。不同温度下,合成的
中锰元素的平均价态为+3.5。不同温度下,合成的 中
中 、
、 和
和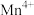 的含量与温度的关系见下表。
的含量与温度的关系见下表。
在上述温度范围内,锰元素平均价态的变化趋势为___________ 。
(3)以某种Ti的氧化物为原料,可制备正极材料尖晶石型钛酸锂( )。
)。
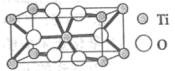
①Ti的氧化物晶胞结构如图所示,其化学式为___________ 。
②电池放电过程中,钛酸锂(难溶于水)由尖晶石型转变为岩盐型(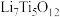 ),则正极的电极反应式为
),则正极的电极反应式为___________ 。
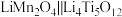 表现出优异的稳定性和放电容量。
表现出优异的稳定性和放电容量。(1)对电极材料组成元素的分析。
①O原子核外电子有
②Mn元素位于元素周期表的
③基态Ti原子的核外电子排布式为
(2)将
 和
和 按
按 的物质的量比配料,经研磨后升温至600~750℃可制得电极材料
的物质的量比配料,经研磨后升温至600~750℃可制得电极材料 。
。①该反应的化学方程式为
②
 中锰元素的平均价态为+3.5。不同温度下,合成的
中锰元素的平均价态为+3.5。不同温度下,合成的 中
中 、
、 和
和 的含量与温度的关系见下表。
的含量与温度的关系见下表。| T/℃ |  | 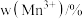 | 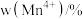 |
| 700 | 5.56 | 44.58 | 49.86 |
| 750 | 2.56 | 44.87 | 52.57 |
| 800 | 5.50 | 44.17 | 50.33 |
| 850 | 6.22 | 44.40 | 49.38 |
(3)以某种Ti的氧化物为原料,可制备正极材料尖晶石型钛酸锂(
 )。
)。①Ti的氧化物晶胞结构如图所示,其化学式为

②电池放电过程中,钛酸锂(难溶于水)由尖晶石型转变为岩盐型(
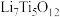 ),则正极的电极反应式为
),则正极的电极反应式为
您最近一年使用:0次
2022-06-29更新
|
233次组卷
|
2卷引用:江苏省常州市教育学会2021-2022学年高二下学期期末学业水平监测化学试题
解题方法
9 . 氯化亚锡和锡酸钠都可在印染行业用作媒染剂。校化学小组从电镀锡渣(主要成分为Sn、SnO,含有砷和难溶于酸碱的杂质)中制取二水合氯化亚锡和锡酸钠,工艺流程如图所示:
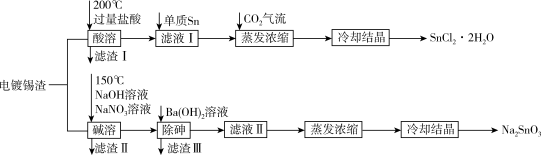
已知:
①Sn(II)具有还原性,可与Cl-形成[SnCl3]-
②As在碱溶时转化为Na3AsO4溶液
③20℃时,Ksp[Ba3(AsO4)2]=2.7×10-10
回答下列问题:
(1)Sn元素在周期表中的位置为_______ 。
(2)SnCl2溶液可用作电镀锡的电解液,阴极的电极反应式为_______ 。
(3)“酸溶”时SnO发生反应的离子方程式为_______ 。
(4)“碱溶”时的还原产物是空气的主要成分之一,写出Sn发生反应的化学方程式_______ 。
(5)“滤液I”中,需加入少量单质Sn,原因是_______ 。
(6)“除砷”时,若溶液中c(AsO )=2mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×10-3mol/L,则沉淀中的As元素占原As元素总量的
)=2mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×10-3mol/L,则沉淀中的As元素占原As元素总量的_______ 。
(7)蒸发浓缩“滤液II”前,可往体系中加入适量的NaOH溶液,目的是________ 。

已知:
①Sn(II)具有还原性,可与Cl-形成[SnCl3]-
②As在碱溶时转化为Na3AsO4溶液
③20℃时,Ksp[Ba3(AsO4)2]=2.7×10-10
回答下列问题:
(1)Sn元素在周期表中的位置为
(2)SnCl2溶液可用作电镀锡的电解液,阴极的电极反应式为
(3)“酸溶”时SnO发生反应的离子方程式为
(4)“碱溶”时的还原产物是空气的主要成分之一,写出Sn发生反应的化学方程式
(5)“滤液I”中,需加入少量单质Sn,原因是
(6)“除砷”时,若溶液中c(AsO
 )=2mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×10-3mol/L,则沉淀中的As元素占原As元素总量的
)=2mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×10-3mol/L,则沉淀中的As元素占原As元素总量的(7)蒸发浓缩“滤液II”前,可往体系中加入适量的NaOH溶液,目的是
您最近一年使用:0次
10 . 废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为Culn0.5Ga0.5Se2。某探究小组回收处理流程如图:
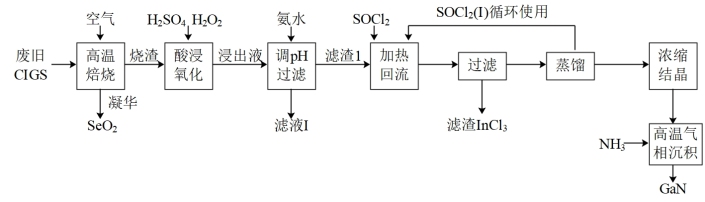
已知:①镓(Ga)和铟(In)位于元素周期表ⅢA族,镓与铝元素相邻。
②硒(Se)位于元素周期表ⅥA族。
回答下列问题:
(1)镓(Ga)原子结构示意图为____ 。
(2)“酸浸氧化”时发生的主要氧化还原反应的离子方程式为____ 。
(3)滤液Ⅰ中所含金属元素名称为_____ 。
(4)“滤渣Ⅰ”与SOCl2混合前需要洗涤、干燥,检验滤渣Ⅰ中SO 是否洗净的操作:
是否洗净的操作:____ ;SOCl2与一定量的水反应能产生两种气体,其中一种气体能使品红溶液褪色,写出SOCl2水解的化学方程式____ ;“加热回流”中SOCl2的作用:一种是将氢氧化物转化为氯化物,另一种是____ 。
(5)浓缩结晶后所得的GaCl3在“高温气相沉积”过程中发生的化学反应方程式为____ 。
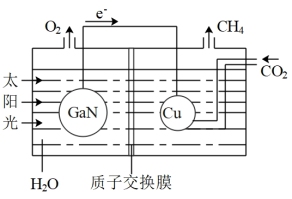
(6)如图表示氮化镓与铜组装成的人工光合系统的电池工作原理。电池工作时H+向_____ (填“左”或“右”)池移动;当电路中转移1.6mol电子时,电池中液体质量_____ (填“增重”还是“减轻”)_____ g。

已知:①镓(Ga)和铟(In)位于元素周期表ⅢA族,镓与铝元素相邻。
②硒(Se)位于元素周期表ⅥA族。
回答下列问题:
(1)镓(Ga)原子结构示意图为
(2)“酸浸氧化”时发生的主要氧化还原反应的离子方程式为
(3)滤液Ⅰ中所含金属元素名称为
(4)“滤渣Ⅰ”与SOCl2混合前需要洗涤、干燥,检验滤渣Ⅰ中SO
 是否洗净的操作:
是否洗净的操作:(5)浓缩结晶后所得的GaCl3在“高温气相沉积”过程中发生的化学反应方程式为
(6)如图表示氮化镓与铜组装成的人工光合系统的电池工作原理。电池工作时H+向

您最近一年使用:0次



