18-19高一下·江西南昌·期中
解题方法
1 . 下图是周期表的一部分,回答下列问题:
(1)A的原子结构示意图是_________________ ;
(2)E在周期表的位置为_________________________ ;与E同族的下一周期元素的原子序数为___________ ;
(3)表中元素形成气态氢化物最稳定的是___________ (填化学式,下同),最高价氧化物对应水化物酸性最强的是________________ ;
(4)下列不能用来对比C和D金属性强弱的是_________
a.C单质的熔点比D低
b.C的阳离子的氧化性弱于D的阳离子的氧化性
c.C单质与水反应比D单质与水反应剧烈
d.C最高价氧化物对应水化物的碱性比D强
(5)元素A与H分别与H形成的18电子分子Q和W(常用作火箭燃料)可以发生氧化还原反应,生成H单质和A的另一种氢化物。请写出该反应的方程式:______________________ 。
| H | A | B | ||||||
| C | D | E | F | G | ||||
(2)E在周期表的位置为
(3)表中元素形成气态氢化物最稳定的是
(4)下列不能用来对比C和D金属性强弱的是
a.C单质的熔点比D低
b.C的阳离子的氧化性弱于D的阳离子的氧化性
c.C单质与水反应比D单质与水反应剧烈
d.C最高价氧化物对应水化物的碱性比D强
(5)元素A与H分别与H形成的18电子分子Q和W(常用作火箭燃料)可以发生氧化还原反应,生成H单质和A的另一种氢化物。请写出该反应的方程式:
您最近一年使用:0次
18-19高一下·江西南昌·期中
解题方法
2 . 某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表一种元素,其中O点代表氢元素。下列说法中正确的是


| A.虚线相连的元素处于同一主族 |
| B.形成气态氢化物的稳定性:C>D |
| C.化合物BDA中既含离子键又含共价键且属于离子化合物 |
| D.C的氧化物能与B或D的最高价氧化物的水化物反应 |
您最近一年使用:0次
解题方法
3 . 如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
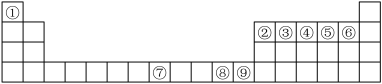
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,⑨元素位于周期表的________ 区。
(2)④、⑥两元素形成的化合物的立体构型为________ ,其中心原子的杂化轨道类型为________ 。
(3)元素⑧的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为________ 。
(4)在周期表给出的9种元素中,电负性最大的元素基态原子的电子排布式为___________ 。
(5)在①与④形成的相对分子质量最小的化合物A中,元素④的杂化类型是____ ,写出与化合物A互为等电子体的一种阳离子______ (填离子符号)。
(6)关于元素①与元素⑤形成的1︰1的化合物,下列说法正确的是______ (填字母序号)。
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1︰1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(7)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________ 晶体(填晶体类型),化合物中⑦的化合价为:_______ 。根据等电子体理论,该化合物的配体的结构式为:_______ ,CaC2中,阴离子的电子式为: ____________________ 。

(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,⑨元素位于周期表的
(2)④、⑥两元素形成的化合物的立体构型为
(3)元素⑧的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为
(4)在周期表给出的9种元素中,电负性最大的元素基态原子的电子排布式为
(5)在①与④形成的相对分子质量最小的化合物A中,元素④的杂化类型是
(6)关于元素①与元素⑤形成的1︰1的化合物,下列说法正确的是
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1︰1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(7)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于
您最近一年使用:0次
名校
解题方法
4 . 第二主族元素R的单质及其相应氧化物的混合物12g,加足量水经完全反应后蒸干,得固体16g,试推测该元素可能为
| A.Mg | B.Ca | C.Be | D.Ba |
您最近一年使用:0次
2020-03-06更新
|
242次组卷
|
2卷引用:四川省南充市阆中中学2020届高三化学选择题专项训练(15)
19-20高二·浙江·期末
解题方法
5 . 某同学设计如下元素周期表,以下说法正确的是( )
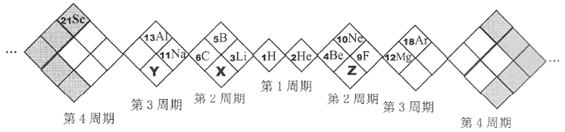

| A.白格中都是主族元素,灰格中都是副族元素 |
| B.原子半径:Z>X>Y |
| C.Z的最高价含氧酸是强酸 |
| D.X、Y、Z的气态氢化物中最稳定的是Z的氢化物 |
您最近一年使用:0次
6 . 如图是部分短周期元素化合价与原子序数的关系图
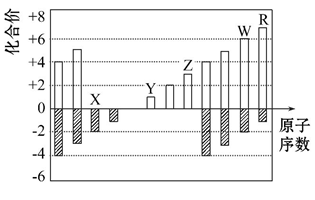
请回答下列问题(用元素符号表达):
(1) X、Y、Z 三种元素的原子半径大小顺序是____________
(2)X 与 Y 形成化合物Y2X2,写出该化合物的电子式____________
(3)RX2是一种强氧化性气体,可用于污水处理,能将 CN-氧化,生成两种无毒气体,该反应离子方程式为____________
(4)某阴离子 Wa2-(a 为2 − 6之间的数字)在碱性溶液中被 BrO3‾离子氧化为 WO42-,而BrO3-离子被还原为Br-,反应中消耗的 BrO3-离子和 OH ‾离子的物质的量之比为 2:3,则 a =____________ 。

请回答下列问题(用元素符号表达):
(1) X、Y、Z 三种元素的原子半径大小顺序是
(2)X 与 Y 形成化合物Y2X2,写出该化合物的电子式
(3)RX2是一种强氧化性气体,可用于污水处理,能将 CN-氧化,生成两种无毒气体,该反应离子方程式为
(4)某阴离子 Wa2-(a 为2 − 6之间的数字)在碱性溶液中被 BrO3‾离子氧化为 WO42-,而BrO3-离子被还原为Br-,反应中消耗的 BrO3-离子和 OH ‾离子的物质的量之比为 2:3,则 a =
您最近一年使用:0次
7 . 碳及其化合物在生产、生活中有广泛的用途。
I.金刚砂SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与同周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子,则Q元素在周期表中的位置为____________ ,R的电子式为______________ ;
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收CCl4的实验操作名称为_____________ ,除去粗产品中少量钠的试剂为______________ ;
(3)碳还原制取SiC,其粗产品中杂质为Si和SiO2。先将20.0g SiC粗产品加入到过量NaOH溶液中充分反应,收集到0.1 mol氢气,过滤SiC固体11.4g,滤液稀释到1L。Si与NaOH溶液反应的离子方程式为____________________ ,硅酸盐的物质的量浓度为____________ 。
II.工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如图所示。已知CaSO4的KSP=9.1×10-4,CaCO3的KSP=2.8×10-4。请回答:
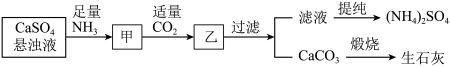
(1)向甲中通入过量CO2__________ (填“有”或“不”)利于CaCO3和(NH4)2SO4的生成,原因是_________________ 。
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是____________ (填含量最多的一种)。
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为___________________________ ;
②请分析CaSO4转化为CaCO3的原理:___________________________ 。
I.金刚砂SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与同周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子,则Q元素在周期表中的位置为
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收CCl4的实验操作名称为
(3)碳还原制取SiC,其粗产品中杂质为Si和SiO2。先将20.0g SiC粗产品加入到过量NaOH溶液中充分反应,收集到0.1 mol氢气,过滤SiC固体11.4g,滤液稀释到1L。Si与NaOH溶液反应的离子方程式为
II.工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如图所示。已知CaSO4的KSP=9.1×10-4,CaCO3的KSP=2.8×10-4。请回答:

(1)向甲中通入过量CO2
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为
②请分析CaSO4转化为CaCO3的原理:
您最近一年使用:0次
名校
解题方法
8 . 有X、Y、Z、W四种短周期主族元素,它们在周期表中的位置如图所示,已知Y是地壳中含量最高的金属元素,则下列说法中正确的是( )
| X | |||
| Y | Z | W |
| A.简单离子半径:Y>W |
| B.Y的最高价氧化物的水化物和X的最高价氧化物的水化物可反应 |
| C.X的简单氢化物比Z的简单氢化物更稳定、沸点更高 |
| D.非金属性:W>X |
您最近一年使用:0次
2019-12-31更新
|
559次组卷
|
3卷引用:华南师范大学附中2020届高三上学期第三次月考理综化学试题
18-19高三·浙江·期中
9 . 下图是元素周期表的一部分。
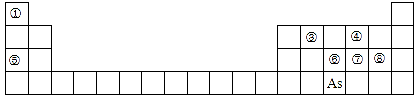
Ⅰ.(1)④、⑤、⑧的离子半径由大到小的顺序为_________ (用离子符号表示)。
(2)③、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_______ 。(用化学式表示)
(3) 由④⑤⑧三种元素组成,它的水溶液是生活中常见的消毒剂,
由④⑤⑧三种元素组成,它的水溶液是生活中常见的消毒剂, 可与
可与 的水溶液反应,产物有
的水溶液反应,产物有 的最高价含氧酸,该反应的化学方程式为
的最高价含氧酸,该反应的化学方程式为_______________ 。
Ⅱ.以下框图中的物质均为中学中常见的化合物或单质(部分产物略去),已知化合物 为由以上①④两种元素组成的人类生命活动不可缺少的常见液态物质,试回答
为由以上①④两种元素组成的人类生命活动不可缺少的常见液态物质,试回答
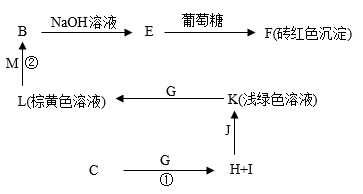
(1)化合物 的电子式为
的电子式为______________ , 的化学式为
的化学式为____________ 。
(2)写出反应①和反应②的离子方程式
①________________________________________ 。
②________________________________________ 。

Ⅰ.(1)④、⑤、⑧的离子半径由大到小的顺序为
(2)③、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是
(3)
 由④⑤⑧三种元素组成,它的水溶液是生活中常见的消毒剂,
由④⑤⑧三种元素组成,它的水溶液是生活中常见的消毒剂, 可与
可与 的水溶液反应,产物有
的水溶液反应,产物有 的最高价含氧酸,该反应的化学方程式为
的最高价含氧酸,该反应的化学方程式为Ⅱ.以下框图中的物质均为中学中常见的化合物或单质(部分产物略去),已知化合物
 为由以上①④两种元素组成的人类生命活动不可缺少的常见液态物质,试回答
为由以上①④两种元素组成的人类生命活动不可缺少的常见液态物质,试回答
(1)化合物
 的电子式为
的电子式为 的化学式为
的化学式为(2)写出反应①和反应②的离子方程式
①
②
您最近一年使用:0次
名校
10 . 根据 A-I 在周期表中的位置,用元素符号或化学式回答下列问题。
(1)表中元素,化学性质最不活泼的是_____ ,只有负价而无正价的是_____ ,氧化性最强的单质是____ ;
(2)最高价氧化物的水化物碱性最强的是_____ ,酸性最强的是_____ ,呈两性的是_____ ;
(3)A 分别与 D、E、F、G、H 形成的化合物中,最稳定的是_____ ;
(4)在 B、C、D、E、F、G、H 中,原子半径最大的是_____ ;
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外 M 电子层与 K 电子层上的电子数相等,甲、乙两元素相比较,金属性较强的是_______ 可以验证该结论的实验是_ 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是
(2)最高价氧化物的水化物碱性最强的是
(3)A 分别与 D、E、F、G、H 形成的化合物中,最稳定的是
(4)在 B、C、D、E、F、G、H 中,原子半径最大的是
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外 M 电子层与 K 电子层上的电子数相等,甲、乙两元素相比较,金属性较强的是
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
您最近一年使用:0次
2019-10-25更新
|
118次组卷
|
2卷引用:上海外国语大学附属外国语学校2017-2018学年高二12月月考化学试题



