名校
1 . 如表所示为元素周期表的前四周期部分,根据图示结合所学知识回答下列问题:
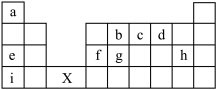
(1)h、i的简单离子半径由大到小的顺序为_______ (填离子符号)。
(2)i、e、f的最高价氧化物对应的水化物的碱性由强到弱的顺序是_______ (填化学式)。
(3)用电子式表示e和h形成离子化合物的过程:________ 。
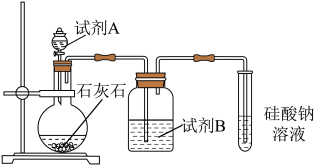
(4)非金属性:b_______ g(填“>”或“<”);以如图装置进行实验比较b、g对应的最高价氧化物对应水化物的酸性,则试剂A为_______ (填试剂名称),试剂B为_______ 。
(5)X处包含_______ 纵列,_______ 个族。
(6)i单质与d的简单氢化物反应的离子方程式为_______ 。

(1)h、i的简单离子半径由大到小的顺序为
(2)i、e、f的最高价氧化物对应的水化物的碱性由强到弱的顺序是
(3)用电子式表示e和h形成离子化合物的过程:
(4)非金属性:b

(5)X处包含
(6)i单质与d的简单氢化物反应的离子方程式为
您最近一年使用:0次
解题方法
2 . 下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答以下问题。
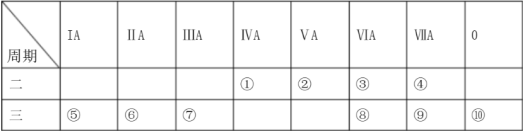
(1)非金属性最强的元素是___________ (填元素符号,下同),最外层电子数是次外层电子数2倍的元素是___________ ,这种元素的一种同位素可用于测定文物年代,这种同位素的符号是___________ 。
(2)与⑥同主族的下一周期的元素是___________ (填元素符号),它在元素周期表中的位置是___________ ,请写出它的原子结构示意图___________ 。
(3)请写出⑦的单质与碱液反应的离子方程式___________ 。

(1)非金属性最强的元素是
(2)与⑥同主族的下一周期的元素是
(3)请写出⑦的单质与碱液反应的离子方程式
您最近一年使用:0次
2024-04-03更新
|
85次组卷
|
2卷引用:四川省雅安市名山区第三中学2023-2024学年高一12月月考化学试题
3 . 下表是元素周期表的一部分。请按要求回答下列问题:
(1)氧元素在周期表中的位置是___________ ,⑦的最高价氧化物对应水化物的化学式___________ 。
(2)上述所列元素最高价氧化物对应水化物碱性最强的是___________ (填化学式)。
(3)写出由上述所列元素形成的18电子的双原子分子的化学式___________ 。
(4)已知X为第四周期第IIIA族元素,其原子序数为a,Y与X位于同一周期,且为第IIA族元素,写出Y的原子序数b=___________ (用含a的代数式表示)。
(5)下列说法不正确的是___________。
(6)BrCl属于卤素互化物,性质与Cl2相似。写出BrCl与氢氧化钠溶液反应的化学方程式___________ 。
族 周期 | IA | 0 | ||||||
| 1 | ④ | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ⑦ | |||||
| 4 | ② | ⑧ | ||||||
(2)上述所列元素最高价氧化物对应水化物碱性最强的是
(3)写出由上述所列元素形成的18电子的双原子分子的化学式
(4)已知X为第四周期第IIIA族元素,其原子序数为a,Y与X位于同一周期,且为第IIA族元素,写出Y的原子序数b=
(5)下列说法不正确的是___________。
| A.⑥形成的最简单氢化物比⑤形成的最简单氢化物的稳定性高 |
| B.元素最高正价与最低负价绝对值相等的元素一定处于第IVA族 |
| C.第5周期第VIIA族元素的原子序数为53 |
| D.周期表中当某元素的周期序数大于其主族序数时,该元素可能属于金属或非金属 |
您最近一年使用:0次
名校
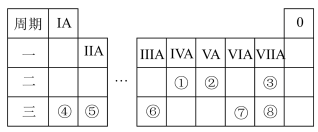
4 . 元素周期表反映了元素之间的内在联系,是研究物质性质的重要工具。下图是元素周期表的一部分,请结合推断回答下列问题:________ (填元素符号);简单离子半径最小的元素是:________ (填离子符号)。
(2)由这些元素中原子半径最大与最小的两种元素形成的化合物X的电子式为________ ;画出X中阴离子的离子结构示意图:________ 。
(3)⑦⑧两种元素的最高价氧化物的水化物酸性较强的是________ (填化学式)。
(4)⑥的单质与强碱反应的离子方程式为________ 。
(5)根据周期表的结构特点,推断在第四周期中与⑤和⑥同族的元素原子序数相差________ 。
(6)查阅资料可知:⑤的单质可以在①的最高价氧化物中燃烧,瓶壁上出现大量白色和黑色的颗粒,试写出发生反应的化学方程式:________ 。
(2)由这些元素中原子半径最大与最小的两种元素形成的化合物X的电子式为
(3)⑦⑧两种元素的最高价氧化物的水化物酸性较强的是
(4)⑥的单质与强碱反应的离子方程式为
(5)根据周期表的结构特点,推断在第四周期中与⑤和⑥同族的元素原子序数相差
(6)查阅资料可知:⑤的单质可以在①的最高价氧化物中燃烧,瓶壁上出现大量白色和黑色的颗粒,试写出发生反应的化学方程式:
您最近一年使用:0次
2024-04-03更新
|
239次组卷
|
2卷引用:辽宁省名校联盟2023-2024学年高一下学期3月联合考试化学试题
5 . Ti、Na、Mg、C、N、O、Fe等元素的研究一直在进行中,其单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)钠在火焰上灼烧的黄光是一种___________ (填字母)。
A.吸收光谱 B.发射光谱
(2)下列Mg原子的核外电子排布式中,能量最高的是___________ (填序号)。
a. b.
b.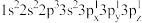 c.
c.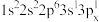 d.
d.
(3)Ti原子最高能层电子的电子云轮廓形状为___________ ,Ti原子位于元素周期表中的___________ 区,与Ti同周期的过渡元素中,未成对电子数最多的的基态原子的外围电子的轨道表示式___________ 。
(4)N元素基态原子核外电子有___________ 种不同的空间运动状态,能量最高的电子所在原子轨道在空间有___________ 个伸展方向。
(1)钠在火焰上灼烧的黄光是一种
A.吸收光谱 B.发射光谱
(2)下列Mg原子的核外电子排布式中,能量最高的是
a.
 b.
b.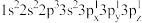 c.
c.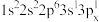 d.
d.
(3)Ti原子最高能层电子的电子云轮廓形状为
(4)N元素基态原子核外电子有
您最近一年使用:0次
名校
6 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系,下图是元素周期表的一部分,回答下列问题:
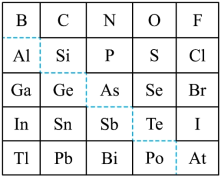
(1)元素Ga在元素周期表中的位置为:______ ;
(2)Sn的最高正价为______ ,C1的最高价氧化物对应水化物的化学式为______ ;
(3)根据元素周期律,推断
①表中元素形成的氢化物中热稳定性最高的是______ (写化学式),其电子式为______ 。
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4______ H2SeO4(填“>”、<”、“=”或“无法比较”);
③氢化物的还原性:H2O______ H2S(填“>”、“<”、“=”或“无法比较”)。
④原子半径比较:N______ Si(填“>”、“<”、“=”或“无法比较”)。

(1)元素Ga在元素周期表中的位置为:
(2)Sn的最高正价为
(3)根据元素周期律,推断
①表中元素形成的氢化物中热稳定性最高的是
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4
③氢化物的还原性:H2O
④原子半径比较:N
您最近一年使用:0次
名校
7 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的元素周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构。性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
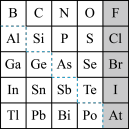
(1) 的结构示意图是
的结构示意图是___________ 。
(2)元素In在元素周期表中的位置是___________ 。
(3)P的最高价氧化物的化学式为___________ ,Al元素的最高价氧化物对应的水化物与S元素的最高价氧化物对应的水化物发生反应的离子方程式是___________ 。
(4)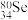 的中子数与电子数的差值是
的中子数与电子数的差值是___________ ;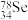 和
和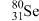 的物理性质
的物理性质___________ (填“相同”或“不同”),化学性质___________ (填“相同”或“不同”)。
(5)根据元素周期律及事实推断:
①在溶液中下列反应能发生的是___________ 。
A.
B.
C.
②氢化物的还原性:
___________  (填“>”或“<”)。
(填“>”或“<”)。

(1)
 的结构示意图是
的结构示意图是(2)元素In在元素周期表中的位置是
(3)P的最高价氧化物的化学式为
(4)
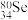 的中子数与电子数的差值是
的中子数与电子数的差值是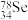 和
和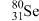 的物理性质
的物理性质(5)根据元素周期律及事实推断:
①在溶液中下列反应能发生的是
A.

B.

C.

②氢化物的还原性:

 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
8 . 核外电子排布与元素周期系的基本结构
①根据构造原理得出的核外电子排布可以解释元素周期系中每个周期的元素数。第一周期从1s1开始,以1s2结束,只有_______ 种元素。其余各周期总是从ns能级开始,以np结束,而从ns能级开始以np结束递增的核电荷数(或电子数)就_______ 每个周期里的元素数。
②周期、能级组、元素种类的对应关系
①根据构造原理得出的核外电子排布可以解释元素周期系中每个周期的元素数。第一周期从1s1开始,以1s2结束,只有
②周期、能级组、元素种类的对应关系
| 周期 | 对应能级组 | 对应能级组最多所能容纳的电子数 | 周期中所含元素种类 |
| 1 | 1s | 2 | 2 |
| 2 | 8 | ||
| 3 | 3s、3p | 8 | 8 |
| 4 | 18 | ||
| 5 | 5s、4d、5p | 18 | 18 |
| 6 | 32 | ||
| 7 | 7s、5f、6d、7p | 32 | 32 |
您最近一年使用:0次
9 . 核外电子排布与元素周期表的分区
按电子排布式中最后填入电子的_______ 可将元素周期表分为s、p、d、f4个区,而IB、IIB族这2个纵行的元素的核外电子可理解为先填满了_______ 能级而后再填充_______ 能级而得名ds区。5个区的位置关系如下图所示:
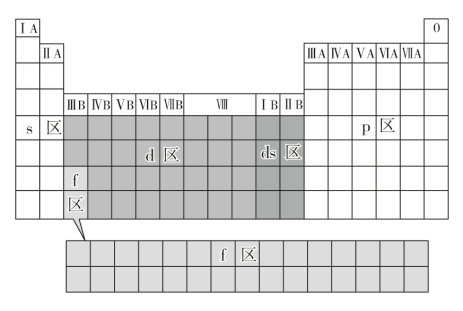
按电子排布式中最后填入电子的

您最近一年使用:0次
解题方法
10 . 作为元素周期律表现形式的元素周期表,反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。下表是元素周期表中的一部分,请参照以下六种元素(每种字母分别代表一种元素)在表中的位置,回答下列问题:
回答下列问题:
(1)M的原子结构示意图为________ 。
(2)M与Z可形成一种离子化合物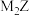 ,其电子式为
,其电子式为________ 。
(3)原子半径:X________ Z(填“大于”或“小于”,下同);简单氢化物的稳定性:Z________ N。
(4)X、Y的最高价氧化物对应水化物的酸性:________ 
________ (填化学式)。
(5)由M和Z组成的一种化合物可用作核潜艇中氧气的来源,该化合物的名称是________ ,其中含有的化学键类型是________ 、________ 。
| 族 周期 | ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | X | Y | Z | |||||
3 | M | N | W |
(1)M的原子结构示意图为
(2)M与Z可形成一种离子化合物
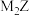 ,其电子式为
,其电子式为(3)原子半径:X
(4)X、Y的最高价氧化物对应水化物的酸性:

(5)由M和Z组成的一种化合物可用作核潜艇中氧气的来源,该化合物的名称是
您最近一年使用:0次



