名校
解题方法
1 . 短周期主族元素X、Y、Z、W的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法不正确的是( )


| A.Y、Z、W三种元素电负性:W>Z>Y |
| B.Y、Z、W三种元素第一电离能:Z>W>Y |
| C.L的沸点一定比X、Y组成的化合物沸点高 |
| D.由X、Y、Z、W构成的化合物中只能含有共价键 |
您最近一年使用:0次
2020-06-24更新
|
556次组卷
|
6卷引用:福建省建瓯市芝华中学2019-2020学年高二下学期居家学习检测化学试题
名校
解题方法
2 . 硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式为:AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr。下列说法正确的是
| A.基态Br原子中电子的空间运动状态有35种 | B.[Ag(S2O3)2]3-中含有离子键、共价键、配位键 |
C. 中心原子S的杂化方式为sp3 中心原子S的杂化方式为sp3 | D.非金属元素S、O、Br中电负性最大的是Br |
您最近一年使用:0次
2020-06-22更新
|
423次组卷
|
5卷引用:福建泉州养正中学、安溪一中、惠安一中、实验中学2022-2023学年高二下学期期中联考化学试题
名校
解题方法
3 . 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素:

(1)I的最高化合价为________ ,K的元素名称为________ 。
(2)基态时Q元素原子的电子排布式_________________________________ ,J元素原子的外围电子排布式______________________ 。
(3)下列对比正确的是________ 。
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是________ 。
a.L位于元素周期表中第5周期ⅠA族,属于s区元素
b.O位于元素周期表中第7周期ⅧB族,属于d区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
(5)由P、A、C三种元素形成的某化合物,对氢气的相对密度为15,则该分子的键角约为________ 。
(6)元素B和C的气态氢化物热稳定性较强的是________ (填化学式)。
(7)K的常见离子和B的最简单氢化物形成的配离子的名称为________ ,其水溶液颜色为________ 。Ag和元素K同族,且在K的下一周期,则Ag元素的原子序数为________ ,Ag也可以和B的最简单氢化物形成配离子,配位数为2,该配离子的符号为________ 。

(1)I的最高化合价为
(2)基态时Q元素原子的电子排布式
(3)下列对比正确的是
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是
a.L位于元素周期表中第5周期ⅠA族,属于s区元素
b.O位于元素周期表中第7周期ⅧB族,属于d区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
(5)由P、A、C三种元素形成的某化合物,对氢气的相对密度为15,则该分子的键角约为
(6)元素B和C的气态氢化物热稳定性较强的是
(7)K的常见离子和B的最简单氢化物形成的配离子的名称为
您最近一年使用:0次
名校
解题方法
4 . 羟基磷酸钙[Ca10(PO4)6(OH)2]具有优良的生物相容性和生物活性,它在口腔保健中具有重要作用,可以防止龋齿等,回答下列问题。
(1)Ca10(PO4)6(OH)2中,元素的电负性按由大到小的顺序依次是___ 。
(2)上述元素都能形成氢化物,其中PH3与同主族元素N形成的氢化物的沸点是PH3___ NH3(填“>”或“<”),原因是___ 。
(3)碳酸钙的分解温度远高于碳酸镁,其原因是__ 。
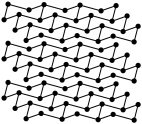
(4)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图所示:其中最小的环为6元环,每个环平均含有__ 个P原子。
(1)Ca10(PO4)6(OH)2中,元素的电负性按由大到小的顺序依次是
(2)上述元素都能形成氢化物,其中PH3与同主族元素N形成的氢化物的沸点是PH3
(3)碳酸钙的分解温度远高于碳酸镁,其原因是
(4)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图所示:其中最小的环为6元环,每个环平均含有

您最近一年使用:0次
5 . 已知X、Y、Z、W是短周期元素。X元素原子的2p能级处于半充满状态;Y元素原子L电子层上s电子数和p电子数相等;Z元素的+2价阳离子的核外电子排布与氖原子相同;W元素原子的M电子层有1个未成对的p电子。下列说法一定正确的是
| A.含有X元素的化合物一定是共价化合物 |
| B.Y元素的电负性大于X元素的电负性 |
| C.W元素的单质能与NaOH溶液反应放出氢气 |
| D.X元素的单质与Z元素的单质在一定条件下能发生化合反应 |
您最近一年使用:0次
2020-05-14更新
|
612次组卷
|
11卷引用:福建省仙游第一中学2022-2023学年高二下学期第一次月考化学试题
福建省仙游第一中学2022-2023学年高二下学期第一次月考化学试题人教化学选修3第一章第二节课时5第1章 原子结构——B拓展区综合拓展(鲁科版选修3)江苏省南通中学2019-2020学年高二下学期期中考试化学试题新疆昌吉回族自治州第二中学2019-2020学年高二下学期期中考试化学试题宁夏吴忠市吴忠中学2020-2021学年高二3月月考化学试题新疆乌鲁木齐市第八中学2021-2022学年高二下学期期中考试化学试题江苏省苏州市相城区陆慕高级中学2021-2022学年高二下学期第一次月考化学试题安徽省合肥市第一中学2022-2023学年高二下学期第一次质量检测化学试题河南省焦作市2022-2023学年第四中学高二下学期3月月考 化学试卷(人教版2019)选择性必修2 第一章 原子结构与性质 C高考挑战区
名校
解题方法
6 . 现有四种元素的基态原子的电子排布式如下: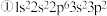 ;
; 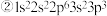 ;
; 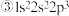 ;
;  则下列有关比较中正确的是
则下列有关比较中正确的是
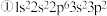 ;
; 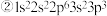 ;
; 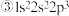 ;
;  则下列有关比较中正确的是
则下列有关比较中正确的是A.电负性: | B.原子半径: |
C.第一电离能: | D.最高正化合价: |
您最近一年使用:0次
2019-12-22更新
|
431次组卷
|
8卷引用:福建省福州第一中学2021-2022学年高二下学期期中考试化学试题
福建省福州第一中学2021-2022学年高二下学期期中考试化学试题2016-2017学年四川省成都市九校高二下学期期中联考化学试卷2016-2017学年山东省淄博市高青一中、淄博实验中学高二下学期期中联考化学试卷【全国百强校】内蒙古北方重工业集团有限公司第三中学2017-2018学年高二下学期期末考试化学试题湖北省黄冈市浠水实验高中2019—2020学年高二上学期12月月考化学试题山西省实验中学2019-2020学年高二下学期第一次月考化学试题四川省广安市第二中学校2022-2023学年高二下学期期中考试化学试题(已下线)专题13 原子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)
名校
解题方法
7 . 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。
Ⅰ.羰基法提纯粗镍涉及的两步反应依次为:
①Ni(S)+4CO(g) Ni(CO)4(g) ②Ni(CO)4(g)
Ni(CO)4(g) ②Ni(CO)4(g) Ni(S)+4CO(g)
Ni(S)+4CO(g)
完成下列填空:
(1)在上述反应中断裂或形成的化学键有____ (填序号)。
A.离子键 B.配位键 C.非极性共价键 D.金属键
(2)比较C元素和O元素分别形成的最简单气态氢化物的稳定性大小________ 。
(3)C、O、Ni元素的电负性由大到小排列顺序为______ 。
(4)化合物Ni(CO)4呈正四面体构型,Ni(CO)4中Ni原子的杂化类型为____ 。
(5)基态Ni原子的外围电子排布式___ ,价电子的轨道表示式为__________ 。
Ⅱ.研究金属镍及其化合物晶体结构具有重要意义。
(6)NiO、FeO的晶体结构类型均与氯化钠的相同,且Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO_______ FeO(填“<”或“>”);
Ⅰ.羰基法提纯粗镍涉及的两步反应依次为:
①Ni(S)+4CO(g)
 Ni(CO)4(g) ②Ni(CO)4(g)
Ni(CO)4(g) ②Ni(CO)4(g) Ni(S)+4CO(g)
Ni(S)+4CO(g)完成下列填空:
(1)在上述反应中断裂或形成的化学键有
A.离子键 B.配位键 C.非极性共价键 D.金属键
(2)比较C元素和O元素分别形成的最简单气态氢化物的稳定性大小
(3)C、O、Ni元素的电负性由大到小排列顺序为
(4)化合物Ni(CO)4呈正四面体构型,Ni(CO)4中Ni原子的杂化类型为
(5)基态Ni原子的外围电子排布式
Ⅱ.研究金属镍及其化合物晶体结构具有重要意义。
(6)NiO、FeO的晶体结构类型均与氯化钠的相同,且Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO
您最近一年使用:0次
名校
解题方法
8 . 常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)Ga 基态原子核外电子排布式为_______ ,As 基态原子核外有_______ 个未成对电子。
(2)Ga、As、Se 的电负性由大到小的顺序是__________ 。
(3)GaCl3和AsF3的立体构型分别是____________ ,__________ 。
(4)比较下列镓的卤化物的熔点和沸点,分析其变化的原因:____________ 。
GaF3的熔点超过1000 ℃,可能的原因是_____ 。
(5)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。[B(OH)4]-中B原子的杂化类型为______ 。
(6)若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅,若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是__________ (用化学式表示);
(1)Ga 基态原子核外电子排布式为
(2)Ga、As、Se 的电负性由大到小的顺序是
(3)GaCl3和AsF3的立体构型分别是
(4)比较下列镓的卤化物的熔点和沸点,分析其变化的原因:
| 镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
| 熔点/℃ | 77.75 | 122.3 | 211.5 |
| 沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000 ℃,可能的原因是
(5)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。[B(OH)4]-中B原子的杂化类型为
(6)若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅,若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是
您最近一年使用:0次
名校
解题方法
9 . Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Co原子的价电子排布式为_______ ,Co2+核外3d能级上有_____ 对成对电子。
(2)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是________ 。1 mol配离子中所含σ键的数目为________ ,配位体N3-中心原子的杂化类型为________ 。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+,其原因是_________________________________________________ 。
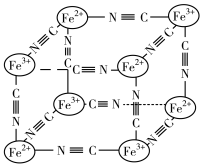
(4)某蓝色晶体晶体结构如图,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的体心上。据此可知该晶体的化学式为________ ,立方体中Fe2+间连接起来形成的空间构型是________ 。K+空缺率(体心中没有K+的占总体心的百分比)为_____________ 。
(5)NiO的晶胞结构如图甲所示,其中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为________ 。
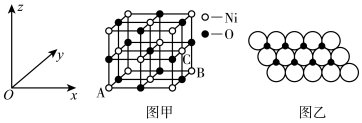
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为________ g(用含a、NA的代数式表示)。
(1)基态Co原子的价电子排布式为
(2)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+,其原因是
(4)某蓝色晶体晶体结构如图,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的体心上。据此可知该晶体的化学式为

(5)NiO的晶胞结构如图甲所示,其中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为

(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为
您最近一年使用:0次
名校
解题方法
10 . I.双氰胺结构简式如图。

(1)双氰胺的晶体类型为_____ 。
(2)双氰胺所含元素中,_____ (填元素名称)元素基态原子核外未成对电子数最多。
(3)双氰胺分子中σ键和π键数目之比为_____
II.硼的最简单氢化物——乙硼烷球棍模型如图,由它制取硼氢化锂的反应为:2LiH + B2H6 =2LiBH4

(4)乙硼烷分子中硼原子的杂化轨道类型为______ 。
(5)BH4-为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为____ (填序号)。
A 离子键 B 金属键 C 氢键 D 配位键 E 极性键 F 非极性键
(6)根据以上反应判断,其中涉及元素的电负性从小到大的顺序为____ (填元素符号)。
Ⅲ.金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。

(7)晶体铝中原子的堆积方式为_____ 。
(8)已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏伽德罗常数的值为NA,则晶体铝的密度ρ=___ g·cm-3(用含a、M、NA的代数式来表示)。

(1)双氰胺的晶体类型为
(2)双氰胺所含元素中,
(3)双氰胺分子中σ键和π键数目之比为
II.硼的最简单氢化物——乙硼烷球棍模型如图,由它制取硼氢化锂的反应为:2LiH + B2H6 =2LiBH4

(4)乙硼烷分子中硼原子的杂化轨道类型为
(5)BH4-为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为
A 离子键 B 金属键 C 氢键 D 配位键 E 极性键 F 非极性键
(6)根据以上反应判断,其中涉及元素的电负性从小到大的顺序为
Ⅲ.金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。

(7)晶体铝中原子的堆积方式为
(8)已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏伽德罗常数的值为NA,则晶体铝的密度ρ=
您最近一年使用:0次



