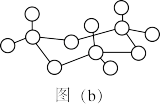
| A.还原性:H2S>HF |
| B.离子半径:S2->O2->F- |
| C.上述反应中被还原的元素的基态原子的成对电子个数为4 |
D.上述反应的四种元素中电负性最强的元素的基态原子价层电子排布图为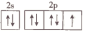 |
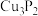 )用于制造磷青铜,磷青铜是含少量金属锡、磷的铜合金,主要用作耐磨零件和弹性原件,磷化铜与水作用产生有毒的
)用于制造磷青铜,磷青铜是含少量金属锡、磷的铜合金,主要用作耐磨零件和弹性原件,磷化铜与水作用产生有毒的 ,下列判断错误的是
,下列判断错误的是A. 中心原子的杂化方式为 中心原子的杂化方式为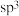 |
| B.电负性:Cu<P |
C.熔沸点: > > |
D.基态Cu原子的价电子轨道表示式为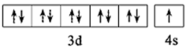 |
① 1s22s22p63s23p4 ② 1s22s22p63s23p3 。则下列有关比较中正确的是
| A.未成对电子数:①>② | B.原子半径大小:①>② |
| C.电负性大小:②>① | D.第一电离能大小:②>① |
| A.SO2、SO3都是极性分子 |
B.在 和[Cu(NH3)4]2+中都存在配位键 和[Cu(NH3)4]2+中都存在配位键 |
| C.元素电负性越大的原子,吸引电子的能力越强 |
| D.CO可以和很多金属形成配合物,如Ni(CO)2,Ni与CO之间的键型为配位键 |
| A.具有下列电子排布式的原子中:①1s22s22p63s23p2,②1s22s22p3,③1s22s22p2,④1s22s22p63s23p4,原子半径最大的是① |
| B.下列价电子排布式的原子中:①3s23p1,②3s23p2,③3s23p3,④3s23p4,第一电离能最大的是③ |
| C.①Na、K、Rb,②N、P、As,③O、S、Se,④Na、P、Cl中,元素的电负性随原子序数增大而递增的是④ |
| D.某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
(1)G的元素名称为
(2)A、B、C三种元素电负性由大到小的顺序为
(3)E3+的离子符号为
(4)F元素基态原子的电子排布式为
(5)G元素可能的性质
A.其单质可作为半导体材料 B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸 D.其第一电离能小
| A.X原子的最外层电子数比Y原子的最外层电子数多 |
| B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
| C.与H2化合时X单质比Y单质容易 |
| D.X单质可以把Y从其氢化物中置换出来 |
8 . 2019年10月1日,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF—31a洲际战略导弹是我国大国地位,国防实力的显著标志,其制作材料中包含了Fe、Cr、Ni、C等多种元素,回答下列问题:
①基态铬原子的价电子排布式为
②Fe和Ni都能与CO形成配合物Fe(CO)5和Ni(CO)4。
(i)电负性比较:C
(ii)写出与CO互为等电子体的分子的电子式
(iii)Ni(CO)4的沸点为43℃,Fe(CO)5的沸点为103℃,请说明Fe(CO)5沸点更高的原因:
③金刚石晶胞如图所示,A、B坐标参数分别为A(0,0,0),B(1,1,1),则距离A位置最近的原子坐标参数为

④Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别是Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为
| 元素 | X | Y | Z | W |
| 最高价氧化物的水化物 | H3ZO4 | |||
 溶液对应的pH(25℃) 溶液对应的pH(25℃) | 1.00 | 13.00 | 1.57 | 0.70 |
| A.元素电负性:Z<W | B.简单离子半径:W<Y |
| C.元素第一电离能:Z<W | D.简单氢化物的沸点:X<Z |
(1)D元素在周期表中的位置为
(2)由A、B、D三种元素形成的常见三元化合物中具有强氧化性的是
(3)A、B、D元素形成的化合物有A2B、DB3,下列关于A2B和DB3的说法中,正确的是
A.中心原子的价层电子对数目相等B.都是非极性分子C.中心原子的孤电子对数目相等D.都含有极性键E.都能与Na2O反应F.固态时晶体类型不同
(4)D在空气中燃烧的产物分子构型为