1 . 下列说法正确的是
A.基态原子的未成对电子数: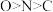 | B.电负性: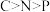 |
C.第一电离能: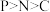 | D.键角: |
您最近一年使用:0次
2 . W、X、Y、Z、R是五种短周期主族元素,原子序数依次增大。W元素的一种离子与Li+具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为3:2,X与Z同主族,Z的价电子排布式为3s23p4。下列说法不正确的是
| A.气态氢化物的热稳定性:Z>Y | B.第一电离能:R>Z>Y |
| C.原子半径:R>X>W | D.电负性:Z>R>X |
您最近一年使用:0次
2023-03-22更新
|
399次组卷
|
2卷引用:天津市部分区2023届高三一模考试化学试题
名校
解题方法
3 . 下列与分子性质有关的说法正确的是
A.邻硝基苯酚( )的沸点高于对硝基苯酚( )的沸点高于对硝基苯酚( )是因为后者形成了分子间氢键 )是因为后者形成了分子间氢键 |
B. 的酸性强于 的酸性强于 是因为 是因为 的电负性大,使 的电负性大,使 中 中 极性强 极性强 |
C.C的电负性强于Si,所以 的熔沸点高于 的熔沸点高于 |
D.尿素 不溶于水,易溶于有机溶剂 不溶于水,易溶于有机溶剂 |
您最近一年使用:0次
2023-03-10更新
|
1246次组卷
|
7卷引用:天津市武清区城关中学、杨村第四中学、黄花店中学2022-2023学年高二下学期第一次阶段考化学试题
名校
4 . 能源、材料与生产生活和社会发展密切相关。
I.光伏材料是指能将太阳能直接转换成电能的材料。光伏材料又称太阳能材料,只有半导体材料具有这种功能。可作太阳能电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe等。
(1)写出31号元素镓(Ga)的原子结构示意图:_______ 。
(2)P、S、Ga电负性从大到小的顺序为_______ 。
(3)As元素的第一电离能_______ (填“大于”“小于”或“等于”)Se元素的第一电离能。
(4)写出原子序数最小的第VIII族元素基态原子的核外电子排布式:_______ 。
(5)写出3p轨道上只有2个未成对电子的元素的符号:_______ 、_______ 。
II.从化学键的角度分析,化学反应的过程就是反应物的化学键断裂和生成物的化学键形成的过程。在化学反应过程中,断裂化学键需要消耗能量,形成化学键又会释放能量。
(6)已知:
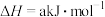 ,根据上表中所列键能数据可计算出a=
,根据上表中所列键能数据可计算出a=_______ 。
I.光伏材料是指能将太阳能直接转换成电能的材料。光伏材料又称太阳能材料,只有半导体材料具有这种功能。可作太阳能电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe等。
(1)写出31号元素镓(Ga)的原子结构示意图:
(2)P、S、Ga电负性从大到小的顺序为
(3)As元素的第一电离能
(4)写出原子序数最小的第VIII族元素基态原子的核外电子排布式:
(5)写出3p轨道上只有2个未成对电子的元素的符号:
II.从化学键的角度分析,化学反应的过程就是反应物的化学键断裂和生成物的化学键形成的过程。在化学反应过程中,断裂化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 | H—H | N—H | N≡N |
| 键能/(kJ/mol) | 436 | 391 | 945 |

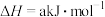 ,根据上表中所列键能数据可计算出a=
,根据上表中所列键能数据可计算出a=
您最近一年使用:0次
名校
5 . 有关周期表和周期律的说法正确的是
| A.周期表p区所有元素,电子最后填入的能级均为p能级 |
| B.第二周期元素,电离能介于B和N之间的元素有1种 |
| C.周期表第14列元素形成化合物种类最多 |
| D.同一周期,第ⅡA族元素电负性大于第ⅢA族元素 |
您最近一年使用:0次
2023-02-11更新
|
712次组卷
|
9卷引用:天津市武清区城关中学、杨村第四中学、黄花店中学2022-2023学年高二下学期第一次阶段考化学试题
天津市武清区城关中学、杨村第四中学、黄花店中学2022-2023学年高二下学期第一次阶段考化学试题山东省济宁市2022-2023学年高二上学期期末考试化学试题山东省曹县第一中学2022-2023学年高二下学期2月月考化学试题广东省梅州市梅州五校2022-2023学年高二下学期4月期中联考化学试题河南省淮滨高级中学2022-2023学年高二下学期期中教学质量检测化学试题河北省邢台市重点高中联考2022-2023学年高二下学期6月月考化学试题广东番禺中学2022-2023学年高二下学期4月期中考试化学试题河南省信阳市第十高级中学2022-2023学年高二下学期期中教学质量检测化学试卷湖北省荆州市沙市中学2022-2023学年高二下学期2月月考化学试题
名校
6 . 如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法中,正确的是
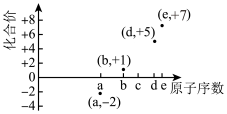

A.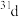 和 和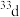 属于同种核素 属于同种核素 | B.第一电离能: ,电负性: ,电负性: |
C.最简单气态氢化物的稳定性: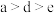 | D.a和b形成的化合物可能含共价键 |
您最近一年使用:0次
7 . 黑火药是中国古代四大发明之一,其爆炸反应为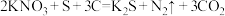 下列说法正确的是
下列说法正确的是
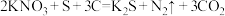 下列说法正确的是
下列说法正确的是A.半径: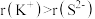 | B.第一电离能: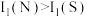 |
C.电负性: | D.酸性: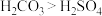 |
您最近一年使用:0次
名校
解题方法
8 . 含ⅥA族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)基态O原子电子占据最高能级的电子云轮廓图为_______ 形。
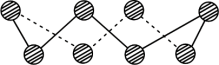
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是_______ 。
(3)Se的核外M层电子的排布式为_______ 。
(4)关于物质I~Ⅳ,下列说法正确的有_______ 。
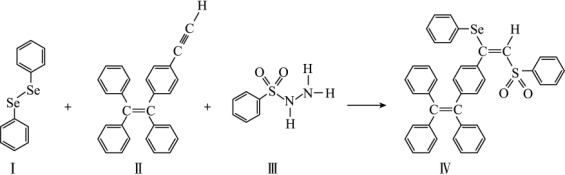
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.I易溶于水
D.II中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅳ含有的元素中,O电负性最大
(5)常温下CO2是气体而CS2是液体的原因是_______ 。
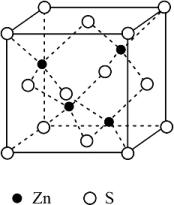
(6)立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有_______ 个。晶胞棱长为apm,密度为_______ gcm3(NA表示阿伏加德罗常数的值)。
(1)基态O原子电子占据最高能级的电子云轮廓图为
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是

(3)Se的核外M层电子的排布式为
(4)关于物质I~Ⅳ,下列说法正确的有

A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.I易溶于水
D.II中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅳ含有的元素中,O电负性最大
(5)常温下CO2是气体而CS2是液体的原因是
(6)立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有

您最近一年使用:0次
名校
9 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)写出元素G在周期表中的位置为_______ ,价电子排布式为_______ 。
(2)A、B、C三种元素的第一电离能由大到小为:_______ 。
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,键角由大到小的顺序为_______ 。
(4)D、E、F三种元素的电负性由大到小为:_______ 。
(5)电解D与F形成的化合物的水溶液在工业上有着重要应用,其电解的总反应化学方程式为_______ 。阴极产物为_______
(6)工业上冶炼单质E的化学反应方程式_______ 。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为3s23p1 |
| F | 基态原子的最外层p轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 生活中使用最多的一种金属 |
(2)A、B、C三种元素的第一电离能由大到小为:
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,键角由大到小的顺序为
(4)D、E、F三种元素的电负性由大到小为:
(5)电解D与F形成的化合物的水溶液在工业上有着重要应用,其电解的总反应化学方程式为
(6)工业上冶炼单质E的化学反应方程式
您最近一年使用:0次
名校
解题方法
10 . A、B、C、D、E是原子序数依次增大 的六种短周期元素,其元素性质或原子结构如下。
(1)写出B、D的元素名称:B_______ 、D_______ 。
(2)元素F位于周期表的_______ 区,其价电子的排布式为_______ 。
(3)A、C和E三种元素的电负性由大到小的顺序:_______ (请填元素符号)
(4)已知元素A、B形成的(AB)2链状分子中所有原子都满足8电子稳定结构,则其分子中σ键与π键之比为_______ 。
(5)烯丙醇(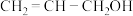 )分子中碳原子的杂化类型为
)分子中碳原子的杂化类型为_______ 。
(6)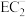 的空间构型为
的空间构型为_______ 。
(7)电解D与E形成的化合物的水溶液在工业上有着重要应用,请写出其电解的总化学方程式_______ 。
| 元素 | 元素性质或原子结构 |
| A | 原子核外有6种不同运动状态的电子 |
| B | 原子最高能级的不同轨道都有电子且自旋方向相同 |
| C | 原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能都低于同周期相邻元素 |
| D | 在同周期元素中,原子半径最大、第一电离能最小 |
| E | 元素最高正价与最低负价代数和为6 |
| F | 基态原子的M层全充满,N层只有一个电子 |
(2)元素F位于周期表的
(3)A、C和E三种元素的电负性由大到小的顺序:
(4)已知元素A、B形成的(AB)2链状分子中所有原子都满足8电子稳定结构,则其分子中σ键与π键之比为
(5)烯丙醇(
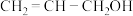 )分子中碳原子的杂化类型为
)分子中碳原子的杂化类型为(6)
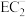 的空间构型为
的空间构型为(7)电解D与E形成的化合物的水溶液在工业上有着重要应用,请写出其电解的总化学方程式
您最近一年使用:0次



