1 . 下列与分子性质有关的说法正确的是
| A.氟代丙二酸(HOOC—CF2—COOH)酸性强于丙二酸(HOOC—CH2—COOH)是因为F原子吸引电子能力大于H原子,导致氟代丙二酸羧基中-OH的极性更大更易电离出H+ |
B.邻硝基苯酚(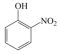 )的沸点高于对硝基苯酚( )的沸点高于对硝基苯酚(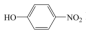 )是因为后者形成了分子间氢键 )是因为后者形成了分子间氢键 |
| C.C的电负性强于Si,所以CH4的熔沸点高于SiH4 |
| D.I2受热易升华,是因为分子内共价键键能较小所致 |
您最近一年使用:0次
名校
解题方法
2 . 物质的光学性质在科研中有重要的用途。回答下列问题:
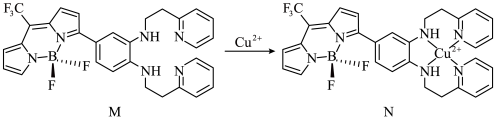
Ⅰ.一种比率光声探针M与Cu2+配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:___________ ,M中键角F-B-F___________  中键角F-B-F(填“>”、“<”或“=”);基态
中键角F-B-F(填“>”、“<”或“=”);基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为___________ 。
(2)均为平面结构的吡咯(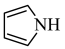 )和吡啶(
)和吡啶(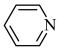 )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为___________ ,原因是___________ 。
Ⅱ.铪(Hf)的卤化物八面体离子是构建卤化物钙钛矿的基本发光单元,其构建的某晶胞结构如图所示。 的配位数为
的配位数为___________ ,阴离子形成的八面体空隙有___________ 个。
(4)该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Hf-Hf最近距离为
,则Hf-Hf最近距离为___________ nm。
Ⅰ.一种比率光声探针M与Cu2+配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
 中键角F-B-F(填“>”、“<”或“=”);基态
中键角F-B-F(填“>”、“<”或“=”);基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为(2)均为平面结构的吡咯(
 )和吡啶(
)和吡啶( )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为Ⅱ.铪(Hf)的卤化物八面体离子是构建卤化物钙钛矿的基本发光单元,其构建的某晶胞结构如图所示。
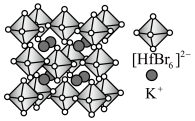
 的配位数为
的配位数为(4)该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Hf-Hf最近距离为
,则Hf-Hf最近距离为
您最近一年使用:0次
2024-03-14更新
|
1143次组卷
|
4卷引用:山东省德州市2023-2024学年高三下学期一模考试化学试题
山东省德州市2023-2024学年高三下学期一模考试化学试题山东省烟台市2024届高三一模化学试题2024届山东省高三下学期第一次练兵考试一模化学试题(已下线)化学(山东卷03)-2024年高考押题预测卷
名校
3 . 下列有关物质的结构与性质的说法错误的是
A.甘油酸(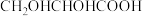 )中含有两个手性碳原子,是手性分子 )中含有两个手性碳原子,是手性分子 |
B.已知: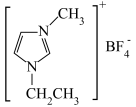 常温下呈液态,推测其是离子液体 常温下呈液态,推测其是离子液体 |
| C.氟的电负性大于氯的电负性,导致三氟乙酸的酸性大于三氯乙酸的酸性 |
| D.冠醚利用不同大小的空穴适配不同大小的碱金属离子进行“分子识别” |
您最近一年使用:0次
2024-02-04更新
|
121次组卷
|
2卷引用:山东省德州市齐河县第一中学2023-2024学年高二下学期4月月考化学试题
4 . 铬是一种重要的元素,在合金、电镀、鞣制领域都有重要的应用, 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。
(1)基态Cr原子价层电子的轨道表达式为__________ ,同周期元素的基态原子最外层电子数与Cr相同的元素有__________ 种。
(2) 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为__________ ,基态S原子核外电子中成对电子数和未成对电子数之比为__________ 。
(3)NH3、H2O、 都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是
都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是____________________ 。
(4) 中
中 键的数目为
键的数目为__________ ,基态N原子电子占据最高能级的电子云轮廓图为__________ 形。
(5)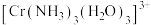 中配体
中配体 的杂化类型是
的杂化类型是__________ , 的键角
的键角__________  的键角(填“大于”、“小于”或“等于”),判断依据是
的键角(填“大于”、“小于”或“等于”),判断依据是______________________________ 。
 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。(1)基态Cr原子价层电子的轨道表达式为
(2)
 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为(3)NH3、H2O、
 都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是
都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是(4)
 中
中 键的数目为
键的数目为(5)
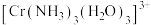 中配体
中配体 的杂化类型是
的杂化类型是 的键角
的键角 的键角(填“大于”、“小于”或“等于”),判断依据是
的键角(填“大于”、“小于”或“等于”),判断依据是
您最近一年使用:0次
2024-02-01更新
|
270次组卷
|
2卷引用:山东省德州市2023-2024学年高二上学期期末考试化学试题
解题方法
5 . 某笼形络合物 晶胞结构中,镍离子与
晶胞结构中,镍离子与 连接形成平面层,两个平面层通过
连接形成平面层,两个平面层通过 分子连接,所有N原子均参与形成配位键,苯分子填充于空隙正中心,其晶胞结构如图(H原子未画出)。回答下列问题:
分子连接,所有N原子均参与形成配位键,苯分子填充于空隙正中心,其晶胞结构如图(H原子未画出)。回答下列问题:

(1)C、N、H电负性大小顺序___________ ;晶胞中N原子的杂化方式为___________ 。
(2)晶胞中镍离子的价电子轨道表示式为___________ ,与镍同周期的元素中,基态原子的未成对电子数与镍相同的有___________ 种。
(3)已知苯环中 键长为npm,则晶胞中A号C原子的分数坐标
键长为npm,则晶胞中A号C原子的分数坐标___________ ;晶胞M中含有 键数目为
键数目为___________ 个。
(4)镍离子的配位数为___________ ,晶胞的密度为___________  (用代数式表示)。
(用代数式表示)。
 晶胞结构中,镍离子与
晶胞结构中,镍离子与 连接形成平面层,两个平面层通过
连接形成平面层,两个平面层通过 分子连接,所有N原子均参与形成配位键,苯分子填充于空隙正中心,其晶胞结构如图(H原子未画出)。回答下列问题:
分子连接,所有N原子均参与形成配位键,苯分子填充于空隙正中心,其晶胞结构如图(H原子未画出)。回答下列问题:
(1)C、N、H电负性大小顺序
(2)晶胞中镍离子的价电子轨道表示式为
(3)已知苯环中
 键长为npm,则晶胞中A号C原子的分数坐标
键长为npm,则晶胞中A号C原子的分数坐标 键数目为
键数目为(4)镍离子的配位数为
 (用代数式表示)。
(用代数式表示)。
您最近一年使用:0次
解题方法
6 . 材料是人类文明进步的阶梯,主族非金属元素是组成特殊材料的重要元素。请回答下列问题:
(1)氮氧共掺杂多孔碳材料是一种新型高效的能源存储材料,其中的三种主要元素C、N、O,电负性从小到大的顺序是_____ ,第一电离能从大到小的顺序是_____ 。
(2)根据杂化轨道理论的相关知识,在NH3、BF3、SO 、H3O+几种微粒中,中心原子杂化方式与其他三个不同的是
、H3O+几种微粒中,中心原子杂化方式与其他三个不同的是______ (填化学式);已知等电子体具有相同的空间构型,结合价电子对互斥理论可知N2O分子为______ 形。
(3)有一种配合物组成为[M(NH3)5(H2O)]Cl3,该配合物中提供孤电子对的原子是_____ (填符号);配合物T与[M(NH3)5(H2O)]Cl3组成所含微粒种类和数目相同,中心离子的配位数相同且T中也只有两种配体,若1molT溶于水,加入足量AgNO3溶液只生成2molAgCl,则T的配合物可表示为_____ 。
(4)最近发现一种由Ti原子和C原子构成的气态团簇分子如图所示,其化学式为_____ 。

(1)氮氧共掺杂多孔碳材料是一种新型高效的能源存储材料,其中的三种主要元素C、N、O,电负性从小到大的顺序是
(2)根据杂化轨道理论的相关知识,在NH3、BF3、SO
 、H3O+几种微粒中,中心原子杂化方式与其他三个不同的是
、H3O+几种微粒中,中心原子杂化方式与其他三个不同的是(3)有一种配合物组成为[M(NH3)5(H2O)]Cl3,该配合物中提供孤电子对的原子是
(4)最近发现一种由Ti原子和C原子构成的气态团簇分子如图所示,其化学式为

您最近一年使用:0次
解题方法
7 . 绿色植物是利用空气中的CO2、阳光、泥土中的水分及矿物质为自己制造食物,整个过程被称为“光合作用”,而所需的阳光被叶子内的绿色物质吸收,这种绿色有机化合物就是叶绿素,叶绿素a的结构如图所示:
(1)叶绿素a中含氧官能团的名称为_____ 。
(2)有关叶绿素a的结构与性质,下列说法中正确的是_____ 。
A.叶绿素a中碳原子杂化方式只有sp2一种
B.叶绿素a易溶于水、乙醚、乙醇等溶剂
C.叶绿素a能使酸性KMnO4溶液褪色
(3)叶绿素a的组成元素中电负性由大到小依次为_____ (用元素符号表示)。
(4)叶绿素a光解后会产生乳酸、柠檬酸等酸性物质。有机酸羧酸的电离方程式为R-COOH R-COO-+H+,其电离产生的羧酸根负离子越稳定,其相应的羧酸的酸性越强,影响羧酸根负离子稳定性的因素主要是R基团的电子效应,R基团上连有吸电子基时其酸性增强;R基团上连有供电子基时其酸性减弱。已知甲基是供电子基,卤素的吸电子效应-F>-Cl>-Br>-I,则CH3COOH、CH2FCOOH、CH2ClCOOH的酸性由强到弱依次为
R-COO-+H+,其电离产生的羧酸根负离子越稳定,其相应的羧酸的酸性越强,影响羧酸根负离子稳定性的因素主要是R基团的电子效应,R基团上连有吸电子基时其酸性增强;R基团上连有供电子基时其酸性减弱。已知甲基是供电子基,卤素的吸电子效应-F>-Cl>-Br>-I,则CH3COOH、CH2FCOOH、CH2ClCOOH的酸性由强到弱依次为_____ 。
(5)在植物体内还有一类物质吲哚乙酸也能刺激植物生长,使植物具有向光性,其结构如图所示:_____ 。
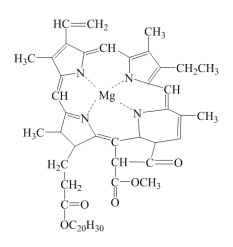
(1)叶绿素a中含氧官能团的名称为
(2)有关叶绿素a的结构与性质,下列说法中正确的是
A.叶绿素a中碳原子杂化方式只有sp2一种
B.叶绿素a易溶于水、乙醚、乙醇等溶剂
C.叶绿素a能使酸性KMnO4溶液褪色
(3)叶绿素a的组成元素中电负性由大到小依次为
(4)叶绿素a光解后会产生乳酸、柠檬酸等酸性物质。有机酸羧酸的电离方程式为R-COOH
 R-COO-+H+,其电离产生的羧酸根负离子越稳定,其相应的羧酸的酸性越强,影响羧酸根负离子稳定性的因素主要是R基团的电子效应,R基团上连有吸电子基时其酸性增强;R基团上连有供电子基时其酸性减弱。已知甲基是供电子基,卤素的吸电子效应-F>-Cl>-Br>-I,则CH3COOH、CH2FCOOH、CH2ClCOOH的酸性由强到弱依次为
R-COO-+H+,其电离产生的羧酸根负离子越稳定,其相应的羧酸的酸性越强,影响羧酸根负离子稳定性的因素主要是R基团的电子效应,R基团上连有吸电子基时其酸性增强;R基团上连有供电子基时其酸性减弱。已知甲基是供电子基,卤素的吸电子效应-F>-Cl>-Br>-I,则CH3COOH、CH2FCOOH、CH2ClCOOH的酸性由强到弱依次为(5)在植物体内还有一类物质吲哚乙酸也能刺激植物生长,使植物具有向光性,其结构如图所示:
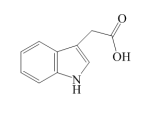
您最近一年使用:0次
2023-03-17更新
|
222次组卷
|
2卷引用:山东省德州市夏津县第一中学2023-2024学年高二下学期3月月考化学试题
名校
8 . 自然界中存在大量的金属元素,在工农业生产中有着广泛的应用。回答下列问题:
(1)下列有关微粒性质的排列顺序错误的是_____ 。
(2)基态Ni原子核外电子运动状态有_____ 种,其核外电子排布式中未成对电子数为_____ 个。
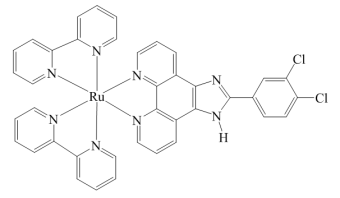
(3)钌-多吡啶配合物具有丰富的光化学和光物理信息,结构简式如图所示。钌(II)的配位数是______ ,N原子的杂化类型为______ 。
(4)氧铬酸钙是一种常见含铬矿石,其立方晶胞如图所示。
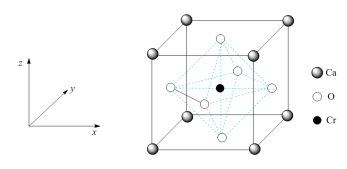
①氧铬酸钙的化学式为_____ 。
②1个钙原子与_____ 个氧原子最近且等距离。
③该晶体密度为_____ g•cm-3(列出计算式即可。已知Ca和O的最近距离为anm,NA代表阿伏加德罗常数)
(1)下列有关微粒性质的排列顺序错误的是
| A.元素的电负性:P<O<F | B.元素的第一电离能:C<N<O |
| C.离子半径:O2->Na+>Mg2+ | D.原子的未成对电子数:Mn>Si>Cl |
(3)钌-多吡啶配合物具有丰富的光化学和光物理信息,结构简式如图所示。钌(II)的配位数是

(4)氧铬酸钙是一种常见含铬矿石,其立方晶胞如图所示。

①氧铬酸钙的化学式为
②1个钙原子与
③该晶体密度为
您最近一年使用:0次
解题方法
9 . 亚铁氰化钾( )是一种常见的食盐抗结剂,其三水合物(
)是一种常见的食盐抗结剂,其三水合物(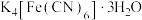 )是黄色晶体,俗称黄血盐,遇
)是黄色晶体,俗称黄血盐,遇 立即产生深蓝色沉淀(
立即产生深蓝色沉淀(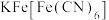 )。回答下列问题。
)。回答下列问题。
(1)O元素位于_______ 区,基态O原子核外电子的空间运动状态有_______ 种。
(2)Fe在元素周期表中的位置_______ ,基态Fe原子的价电子轨道表示式为_______ 。
(3)黄血盐(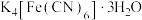 )中四种非金属元素的第一电离能最大的是
)中四种非金属元素的第一电离能最大的是_______ ,该原子能量最高的电子所在能级符号为_______ 。
(4)亚铁氰化钾( )中四种元素的电负性由大到小的顺序为
)中四种元素的电负性由大到小的顺序为_______ 。
(5)普鲁士蓝(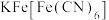 )中不同价态铁元素的简单微粒较稳定的是
)中不同价态铁元素的简单微粒较稳定的是_______ ,其原因是_______ 。
 )是一种常见的食盐抗结剂,其三水合物(
)是一种常见的食盐抗结剂,其三水合物(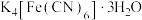 )是黄色晶体,俗称黄血盐,遇
)是黄色晶体,俗称黄血盐,遇 立即产生深蓝色沉淀(
立即产生深蓝色沉淀(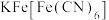 )。回答下列问题。
)。回答下列问题。(1)O元素位于
(2)Fe在元素周期表中的位置
(3)黄血盐(
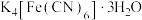 )中四种非金属元素的第一电离能最大的是
)中四种非金属元素的第一电离能最大的是(4)亚铁氰化钾(
 )中四种元素的电负性由大到小的顺序为
)中四种元素的电负性由大到小的顺序为(5)普鲁士蓝(
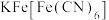 )中不同价态铁元素的简单微粒较稳定的是
)中不同价态铁元素的简单微粒较稳定的是
您最近一年使用:0次
名校
解题方法
10 . 铁系元素是指铁、钴和镍3种元素,位于元素周期表中第VIII族,均为金属元素,在工业生产中有重要的作用。
(1)基态铁元素的原子核外电子占据的轨道数目共_______ 个,基态钴元素的价电子排布式为_______ 。
(2)铁系元素常常能和许多配位体形成配合物。
①若一个配位体含有两个或两个以上的能提供孤电子对的原子,这种配位体就叫多齿配位体,其中有一个能提供孤电子对的原子为一齿,(羰基中的氧原子不能提供孤对电子),EDTA( )是
)是_______ 齿配位体,与铁离子形成配合物时的配位原子为_______ ,EDTA中所含元素的电负性由大到小的顺序为:_______ 。
②铁系元素形成的很多配合物有特殊的颜色,可用于鉴定铁系元素。用 检验
检验 时,若有
时,若有 存在会产生干扰,可加入掩蔽剂NaF,
存在会产生干扰,可加入掩蔽剂NaF, 与
与 结合形成更稳定无色配离子
结合形成更稳定无色配离子 ,该配离子的空间构型为:
,该配离子的空间构型为:_______ 。
(3)铁与镁组成的其中一种储氢合金的晶胞结构如图所示,其中铁原子和镁原子最近的距离是为a nm, 代表阿伏加德罗常数。
代表阿伏加德罗常数。

图中a处原子的坐标参数为_______ ,合金的密度为_______  。(列计算式)
。(列计算式)
(1)基态铁元素的原子核外电子占据的轨道数目共
(2)铁系元素常常能和许多配位体形成配合物。
①若一个配位体含有两个或两个以上的能提供孤电子对的原子,这种配位体就叫多齿配位体,其中有一个能提供孤电子对的原子为一齿,(羰基中的氧原子不能提供孤对电子),EDTA(
 )是
)是②铁系元素形成的很多配合物有特殊的颜色,可用于鉴定铁系元素。用
 检验
检验 时,若有
时,若有 存在会产生干扰,可加入掩蔽剂NaF,
存在会产生干扰,可加入掩蔽剂NaF, 与
与 结合形成更稳定无色配离子
结合形成更稳定无色配离子 ,该配离子的空间构型为:
,该配离子的空间构型为:(3)铁与镁组成的其中一种储氢合金的晶胞结构如图所示,其中铁原子和镁原子最近的距离是为a nm,
 代表阿伏加德罗常数。
代表阿伏加德罗常数。
图中a处原子的坐标参数为
 。(列计算式)
。(列计算式)
您最近一年使用:0次
2022-07-13更新
|
199次组卷
|
2卷引用:山东省德州市2021-2022学年高二下学期期末考试化学试题



